Обоснование применения антагонистов NMDA-рецепторов для лечения лекарственной зависимости
Значительный экспериментальный материал, накопленный к настоящему времени, убедительно свидетельствует в пользу ослабления лекарственной зависимости под влиянием антагонистов NMDA-рецепторов. Результаты исследований in vivo и in vitro показали повышение глутаматергической передачи в период опиатной абстиненции (Hong et al., 1993; Rasmussen, 1995; Sepulveda et al., 1998).
Чтобы подтвердить роль глутаматных рецепторов в экспрессии опиатного синдрома отмены, абстинентные реакции можно преципитировать инъекцией не только опиатного антагониста, но и глутамата. Токуяма с коллегами (Tokuyama et al., 1996) обнаружили, что у животных, которым в течение нескольких дней постоянно вводили морфин или буторфанол, внутрижелудочковое введение глутамата способствует появлению различных абстинентных реакций. Эти данные указывают на участие глутаматных рецепторов в генезе острых абстинентных реакций, но не доказывают вовлечение в процесс NMDA-рецепторов. Введение агонистов NMDA-рецепторов

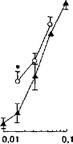
(NMDA и глицин) животным, зависимым от морфина, не приводит к достоверному развитию каких-либо заметных признаков абстинентного синдрома, но потенцирует эффекты преципитирующей инъекции налоксона (рис. 4.13'; Dravolina et al, 19996).
В экспериментах in vitro получены аналогичные результаты. Например, на изолированном препарате подвздошной кишки крыс, подвергшейся длительной инкубации в растворе с морфином, контрактильные свойства глутамата были значительно усилены. Усиление эффектов глутамата, видимо, отражает повышенную чувствительность NMDA-рецепторов, так как антагонисты NMDA-рецепторов блокировали контрактильные свойства налоксона (Yukhananov, Larson, 1994a).
Большинство примеров основано на данных исследования опиатной зависимости, однако длительное введение этанола также повышает чувствительность к стимуляции NMDA-рецепторов, что проявляется большей нейротоксичностью NMDA при локальном введении в гиппокамп (Davidson et al., 1993,1995). Несмотря на это, свойства этанола как антагониста NMDA-рецепторов заставляют предполагать отличия алкогольного абстинентного синдрома от синдрома отмены других нейроактивных веществ, таких как, например, морфин. Повторные введения этанола (Grant et al., 1990; Snell et al., 1993; Trevisan et al., 1994; Follesa, Ticku, 1996; Snell et al., 1996), так же как и антагонистов NMDA-рецепторов (McDonald et al., 1990; Williams et al., 1992; Sanner et al., 1994; Lason et al., 1997; Wang et al., 1999a), приводят к "ир"-регуляции NMDA-рецепторного комплекса. В то же время морфиновый абстинентный синдром
характеризуется снижением уровней связывания [3Н]дизоцилпина (Bhargava et al 1995). "Down''-регуляция рецепторов обычно наблюдается при длительном воздействии агонистов, что указывает на избыточную стимуляцию NMDA-рецепторов у животных, зависимых от морфина. Гиперактивность NMDA-рецепторов может быть следствием не только чрезмерного высвобождения глутамата, но и повышенной эффективности стимуляции рецептора агонистом. Существуют экспериментальные данные, доказывающие оба возможных пути появления гиперактивности NMDA- рецепторного комплекса при опиатном абстинентном синдроме.
Как экспрессия рецепторов, так и высвобождение эндогенных медиаторов очень сложно организованы. Этим объясняется тот факт, что сведения по механизмам формирования и проявления лекарственной зависимости полны, казалось бы, неразрешимых противоречий. Механизмы обратной связи практически любой системы включаются при малейшем отклонении от состояния покоя, и адаптивные гетеросистемные изменения нередко принимаются за первичные, причинные, ведущие к появлению толерантности и зависимости. Например, при длительном воздействии этанола экспрессия АМРА-подтипа глутаматных рецепторов может снижаться, что связывают с неспецифической адаптивной перестройкой в ответ на изменения в NMDA-рецепторном комплексе (Ulrichsen et al., 1996). Другой типичный пример — регуляция активности фермента NO-синтетазы.
Ингибиторы NO-синтетазы вызывают большинство эффектов, свойственных антагонистам NMDA-рецепторов, таких как ослабление проявлений синдрома отмены опиатов, этанола, никотина (Adams et al., 1993; Thorat et al., 1994; Hall et al., 1996; Vaupel et al., 1997; Adams, Cicero, 1998a). Более того, донорам NO приписывают способность усиливать проявления опиатного и алкогольного абстинентных синдромов (Adams et al., 1993; Adams, Cicero, 19986; Medvedev et al., 1999).
Активация NO-синтетазы — лишь одно из пострецепторных явлений, следующих за активацией NMDA-рецепторов. В регуляции синаптической пластичности и эффективности глутаматергической передачи оксид азота играет двоякую роль (см. гл. 1.5.4). С одной стороны, образование NO повышается при стимуляции NMDA-рецепторов (Rivot et al., 1999), а возбуждающие эффекты NMDA на нейронную активность в голубом пятне значительно уменьшаются при сочетанном применении ингибиторов NO-синтетазы (Hall et al., 1998). Соответственно, некоторые эффекты блокады NMDA-рецепторов воспроизводятся веществами, угнетающими NO-синте- тазу. С другой стороны, NO оказывает угнетающее действие на пре- и постсинаптические глутаматные рецепторы (механизм отрицательной обратной связи) и, например, предотвращает нейротоксическое действие NMDA (Lipton et al., 1994). Поэтому доноры NO замедляют, а ингибиторы NO-синтетазы ускоряют развитие опиатной толерантности и зависимости (Dambisya, Lee, 1996). Как следствие, существуют противоречивые данные об эффектах модуляторов системы NO на системном уровне. Например, ингибиторы NO-синтетазы блокируют развитие сенситизации к стимулирующим эффектам кокаина (Pudiak, Bozarth, 1993), но не амфетамина (Stewart et al., 1994). Причина появления столь противоречивых сообщений не обязательно кроется в различиях механизмов действия кокаина и амфетамина, а скорее, в пока что несопоставимых отличиях методик экспериментов.
Точная локализация "причинных" изменений в системах первичных (рецепторы) и вторичных посредников пока что не известна. Длительное введение различных ней
роактивных веществ не обязательно должно проявляться повышением аффинности или уровней экспрессии субъединиц NMDA-рецепторного комплекса. Например, как для опиатов, так и для этанола существуют данные об "ир"-регуляции и отсутствии изменений в NMDA-рецепторном комплексе (Morrow et al., 1994; Ulrichsen et al., 1996). В одной из работ проследили концентрации мРНК и самого белка субъединиц NMD A- рецептора у животных, у которых была выработана физическая зависимость от этанола (судороги при отмене этанола; Snell et al., 1996). Было установлено, что уровни белка, но не мРНК для субъединиц NR1 и NR2 А были значительно повышены.
Таким образом, становится очевидным, что для дальнейшего исследования механизмов лекарственной зависимости необходим целостный, концептуальный подход, основанный на общем представлении о гетеро- и гомосистемной адаптации, а не на разрозненных данных об изменениях в том или ином компоненте системы. По аналогии с предполагаемыми механизмами формирования толерантности (см. гл. 3.3) лекарственная зависимость может иметь механизмы, основанные на повышении функциональной активности NMDA-рецепторного комплекса. Необходимо пояснить, в чем же существенное отличие такой формулировки. Дело в том, что повышенная функциональная активность, в первую очередь, проявляется гиперчувствительностью к агонистам, которая становится заметной спонтанно (в состоянии покоя) или при стимуляции (абстинентный синдром, введение агонистов и т. д.). В зависимости от того, насколько выражены механизмы отрицательной обратной связи для данной системы, функциональная гиперактивность рецепторного комплекса проявится или, наоборот, не проявится в "down''-регуляции (Bhargavaet al., 1995; снижение аффинности, плотности рецепторов, уровней экспрессии мРНК, синтеза белка и т. д.) или десенситизации рецепторов (Kogan, Aghajanian, 1995). Судя по всему, в разных областях мозга и для разных нейрохимических систем выраженность этой обратной связи различается, что ведет к неодинаковым результатам. Отчасти это многообразие оправдывается разнообразием субъединичного состава рецепторов и систем сопряжения со вторичными посредниками.
Если исходить из того, что функциональная гиперактивность NMDA-рецепторного комплекса — один из ключевых факторов или путей формирования зависимости, то следует обратить внимание на то, что практически все экспериментальные данные указывают именно на функциональную природу перестройки. Например, при некоторых режимах введения становится очевидным, что длительное введение этанола влечет за собой повышение способности NMDA стимулировать накопление N0, в то время как количественные параметры связывания лигандов с NMD А-рецеп- торами не меняются (Chandler et al., 1997). У животных, зависимых от морфина, абстинентный синдром характеризуется стимуляцией активности Са2+-зависимой NO- синтетазы, и это повышение активности предупреждается введением антагониста NMDA-рецепторов (Lizasoain et al., 1996; см. также Hall et al, 1998).
Дальнейшее обсуждение гипотетических механизмов формирования зависимости проще вести на примере опиатной зависимости. Наибольшее количество данных касается опиатной и алкогольной зависимости. Однако для этанола рецепторные механизмы слишком сложны, так как затрагивают сразу несколько нейромедиаторных систем (Faingold et al., 1998).
При поиске механизмов опиатной зависимости уже многие годы исходят из диаметральной противоположности острых эффектов стимуляции опиатных рецепторов
и признаков опиатного абстинентного синдрома. Снижение моторики ЖКТ при остром введении и диарея при отмене морфина после длительного введения — лишь один из многочисленных примеров. При однократном введении морфин угнетает пресинаптическое высвобождение глутамата (Coutinho-Netto et al., 1980; Crowder et al., 1986). Опиатный абстинентный синдром, преципитированный инъекцией налоксона, сопровождается повышением внеклеточной концентрации глутамата в ряде структур головного мозга, таких как голубое пятно (Aghajanian et al., 1994; Zhang et al., 1994). Известно, что в ряде структур головного мозга (Van Bockstaele, Colago, 1996), а также в спинном мозге (см. гл. 2.6.1) NMDA-рецепторы могут находиться пресинаптически, принимая самое непосредственное участие в регуляции высвобождения. Таким образом, повышение выброса различных медиаторов при отмене опиатов после хронического введения связано с повышенной функциональной активностью NMDA-рецепторов. Пресинаптическая локализация NMDA-рецепторов, задействованных в механизмах формирования лекарственной зависимости, объясняет ряд отрицательных результатов, полученных в экспериментах по экспрессии опиатного абстинентного синдрома. Например, деполяризация нейронов ЦОВ, вызванная отменой субхронического введения морфина, не блокируется антагонистами NMDA-рецепторов (Chieng, Christie, 1996).
Повышение функциональной активности NMDA-рецепторов, скорее всего, происходит по вышеописанному механизму (см. гл. 3.3.1). Острое введение опиатных агонистов (и возможно других нейроактивных веществ) способствует фосфорилированию внутриклеточных доменов или структурных белков, которые участвуют в кластеризации NMDA-рецепторов. Именно поэтому эффекты антагонистов NMDA-рецепторов воспроизводятся введением ингибиторов протеинкиназ. Например, вызываемое налоксоном повышение высвобождения норадреналина в мосту и продолговатом мозге животных, зависимых от морфина, ослабляется как ингибитором протеинкиназ Н-7, так и дизоцилпином (Makimura et al., 1997). Более того, есть прямые свидетельства активации протеинкиназ А и С при длительном введении морфина, чему препятствует сочетанное введение с морфином антагонистов NMDA- рецепторов (Makimura et al., 1997). Активаторы протеинкиназ (форболовые эфиры) потенцируют эффекты стимуляции NMDA-рецепторов, а блокаторы (сфингозин, Ro 31-8220, стауроспорин) — блокируют. Установлено, что протеинкиназная активность не просто потенцирует, но является необходимым условием для стимуляции NMDA-рецепторов (Murphy et al., 1994).
При стимуляции опиатных рецепторов (например морфином) возможны несколько альтернативных путей изменения клеточного гомеостаза (рис. 4.14; Nestler, Aghajanian, 1997; Ingram et al., 1998). Посредством ингибиторных G-белков (G,, чувствительны к коклюшному токсину) активация опиатного рецептора приводит к: а) усилению фосфолипазной (Аз) активности и повышению проницаемости клеточной мембраны для К+ (канал, чувствительный к блокаде 4-аминопиридином и дендротоксином); б) угнетению аденилатциклазы; в) активации протеинкиназ и переходу NMDA-рецепторов в более активное состояние. Фосфолипазный (аденилатциклаз- ный) и протеинкиназный пути в конечном итоге приводят к прямо противоположным изменениям в нейронной активности, проведении импульса и высвобождении нейромедиаторов.
Схема, представленная на рис. 4.14, принципиально отличается от моделей, предложенных в других работах (Nestler, Aghajanian, 1997; Ingram et al., 1998). Наиболее
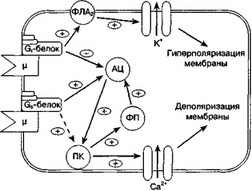
Рис. 4.14. Гипотетическая схема взаимодействия эффектов стимуляции опиатного и NMDA- рецепторов (объяснения в тексте), ц — опиатный рецептор, опосредующий эффекты морфина; АЦ — аденилалциклаза; ФЛА2 — фосфолипаза А,; ПК—протеинкиназы; ФП — фосфо- протеины. Пунктирной линией обозначена связь, существование которой еще недостаточно исследовано и которая, возможно, подразумевает одну систему внутриклеточных посредников или более
существенное отличие заключается в том, что многие авторы считают фосфолипазный путь механизмом развития острых эффектов опиатов, а аденилатциклазный и протеинкиназный пути — механизмами развития хронических эффектов. Такое разделение основано на том, что ингибиторы аденилатциклазы и протеинкиназ не влияют на острые эффекты морфина, что предполагает меньшую значимость этого пути в нормальных условиях. Однако предлагаемая нами схема указывает на оба пути как на альтернативные механизмы реализации острых эффектов опиатов. Во-первых, как уже отмечалось, однократное введение морфина вызывает не только гипоалге- зию (т. е. острый эффект опиатов, согласно Ingram et al, 1998), но и гипералгезию. Гипералгетическое действие опиатов (в традиционных дозировках) проявляется позже, чем гипоалгетическое. Временная диссоциация этих эффектов опиатов может иметь различные причины, о которых трудно судить на основании имеющихся данных. Например, можно было бы предположить, что активация протеинкиназного пути занимает больше времени, чем таковая фосфолипазного пути. Острая активация фосфолипазного пути противодействует стимуляции протеинкиназ, и поэтому временной фактор играет определяющую роль в формировании повышенной активности протеинкиназ. Активность протеинкиназ (например протеинкиназы А) накапливается со временем благодаря стимуляции регуляторных фосфопротеинов (например белок, связывающий цАМФ-зависимый элемент) и аденилатциклазы, которая в свою очередь стимулирует протеинкиназы (положительная обратная связь).
Известно, что в очень малых концентрациях морфин оказывает не тормозное, а возбуждающее действие (Cram et al., 1988; Crain, Shen, 1990). Эти парадоксальные данные, на наш взгляд, убедительно свидетельствуют о том, что стимуляция протеинкиназной активности и гипералгетическое действие опиатов являются острыми (!) эффектами. Более того, возбуждающее действие опиатных агонистов проявляется даже в условиях блокады К+-каналов (Cram, Shen, 1990).
Возбуждающие эффекты опиатных агонистов в большей степени выражены после хронической стимуляции опиатных рецепторов, что указывает, с одной стороны, на возможность прогрессивного накопления гиперактивности NMDA-рецепторов, а с другой стороны — на родство механизмов острых возбуждающих эффектов опиатов и адаптационных процессов при длительном применении опиатных агонистов. Кроме того, становится понятным, почему развитие толерантности и зависимости считается непрерывным процессом, запускаемым уже первой инъекцией опиата (Eisenberg, 1982). Выраженность этого процесса находится в прямой зависимости от продолжительности и эффективности лиганд-рецепторного взаимодействия (Goldstein, Schultz, 1973).
Существует вероятность того, что возбуждающие и тормозные эффекты опиатов опосредованы различными подтипами опиатных рецепторов. Для д-опиатных рецепторов предполагали наличие двух подтипов — ц) и \х2- Однако такое подразделение не подтверждается данными генетического анализа (Akil et al., 1998). Тем не менее существуют убедительные свидетельства того, что опиатные рецепторы сопряжены не только с тормозными G,-белками, но и с возбуждающими Gs. Эти исследования основывались на данных о возбуждающем действии опиатных агонистов на сенсорные нейроны спинного мозга (Cram et al., 1988; Crain, Shen, 1990). Было обнаружено, что для разных агонистов опиатных рецепторов способность оказывать возбуждающее действие неодинакова и может коррелировать с вероятностью развития толерантности и зависимости при длительном введении. Например, в отличие от морфина эторфин оказывает гораздо меньшее возбуждающее действие (Crain, Shen, 1996; Shen, Crain, 1997) и, судя по последним данным, не вызывает толерантности и зависимости при повторном введении (Aceto et al., 1997).
В предлагаемой схеме сознательно упрощено представление процессов, задействованных при остром и хроническом введении опиатов. Это необходимо ввиду комплексного характера регуляции клеточного гомеостаза, примеры чего уже приводились выше. Достаточно лишь добавить, что аденилатциклазная активность снижается при остром введении опиатов, а при длительном введении может наблюдаться обратный эффект (Sharma et al., 1977; Duman et al., 1988). Являются ли эти изменения в аденилатциклазной активности причинными для проявления толерантности и зависимости? Есть все основания полагать, что эти изменения в аденилатциклазной активности довольно неспецифические и на самом деле просто отражают попытки организма удержать равновесие на клеточном уровне.
Еще один важный вопрос, который требует короткого разъяснения: почему "причинные" адаптивные изменения происходят в протеинкиназном, а не в фосфолипазном пути? Скорее всего, потому что NMDA-рецепторы сопряжены именно с протеинкиназным путем. Как уже неоднократно подчеркивалось, одной из основных физиологических функций NMDA-рецепторов является участие в механизмах, обеспечивающих хранение информации на клеточном уровне (в широком смысле). В то же время опиатный рецептор оказывает двойное воздействие на аденилатцик- лазу — непосредственное угнетение и опосредованную активацию (протеинкиназы, фосфопротеины). При продолжающемся воздействии агониста на рецептор баланс
этих двух влияний смещается в сторону активации, что выражается в гипервозбудимости нейрона.
Таким образом, так же как и для развития толерантности к эффектам фармакологических средств (в первую очередь опиатов), в качестве универсального механизма ' лекарственной зависимости может выступать функциональная гиперактивность NMDA-рецепторов. Отдельно заметим, что условнорефлекторные механизмы, описанные в гл. 3.1.1.2 и 3.3.3, также вносят существенный вклад в развитие и проявление зависимости, так как функциональная гиперактивность NMDA-рецепторов становится безусловнорефлекторной реакцией, которая вступает в пространственновременные связи со стимулами окружающей среды и, возможно, с другими эффектами самого вещества (см. гл. 3.3.3).
Во многом благодаря условнорефлекторным механизмам повторные абстинентные состояния ведут к прогрессивному усилению симптоматики (Ibuki et al., 1997; Dunbar, Pulai, 1998; Dunworth, Stephens, 1998). Однако накопление функциональной гиперактивности NMD А-рецепторного комплекса ни в коей мере не является только условнорефлекторным явлением и может наблюдаться в условиях экспериментов in vitro (Ulrichsen et al., 1996). В любом случае, как и следовало бы ожидать исходя из предлагаемой модели, антагонисты NMDA-рецепторов предотвращают усиление абстинентной симптоматики, сопровождающее повторные отмены опиатов и бензо- диазепинов (Dunbar, Pulai, 1998; Dunworth, Stephens, 1998).
Источник: Беспалов А. Ю., Звартау Э. Э., «Нейропсихофармакология антагонистов NMDA-рецепторов» 2000