МАКРОЛИДЫ
Антибиотики, молекулы которых содержат крупные алифатические лактоны, называют макролидами. Они делятся на два класса с совершенно ;разными биологическими свойствами и структурой: антибактериальные макролиды и противогрибковые макролиды, известные также под названием полиены.
А. АНТИБАКТЕРИАЛЬНЫЕ МАКРОЛИДЫ
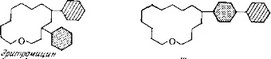
Эта группа в химическом отношении характеризуется меньшим размером лактонных колец, содержащих от 12 до 16 атомов (рис. 5.26), а в биологическом — механизмом действия, со-
Олеандомицин
Лейхомицин
Мозамицин
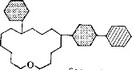
Рис. 5.26. Схематическое изображение структуры антибиотиков-макролидов, используемых в клинике. Светлые кольца — лактоииые кольца; заштрихованные кольца — аминосахара; затененные кольца — сахара. Остальные заместители и гликозидные связи не показаны.
Спирамицин
стоящим в специфическом подавлении синтеза белка в клетках бактерий в результате образования комплекса с бОЭ-субчасти- цами рибосом.
Лактонное кольцо имеет метильные и гидроксильные заместители в различных положениях. Обязательно присутствует по крайней мере один сахарный остаток, обычно в положении 5, а зачастую имеется и второй — в положении 3. Макролиды могут иметь или нейтральный, или основный характер; это зависит от природы сахарных остатков, которые бывают представлены простыми сахарами или аминосахарами (последние встречаются значительно чаще). Спектр антибактериального действия макролидов напоминает спектр действия пенициллина G; они обладают достаточно высокой активностью в отношении грамположительных и некоторых грамотрицательных кокков. За некоторыми исключениями, обсуждающимися ниже, наблю-
Таблица 5.2. Активность макролидных антибиотиков в отношении некоторых бактерий
|
Тест-организмы |
МПК, мкг/мл |
||||
|
Олеандо- мнцин |
Эритроми цин |
Спирамицин |
К(итаэа- мицнн |
Жозамнцнн |
|
|
S. aureus |
0,5 |
0,2 |
2 |
0,4 |
0,4 |
|
S. pyogenes |
0,2 |
0,02 |
0,2 |
0,4 |
0,2 |
|
S. pneumoniae |
0,2 |
0,1 |
0,2 |
0,04—0,2 |
0,8 |
|
Mycoplasma |
|
|
|
|
|
|
pneumoniae |
0,6 |
0,1 |
0,6 |
0,3 |
0,03 |
дается перекрестная устойчивость к различным макролидам, а также к линкомицину.
Некоторые из макролидов нашли применение в клинике. Это эритромицин, карбомицин (теперь не используется), олеандоми- цин, спирамицин, китазамицин (или лейкомицин) и новый антибиотик жозамицин. В ветеринарии широко используется тило- зин, активный в отношении микоплазм. Антибактериальная активность основных макролидов представлена в табл. 5.2.
- ЭРИТРОМИЦИН
Этот макролидный антибиотик используется наиболее широко. Он был выделен в 1952 г. из культуры Streptomyces erythre- us в форме комплекса трех очень близких компонентов, эритро- мицинов А, В и С, из которых основной и'наиболее активный — эритромицин А (рис. 5.27). Структура эритромицина А типична для макролидов; она содержит кольцо из 14 атомов, без двойных связей, с метильными группами при четных атомах углерода и. с карбонильной группой в положении 9. В положении 5 находится заместитель дезозамин, а в положении 3 — клади- ноза.
Эритромицин очень активен в отношении грамположительных организмов и используется для лечения заболеваний, вызываемых стрептококками и пневмококками. Он менее активен в отношении стафилококков, которые часто устойчивы к нему. In vitro эритромицин активен в отношении грамотрицательных бактерий, например Е. coli, но эта активность слишком мала для терапевтического действия. Эритромицин обычно принимают внутрь, но одной из проблем являются индивидуальные различия в характере его всасывания, поскольку он не слишком стабилен в кислой среде (первый макролид, использовавшийся в клинике, карбомицин, не нашел применения именно из-за плохого всасывания). С другой стороны, лекарственные формы для внутримышечного введения, например этилсукцинат эритроми
цина, тоже нельзя признать удовлетворительными, поскольку их введение болезненно. Чтобы повысить уровень антибиотика в крови (который после перорального введения эритромицина- основания составляет менее 0,5 мкг/мл), часто используют лау- рилсульфат пропионового эфира эритромицина, эритромицин- эстолат. Это производное позволяет достичь по крайней мере в три раза более высоких концентраций антибиотика в крови, однако, поскольку пропионовый эфир неактивен, учитывать можно только фракцию, гидролизуемую in vivo, а количественные
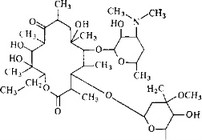
СНз
Рис. 5.27. Эритромицин А.
оценки здесь провести трудно. Кроме того, цри использовании эстолата (и только эстолата) наблюдаются случаи токсического действия на печень, которые, по всей вероятности, являются следствием повышенной чувствительности.
а. Связь между структурой и активностью
Получено несколько полусинтетических производных эритромицина и исследована их активность в сравнении с природными эритромицинами. Показано, что 1) оба гликозильных заместителя необходимы для активности; 2) модификации дезозамина, в особенности модификации аминогруппы, приводят к инактивации, возможно, потому, что эта группа принимает участие в связывании с рибосомами (сложные эфиры по соседней гидроксильной группе в положении 2' неактивны in vitro, но активны in vivo, так как они легко гидролизуются); 3) по-видимому, кладино- за не участвует непосредственно в связывании с рибосомами; эту часть молекулы можно частично модифицировать без потери активности; 4) в результате модификации функциональных групп в положениях лактонного кольца от 9 до 12, восстановления или замещения карбонильной группы, отщепления гидроксильной
группы при 12-м атоме углерода, ацетилирования по положению 11 получаются продукты, обладающие некоторой активностью.
б. Устойчивость
Описаны два типа мутантов, устойчивых к эритромицину.
- Мутанты, устойчивость которых связана с изменением одного рибосомного белка. Такие мутанты обнаружены у нескольких видов бактерий и устойчивы не только к эритромицину, но и к другим макролидам и к линкомицину.
- Мутанты, устойчивость которых связана с изменением (метилированием) рибосомной РНК. Это изменение индуцируется небольшими количествами эритромицина или олеандо- мицина, но не других макролидов. Бактерии с метилированной РНК устойчивы ко всем макролидам и к линкомицину, но при удалении из культуры индуктора мутант становится восприимчивым. Этот тип устойчивости обнаружен только у стафилококков.
- ОЛЕАНДОМИЦИН
Олеандомицин был получен в 1954 г. из культуры Streptomy- ces antibioticus. Это макролид, близкий эритромицину по структуре и по биологическим свойствам. Олеандомицин принимают внутрь в ацетилированной форме (триацетилолеандомицин), которая всасывается лучше, чем природный антибиотик. Олеандомицин имеет ограниченное применение, поскольку он не обладает преимуществами перед эритромицином и в целом менее активен.
- СПИРАМИЦИН, ЛЕЙКОМИЦИН (КИТАЗАМИЦИН),
ЖОЗАМИЦИН
Это макролиды с лактонными кольцами из 16 атомов, содержащие, как и другие представители этого класса, ацетальдегид- ную группу в положении 6 и одну пару сопряженных двойных связей в кольце. В положении 5 у них находится дисахарид (рис. 5.26). Спирамицин (рис. 5.28) отличается от других антибиотиков наличием дополнительного аминосахара в положении 9. Лейкомицин представляет собой смесь нескольких компонентов; основные из них — лейкомицин Ai (рис. 5.28), полученный в 1953 г., и спирамицин, полученный в 1955 г. Жозами- цин очень близок, а возможно, и идентичен лейкомицину А3, но он был независимо получен из другого продуцента в 1964 г.
Антибактериальные спектры действия этих антибиотиков близки спектру действия эритромицина. Они более устойчивы в
кислой среде, но немного менее активны при классической экспериментальной септицемии при приеме внутрь.
Описываемые антибиотики были внедрены в медицинскую практику е некоторых странах благодаря своей активности в отношении стафилококков, ставших устойчивыми к эритромицину. Все другие штаммы обладают перекрестной устойчивостью к этим антибиотикам и к другим макролидам.
ch^n^ch3
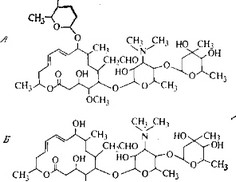
OCHj
Рис. 5.28. А — спирамицин к. Б — лейкомиции Ai (китазамицин).
Исследования по химической модификации показали, что активные продукты могут быть получены после восстановления двух двойных связей или после гидролиза второго сахарного остатка. Восстановление альдегидной группы уменьшает активность, однако ее превращение в гидразон происходит без какого-либо уменьшения исходной активности.
- НЕРЕШЕННЫЕ ПРОБЛЕМЫ
Побочные эффекты при приеме макролидов наблюдаются нечасто и обычно бывают слабыми. Основными проблемами при практическом использовании антибиотиков этого класса, очевидно, являются их плохое всасывание и распространение устойчивых штаммов. Проблему всасывания можно решить, получая полусинтетические производные или выделяя новые природные макролиды, активный поиск которых продолжается.
Надежд на получение производных с повышенной активностью в отношении устойчивых штаммов очень мало, и вряд ли будут предприняты серьезные попытки расширить спектр действия макролидов.
Б. ПРОТИВОГРИБКОВЫЕ МАКРОЛИДЫ (ПОЛНЕНЫ)
Эти макролиды характеризуются очень большими размерами лактонного кольца (от 26 до 38 атомов) и наличием системы сопряженных двойных связей (от 3 до 7), поэтому в целом их называют полиенами, в частности триенами, тетраенами и т. д.
Свойством, общим для всех соединений этого класса, является наличие у атомов кольца нескольких гидроксильных групп в положениях напротив двойных овязей. (см.,например, структуру
ОН
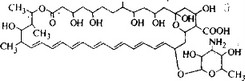
Рис. 5.29. Амфотерицин В.
амфотерицина В, рис. 5.29), так что молекула имеет две разные области — гидрофильную и гидрофобную — и является поэтому поверхностно-активным веществом. Другими заместителями являются карбоксильная группа и сахар микозамин.
Для полиенов типична активность ib отношении грибов, иногда в отношении некоторых простейших, и только в исключительных случаях они действуют на бактерии. Это объясняется механизмом их действия, заключающимся в изменении функционирования и целостности клеточной мембраны в результате образования комплексов со стеринами, компонентами мембран клеток эукариот.
Антимикробная активность увеличивается с увеличением числа сопряженных двойных овязей. Чтобы ответить на вопрос, увеличивается ли токсичность, которая достаточно высока, с увеличением активности, необходимы дополнительные данные.
Соответствие между гемолитической активностью полиенов и их противогрибковой активностью отсутствует. Некоторые полнены используются для лечения инфекционных заболеваний кожи и слизистых оболочек, а также кишечника, поскольку после приема внутрь они не всасываются. К таким полиенам относятся пимарицин, трихомицин, кандицидин и нистатин. Последний используется наиболее широко. Нистатин — тетраен, но как по размерам кольца, так и по другим особенностям структуры он весьма напоминает гептаены.
- АМФОТЕРИЦИН В
Это гептаен (рис. 5,29) с кольцом из 38 углеродных атомов, образуемый культурой Streptomyces nodosus. Он очень активен в отношении некоторых патогенных грибов и используется внутривенно для лечения тяжелых генерализованных микозов. Ам- фотерицин В используют только по жизненным показаниям, поскольку он очень токсичен, главным образом для почек, и часто вызывает их необратимые поражения. Местное или пероральное применение менее опасно. Известно, что при приеме внутрь ам- фотерицин В снижает всасывание холестерина, образующего комплекс с антибиотиком в тонком кишечнике.
- ХИМИЧЕСКИЕ МОДИФИКАЦИИ
Обычно полагают, что активность и токсичность полиенов обусловлена одними и теми же особенностями структуры, поэтому попытки улучшить химиотерапевтический индекс этих препаратов путем химических модификаций были весьма немногочисленны. Однако недавно появилось сообщение, что метиловые эфиры амфотерицина и других макролидов сохраняют противогрибковую активность и в виде растворимых в воде гидрохлоридов должны быть менее токсичными.
- УСТОЙЧИВОСТЬ
Хотя в лаборатории получают штаммы, устойчивые к полие- новым макролидам (причем они обладают перекрестной устойчивостью к разным полиенам), в клинической практике эта проблема пока не возникает. У устойчивых штаммов изменена структура клеточной мембраны.
Источник: Ланчини Д., Паренти Ф., «Антибиотики. Пер. с англ. — М.: Мир. — 272 с., ил.» 1985