Одной из областей клинической и фундаментальной медицины, претерпевшей наиболее значительную эволюцию в свете новейших достижений молекулярной генетики, является онкология. Согласно современным представлениям, большинство онкологических заболеваний обусловлены определенным каскадом спонтанных соматических мутаций в генах, контролирующих различ
ные фазы клеточного деления и дифференцировки; в ряде случаев аналогичный механизм опухолевой трансформации инициируется хромосомными перестройками, вирусной интеграцией в геном или менделевским наследованием генной мутации [Фогель Ф., Мотульски А., 1990; Гарькавцева Р.Ф., Гарькавцев И.В., 1999; KnudsonA., 1977; Vogel F., 1979; Yunis J., 1983; Bishop J., 1991]. Конечным результатом является нарушение равновесия в сложной полигенной системе, состоящей из ингибиторов и активаторов клеточного цикла, результатом чего является приобретение клеткой и соответствующим клеточным клоном способности к неконтролируемой пролиферации [Фогель Ф.. Мотульски А., 1990; Гарькавцева Р.Ф., Гарькавцев И.В., 1999; Bishop J., 1991]. Как и при других мультифакториальных заболеваниях, в возникновении опухоли важная роль принадлежит сре- довым факторам, определяющим, в частности, конкретные особенности мутагенеза в генах-мишенях. Все указанные механизмы имеют универсальный характер и напрямую применимы к нейроонкологии, что находит свое отражение во внедрении в практику новых методов ДНК- анализа при опухолях центральной и периферической нервной системы. Это будет проиллюстрировано на примере некоторых наиболее распространенных видов первичных опухолей мозга.
11аиболее частой разновидностью первичных опухолей мозга как в детском, так и во взрослом возрасте являются астроцитомы. По степени злокачественности они традиционно классифицируются на ряд стадий (астроцитома, анапластическая астроцитома, мультиформ- ная глиобластома) - в зависимости от гистологических особенностей, отражающих наличие митозов, некроза, ядерных и цитоплазматических атипий, эндотелиальной пролиферации в ткани опухоли [Fetell М., 1995]. Переход от одной стадии к другой сопровождается последо-
вательной серией генетических изменений в опухолевых клетках [Cavenee W., 1992].
Одним из важнейших генов, играющих роль супрессора опухоли, является ген р53, локализованной на коротком плече 17-й хромосомы [Bogler О. et al., 1995]. Белковый продукт гена р53 ответственен за реализацию разнообразных клеточных функций, включая контроль цикла клеточного деления, репарацию ДНК и стабильность генома; он действует как фактор транскрипции через взаимодействие со специфическими последовательностями ДНК генов-мишеней Мутации, вовлекающие ген р53, обнаруживаются в опухолевых клетках приблизительно в 40% всех астроцитом, особенно у лиц ранне-взрослого возраста [Hill J. et al., 1999]. Чаще всего у больных имеет место делеция гена р53 на одной из гомологичных хромосом в опухолевом клеточном клоне; в результате этого в опухолевых клетках остается лишь одна копия гена р53, что проявляется феноменом потерн гетерозиготности при исследовании ткани опухоли. Выявление повреждения генар53 имеет несомненное прогностическое значение, поскольку данный ген опосредует реакцию опухоли в ответ на проведение лучевой терапии [Haas-Kogan D. et al., 1999].
Последующая эволюция астроцитарной опухоли включает в себя ряд дальнейших генетических изменений клеток опухолевого клона, схематично представленных на рис. 72. Делеции гена RB1 на хромосоме 13q (данный ген кодирует белок pRB, подавляющий клеточный рост), а также протяженного локуса на хромосоме 19q являются типичными формами мутаций, определяющими трансформацию опухоли в анапластическую астроцитому [Ritland S. et al., 1995; Hill J. et al., 1999]. Большое число генов-супрессоров опухоли (таких как ММАС, кодирующий пептид с фосфатазной клеточно-регуляторной активностью) локализовано на 10-й хромосоме |Ichimura К. et al., 1998]. В связи с этим в 70% случаев глиобластом в клетках опухоли выявляется феномен потери гетерозиготйости по хромосомному локусу 10q23 [Biernat W. et al., 1997]; более того, обнаружение мутаций в гене ММАС может считаться важным диагностическим маркером, свидетельствующим о нарастании степени злокачественности астроцитарной опухоли [Hill J. et al., 1999]. Еще одним семейством генов, ингибирующих цикл клеточного деления, являются гены циклин- зависимых киназ р 14, р 15 и р 16 на хромосоме 9р; не случайно делеции локуса 9р являются характерным молекулярно-генетическим признаком мультиформйых глиобластом [Uelci К. et al., 1996].
Помимо мутаций в генах белков-ингибиторов клеточной пролиферации, в развитии астроцитарных опухолей важнейшую роль играет повышение экспрессии генов, стимулирующих клеточный цикл (такие гены обозначаются общим термином онШеены). Как правило, активизация онкогенов происходит посредством их амплификации (т.е. увеличения числа копий) в результате хромосомной нестабильности в клетках опухоли, свойственной абсолютному большинству злокачественных новообразований. Классическим примером онкогена является ген рецептора эпидермального фактора роста (EGFR), белковый продукт которого является важным стимулятором роста астроцитов. Амплификация гена ?GFR на хромосоме 7q практически не встречается при доброкачественных астроцитомах, но выявляется более чем в трети случаев глиобластом, особенно у пожилых больных [Hunter S. et al., 1995]. Как показано на рис. 72, злокачественная трансформация астроцитарных опухолей ассоциирована также с амплификацией ряда других онкогенов, локализованных, в частности, на хромосомах 1 q, 9q, 12q и т.д. [Hill J. et al., 1999].
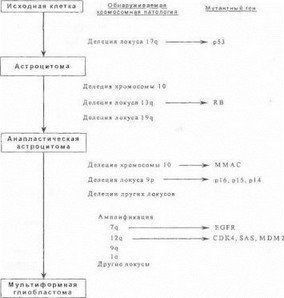
Рис. 72. Генетическая эволюция астроцитарной опухоли
В настоящее время имеется большое число работ, свидетельствующих о существовании аналогичных генетических механизмов, способствующих формированию и эволюции других разновидностей первичных опухолей центральной нервной системы (олигодсндрогли- ом, медуллобластом, менингиом, эпендимом и др.), каждой из которых свойственен свой спектр мутантных генов в клетках опухолевого клона. Чаще всего в клетках данных опухолей описываются как амплификация ряда онкогенов, так и различные мутации (в первую очередь - делеции) в хромосомных локусах 1 р, 6q, 8р, 9q, lip— llq, 17р 13, 19q 1 3, 22q 12.2 и др., приводящие к ингибированию активности соответствующих пептидов-регуляторов клеточного цикла [Ritland S. et al., 1995; Raffel С. et al., 1997; Hill J. et al., 1999]. Один из наиболее известных примеров - инактивация гена NF2 в клетках различных видов наследственных (нейрофиброматоз-2) и спорадических опухолей нервной системы - подробно проанализирован в разделе 3.7.1.2.
Таким образом, формирование опухоли представляет собой многоэтапный процесс, центральными звеньями которого являются повышенная экспрессия онкогенов и инактивация генов-супрессоров опухоли, происходящие в соматических клетках-мишенях под воздействием разнообразных мутагенных факторов. Несмотря на известную ограниченность современных знаний о всей «палитре» генетических повреждений, инициирующих опухолевую пролиферацию, ДНК-диагностика соответствующих мутаций в ряде случаев может способствовать решению различных вопросов клинической нейроонко- логии. Это касается в первую очередь вопросов классификации, дифференциальной диагностики и прогноза опухолей мозга. Так, на сегодня предс гавляется совершенно очевидным, что каждой гистологической разновидности опухоли соответствуют свой собственный «генетический профиль»; более того, дальнейшая детальная молекулярная характеристика опухолей мозга приводит к постепенному выделению новых нозологических подгрупп данных заболеваний [Mohapatra G. et al., 1998]. Наконец, накопление знаний о молекулярной генетике опухолей мозга является важнейшей предпосылкой разработки различных подходов к генной терапии. В силу некоторых особенностей опухолевых процессов в центральной нервной системе (относительно компактная локализация совокупности мутантных клеток, отсутствие клеточных делений в нейронах и др.) они являются идеальным объектом для использования ряда генно-инженерных конструкций [Karpati G. et al., 1996]. Детальное рассмотрение вопросов генной терапии находится за пределами темы настоящей монографии; укажем лишь, что на современном этапе развития нейроонкологии и молекулярной медицины различные методы генной терапии с успехом находят все большее распространение не только в эксперименте, но и в отдельных протоколах клинических испытаний у больных со злокачественными формами глиальных опухолей мозга [Blomer U. etal., 1996; Fathallah-Shaykh Н., 1999;Fueyo J. et al , 1999].
