Прямая ДНК-диагностика предполагает непосредственное выявление мутации в исследуемом гене. Она обладает практически абсолютной точностью, требует для анализа только образец ДНК обследуемого лица и может проводиться как в семейных, так и в спорадичес- uix случаях заболеваний. Для проведения прямой ДНК- диагностики необходимо точно знать структуру гена (или конкретного участка гена, содержащего анализируемую мутацию). Методические подходы, используемые при прямой ДНК-диагностике того или иного наследственного заболевания нервной системы, зависят от характера мутаций и молекулярной организации соответствующего гена.
В настоящее время большинство протоколов прямой ДНК-диагностики базируется на полимеразной цепной реакции (ПЦР). Разработка принципов ПЦР стала поистине революционизирующим этапом в развитии молекулярной генетики, что нашло свое отражение в присуждении ее автору К. Муллису Нобелевской премии за 1993 год в области биологии и медицины. Метод ПЦР заключается в циклическом синтезе in vitro строго заданных, ограниченных участков ДНК длиной от десятков до нескольких тысяч п.о. Это позволяет в течение
- 5 часов получить огромное число копий искусственно синтезированных молекул нужной последовательности ДНК (т.е. амтифицироватъ необходимый участок ДНК, являющийся предметом молекулярного анализа). По сути, метод ПЦР как бы «имитирует» на ограниченном участке гена естественный процесс репликации ДНК, имеющий место in vivo (см. раздел 1.1): в состав реакционного раствора с определенной концентрацией ионов магния и pH входит ДНК-матрица, четыре вида дезоксирибонуклеотид-трифосфатов, а также термостабильная ДНК-полимераза, сохраняющая свою активность при нагревании раствора до высоких температур. Реакция инициируется добавляемыми в раствор праймерами - олигонуклеот идными последовательностями, фланкирующими «зону интереса» и играющими роль затравок в процессе комплементарного синтеза ДНК.
Сущность метода ПЦР схематично представлена на рис. 20 и заключается в циклическом чередовании
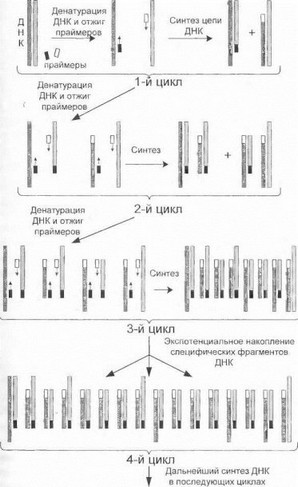
Рис. 20. Полимеразная цепная реакция
3 основных биохимических этапов: 1) денатурация двойной спирали ДНК-матрицы при температуре 95°С; 2) гибридизация (отжиг) одноцепочечной ДНК-матрицы и праймеров при температуре 45-60°С, в процессе которой праймеры распознают комплементарные им участки ДНК-матрицы; 3) полимеризация при температуре 65- 72°С, т.е. синтез комплементарной цепи на ДНК-матри- це, начинающийся от места гибридизации праймера и происходящий в направлении 5’-»3’. В последующих циклах вновь синтезируемые молекулы ДНК становятся, в свою очередь, матрицей для аналогичного синтеза новых копий. Поскольку синтез каждой из 2 антипарал- лельных цепей ДНК начинается от места гибридизации праймера, эти места и становятся границами синтезируемого участка. Число указанных циклов в ПЦР составляет обычно от 25 до 40, причем в каждом цикле происходит удвоение числа копий амплифицируемого участка ДНК, приводящее к увеличению в геометрической прогрессии общего содержания продуктов реакции. Обычно ПЦР осуществляется в автоматическом режиме на специальных программируемых приборах (амплификато- рах), контролирующих заданные параметры реакции (температура, длительность отдельных этапов, число циклов и т.д.).
Дальнейший анализ продуктов ПЦР в процессе прямой ДНК-диагностики предполагает исследование конкретных особенностей амплифицированного участка гена. Так, нри заболеваниях, обусловленных экспансией тринуклеотидных повторов, продукты амплификации различаются по своей длине (отражающей различное число триплетов в изучаемом участке гена) и, как следствие - по их скорости движения в геле. Благодаря этому достигается четкое электрофоретическое разделение нормальных и мутантных аллелей и точное опреде
ление патологически удлиненного фрагмента, т.е ДНК- диагностика болезни. Таким же сравнительно простым путем с помощью анализа размеров продуктов ПЦР на электрофореграмме может проводиться прямая детекция делеций и вставок в составе амплифицированного участка гена. Например, в большинстве случаев аутосомно- доминантной дофа-независимой дистонии у больных имеет место одна и та же типичная гетерозиготная деле- ция трех нуклеотидов GAG в 5-м экзоне гена DYT1 [Ozelius L. et al., 1997]; таким образом, непосредственное выявление при электрофорезе аномально короткого ПЦР-продукта, отличающегося от пормального фрагмента на 3 п.о., может служить молекулярным подтверждением данного диагноза (рис. 21).
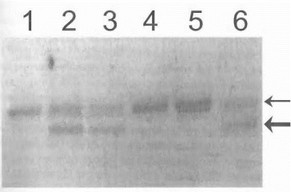
*ис. 21. Диагностика деЛеции GAC в гене DYT1 у больных ,).; gt;фа-исзависимой дистонией
Дорожки 2,3,6 - больные, дорожки 1,4,5 - контроль. Тонкой стрелкой обозначен нормальный аллель, жирной стрел кой-мутантный, ¦олс-е короткий аллель (деления 3 нуклеотидов).
Для обнаружения нуклеотидных замен в анализируемом участке гена возникает необходимость проведения секвенирования, т.е. определения точной нуклеотидной последовательности продуктов ПЦР. На практике наиболее широкое распространение получило секве- нирование по классическому методу Сэнгера, техника которого показана на рис. 22.
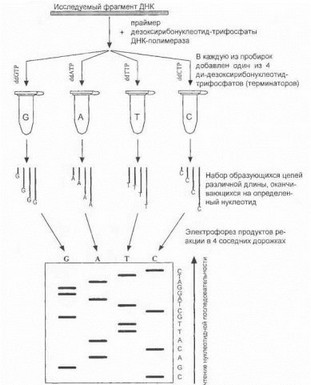
Рис. 22. Принцип секвенирования ДНК по методу Сэнгера
Изучаемый фрагмент ДНК (например, продукт ПЦР) играет роль матрицы, на которой при участии праймера, дозоксирибонуклеотид-трифосфатов и ДНК-полимера- зы инициируется направленный комплементарный синтез новых молекул ДНК, осуществляемый одновременно в 4 параллельных реакциях. Смысл метода в том, что в каждую из реакций добавляется один из 4 химически измененных дезоксирибонуклеш ид- грифосфатов (терминаторов). В качестве таких терминаторов выступают ди- дезоксирибонуклеотид-трифосфаты (ddGTP, ddATP, ddTTP и ddCTP), которые при встраивании в состав молекулы ДИК обрывают дальнейший синтез полинуклео- гидной цепи. В результате этого в каждой из пробирок I [акапливастся набор дочерних молекул ДНК различной длины, оканчивающихся строго на один и тот же нуклеотид. После электрофореза продуктов этих реакций в 4 соседних дорожках проводится считывание информации от более коротких фрагментов к болэе длинным, при этом выявляемый пошаговый порядок удлинения цепей и отражает последовательность нуклеотидов в составе анализируемой ДНК-матрицы. Одномоментно может быть секвенирован участок ДНК, не превышающий -500 п.о., поэтому для исследования более длинных участков гена они должны быть амплифицировапы в виде совокупио- с1% коротких перекрывающихся фрагментов, каждый из которых секвенируется отдельно. Обычно для обнаружения мутаций секвенируются отдельные экзоны изу- 1 Немого гена вместе с примыкающими к ним интронны- ми последовательностями (областями стнлайсинга).
В некоторых случаях в качестве объекта исследо- нвния удобнее использовать не геномную ДНК, а более компактную и информационно «насыщенную» кДНК (См. раздел 1.1), получаемую после соответствующей наработки образцов тканей, например биопсийного ма
териала или клеточных линий лимфоцитов, фибробластов и т.д. Для этого используется методика обратнотранскриптазной ПЦР (RT-PCR): проводится обратная транскрипция мРНК, и получаемые молекулы кДНК служат матрицей для полимеразной цепной реакции (рис. 23).
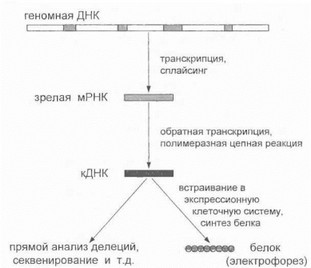
Рис. 23. Диагностика мутаций на уровне мРНК и белка
В последуют,ем кДНК подвергается секвениро- ванию и другим методам мутационного скрининга, прямому электрофоретическому исследованию (выявление делений, вставок и т.д.) либо встраиванию в экспресси- оннуго систему с целью получения белкового продукта и его непосредственного анализа. Последний метод особенно эффективен для детекции мутаций, ведущих к синтезу «усеченного» белка (нонсенс-мутации, мутации
сплайсинга, крупные делеции) - так называемый РТТ- анализ (.Protein Truncation Test) [Telatar M. et al., 1996]. РТТ-анализ обычно используется при исследовании протяженных мультиэкзонных генов, таких как ген мышечной дистрофии Дюшенна/Бекера, атаксии-телеангиэктазии или нейрофиброматоза 1-го типа.
Поскольку толковые мутации могут иметь самую различную локализацию, для их обнаружения необходимо проводить тотальное исследование всей кодирующей области гена. Принимая во внимание тот факт, что гены многих заболеваний содержат в своем составе десятки экзонов, полное секвенированис кодирующей области может представлять исключительно трудоемкую задачу. Для облегчения идентификации мугаций были предложены различные скрининговые методы анализа, позволяющие предварительно отбирать предположительно мутантные фрагменты ДНК, подлежащие секвениро- ванию. Наиболее распространенным является анализ конформационного полиморфизма одионитевой ДИК, или SSCP-анализ (от англ. «Single Strand Conformation Polymorphism») [Orita M. et al., 1989]. Нго принцип показан на рис. 24. При проведении SSCP-анализа ампли- фицированные в ПЦР фрагменты ДНК исследуются в особых неденатурирующих условиях, при которых од- понитсвые молекулы ДНК сохраняют свою пространственную организацию в процессе электрофореза. Замена даже одного нуклеотида приводит к изменению конформации исследуемых полинуклеотидных цепей, в резуль- . ате чего нарушается их электрофоретическая нодвиж- пость (что может быть выявлено посредством обнаружения на электрофореграмме атипично расположенных полос).
Таким образом, обнаружение при SSCP-анализе измененного паттерна миграции фрагментов одноцепо-
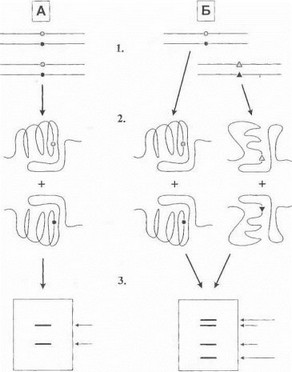
Рис. 24. Принцип SSCP-анализа
А-контроль (2 нормальных аллеля); Б-гетерозиготность по нормальному аллелю и точковой мутации; 1-исходные двойные цепи ДНК, подвергающиеся денатурации; 2-разделенные нити ДНК, принимающие специфическую пространственную конформацию в неденатурирующих условиях; 3-результат электрофореза.Черными и серыми кружками обозначены нормальные нуклеотиды вкомпле- ментарных цепяхДНК,черными и серыми треугольниками-мутант ные нуклеотиды в тех же сайтах. Короткими стрелками на электро- фореграмме указаны нормальные фрагменты ДНК, длинными стрел- ками-мутантные фрагменты ДНК с измененной электрофоретической подвижностью.
чечной ДНК позволяет заподозрить наличие мутации в составе одного из многих изучаемых участков гена, после чего проводится секвекирование данного мутантного образца для точной характеристики нуклеотидных нарушений. Чувствительность SSCP-анализа для детекции неизвестных мутаций зависит от величины анализируемого фрагмента, будучи максимальной (80-95%) при анализе образцов размером от 70 до 200 п.о. Существует целый ряд других скрининговых методов поиска неизвестных толковых мутаций - гетеродуплексный анализ, метод денатурирующего градиентного гель-электрофореза, метод химического расщепления нскомпле- ментарных сайтов и др. [Grompe М., 1993]. Как и SSCP- анализ, они основаны на регистрации некоторых измененных физико-химических свойств амплифицирован- ных мутантных фрагментов ДНК. Во всех случаях после предварительного отбора аномальных образцов наличие мутации подтверждается секвенированием.
В конкретных популяциях мутационный поиск при том или ином наследственном заболевании может быть существенно упрощен в связи с высокой частотой так называемых мажорных мутаций, т.е. мутаций, которые являются преобладающими и обусловливают значительный процент всех случаев заболевания в данной популяции. Наличие мажорных мутаций может быть обусловлено либо эффектом основателя (высокая рас иространенность конкретной мутантной хромосомы, исторически унаследованной от одного предка), либо частым возникновением одного и того же повреждения и связи с некоторыми особенностями нуклеотидного состава данной области гена (так называемые горячие точки мутаций). Примером такого рода является гепа- голентикулярная дегенерация. При данном аутосомно- рецессивном заболевании описано свыше 100 различных мутаций в сложно организованном гене медной АТФ-азы (АТР7В), что значительно затрудняет мутационный скрининг. Однако одна и та же точковая мутация в 14-м экзоне гена, ведущая к замене гистидина на глутамин, выявляется в славянских популяциях России более чем у 60% больных [Ivanova-Smolenskaya I. et al., 1999]. Это позволяет проводить относительно простую и экономную ДНК-диагностику гепатолентикулярной дегенерации в большинстве обследуемых семей из данной этнической группы, не прибегая к технически сложному исследованию всей кодирующей области гена.
При проведении целенаправленного поиска конкретных толковых мутаций важная роль принадлежит использованию рестрикционных эндонуклеаз (рестрик- таз) - особых клеточных ферментов, выделяемых из различных штаммов бактерий. Ценным свойством рестрикционных эндонуклеаз является распознавание ими специфических нуклеотидных последовательностей длиной от 4 до 10 нуклеотидов, в результате чего фермент осуществляет рестрикцию, т.е. разрезапие этих последовательностей в составе двунитевой молекулы ДНК. Каждая рестриктаза распознает и разрезает в фиксированном месте строго определенную, специфичную для себя нуклеотидную последовательность - сайт рестрик ции (сайт узнавания). В настоящее время известно уже несколько сотен различных рестриктаз и, следовательно, столько же различных вариантов коротких нуклеотидных последовательностей, образующих сайты рестрикции. В тех случаях, когда точковая мутация изменяет естественный сайт узнавания для определенной рестрик- тазы, данный фермент не сможет расщепить мутантный амплифицированный фрагмент ДНК; в некоторых случаях, напротив, мутация приводит к появлению нового сайта узнавания для той или иной рестриктазы, отсут-
ствуюшего в норме. В обеих описанных ситуациях мутантный и нормальный ПЦР-продукты дадут различные но длине фрагменты рестрикции, что можно будет легко обнаружить при электрофорезе (рис. 25).
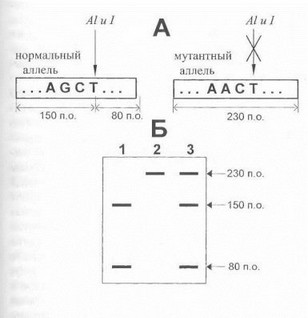
Гис. 25. Выявление толковой мутации с помощью рестрикционного анализа
Л. Лмплифицируемый участок гена, содержащий сайт рестрикции \i тСТ для рестрикционной эндонуклеазы Alul. Мутация G—gt;А и вменяет данную нуклеотидную последовательность, в результате 'ИЯ'О рестрикция ферментом Alul блокируется. Б. Элсктрофорег- |чмма продуктов рестрикции: дорожка 1 - гомозиготность по норма иьному аллелю; дорожка 2- гомозиготность по мутации; 3- ге- ||'|юзиготнос состояние (нормальный аллель+ мутация).
Таким образом, при необходимости быстрой детекции какой-либо определенной толковой мутации задача сводится к компьютерному поиску соответствующей рестриктазы, сайт узнавания которой локализован в месте нарушенной нуклеотидной последовательности; обработка ПЦР-продуктов такой рестриктазой позво'- лит легко дифференцировать нормальные и мутантные аллели. Рестрикционный анализ значительно упрощает обнаружение известных толковых мутаций и в настоящее время широко используется для прямой ДНК-диагностики наследственных заболеваний.
Существует большое число модификаций метода ПЦР, разработанных для быстрого сканирования и поиска известных генных мутаций. Кратко упомянем некоторые из них. 1) Мультиплексная (.мулътипрай- мерная) ПЦР - основана на одновременной амплификации в одной реакции нескольких экзонов исследуемого гена, что позволяет проводить экономный экспресс-скрининг наиболее частых мутаций в гене [Chamberlain J. et al., 1988]. 2) Аллель-специфическая амплификация - основана на использовании различных праймеров, один из которых комплементарен нормальной, а другой - мутантной последовательности ДНК; в результате такой реакции в растворе синтезируются две разновидности ПЦР-продуктов - нормальные и мутантные, различающиеся по своей длине [DvorakovaD., FajkusovaL., 1993]. 3) Метод аллеяь- специфических олигонуклеотидов - основан на гибридизации амплифицированных фрагментов ДНК с мечеными олигонуклеотидами двух видов, комплементарными нормальной либо мутантной последовательности ДНК [Reiss J., 1991]. 4) Метод сайт- направленной модификации амплифицированнойДНК - основан на использовании в ПЦР mismatch-праймера, отличающегося от матричной последовательности на 1 нуклеотид [HaliassosA. etal., 1989]; в результате включения такого праймера в состав мутантного ПЦР-про- дукта в нем образуется искусственно созданный сайт рестрикции для одной из рестриктаз, что позволяет провести ДНК-диагностику с помощью рестрикционного анализа.
Как указывалось выше, для осуществления ПЦР необходимо точно знать структуру кодирующих участков изучаемого гена и примыкающих к ним интронных областей (без чего невозможен синтез праймеров, инициирующих реакцию). Некоторые участки гена (например, сверхдлинные области тандемных тринуклеотид- ных или более сложных повторов) не могут быть эффективно амплифицированы в ПЦР. Кроме того, ПЦР-опос- редованная прямая ДР1К-диагностика не всегда легко применима для анализа больших и сложных по своей молекулярной организации генов (таких как ген дистро- фина), выявления протяженных делеций в I етерозиготном состоянии и в некоторых других случаях. Поэтому при ряде наследственных заболеваний используется другой ^етод детекции изменений нуклеотидного состава гена - блот-гибридизация. В общем виде технология блот-гибридизации показана на рис. 26. Геномная ДНК обрабатывается одной из рестрикционных эндонуклеаз, после чего образующийся набор большого числа рестрикционных фрагментов Д1IK различной длины фракционируется в агарозном геле с разделением их по молекулярной массе. Далее, после денатурации ДНК, проводится процедура блоттипга- переноса фрагментов ДПК с геля на нитроцеллюлозный или нейлоновый фильтр (это осуществляется за счет действия осмотических сил, вакуума или электрического поля), в результате чего на фильтре фиксируется точная реплика ДИК-рестрикта. Денатурированные фрагменты ) [ЦК гибридизуются с радиоактивно-меченым зондом -

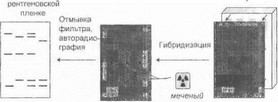
молекулой ДНК длиной несколько сотен нуклеотидов. После отмывки фильтра и авторадиографии на рентеновской пленке можно видеть точное положение и оценить длину фрагментов ДНК, комплементарных использованному зонду. Таким образом, блот- гибридизация позволяет идентифицировать специфические последовательности нуклеотидов в общем наборе рестрикционных фрагментов геномной ДНК.
Представленная технология блот-гибридизации ДНК носит название блот-гибридизации по методу Сау- зерна (Саузерн-блоттинг) - по имени английского исследователя, предложившего данный метод в 1975 г.
Аналогичным образом может проводиться гибридизация ДНК-зонда с электрофоретически разделенными молекулами РНК с целью идентификации специфических последовательностей тканевых РНК (.Нозерн-блоттинг), а также гибридизация меченых антител со специфическими белками (Вестерн-блоттинг, или иммупоблот- тинг). Модификациями Саузерн-блоттиига являются методы гибридизации с Д| iK-зондом молекул ДНК (РНК), нанесенных на фильтр без предварительной рестрикции и электрофореза - дот-гибридизация (при нанесении на фильтр округлого пятна ДНК) и слот-гибридизация (при вытянутой форме пятна).
Метод блот-гибридизации обладает высокой чувствительностью, однако он весьма трудоемок, предполагает использование радиоактивных зондов, предъявляет высокие требования к качеству анализируемой Д11К и требует для проведения больших количеств геномной ДНК (5-10 микрограмм, что на несколько порядков превышает количество ДНК, необходимое для проведения ПЦР). Тем не менее во многих случаях он играет ведущую роль в прямой ДНК-диагностике, в том числе в сочетании с другими разнообразными вышеописаппы- шо методами исследования структуры ДНК Например, когда та или иная точковая мутация затрагивает сайт узнавания используемой при блот-гибридизации рестрик- газы, на пленке можно четко зафиксировать отсутствие соответствующей полосы или появление атипичного фрагмента ДНК. Удлинение определенного участка изучаемого гена (Например, при болезнях экспансии повторов) или делеция участка гена также приведут к изменению размера одного из фрагментов ДИК и появлению атипичной полосы либо отсутствию полосы на радиоавтографе (рис. 27).
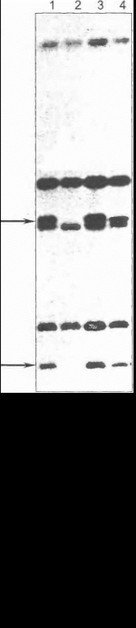
Одним из приложений блот-гибридизации по Саузерну является диагностика мутаций, характеризующихся изменением «дозы гена». При наличии делеции или дупликации гена в гетерозиготном состоянии соответствующие полосы на радиоавтографе будут характеризоваться уменьшением или увеличением интенсивности и площади сигнала, что можно зафиксировать визуально либо оценить количественно с помощью денситометрии полученного изображения (см. рис. 27). Определение дозы гена возможно и на основе технологий количественной ПЦР [Heid С. et al., 1996], позволяющей оценивать количественный состав продуктов амплификации (как правило, для этого применяются автоматические секвенаторы и соответствующее программное обеспечение). Использование блот-гибридизации в ряде случаев позволяет выявить патогенетически значимые нуклеотидные изменения в составе нитронов, которые пропускаются при обычных методах скрининга кодирующей области гена.
В последние годы технологии прямой ДНК-диаг- I гостики вышли на качественно новый уровень в связи с появлением методов так называемого параллельного молекулярно-генетического анализа, позволяющих проводить одновременный мутационный скрининг большого числа образцов и значительно ускорить выявление мутаций в изучаемых генах [Yershov G. et al., 1996; McKenzie S. et al., 1998; Syvanen A., 1999]. К ним относятся уже упоминавшееся автоматическое секвенирова- пие (осуществляемое на специальных приборах с флюоресцентными методами детекции и компьютерным анализом нуклеотидных последовательностей), технология капиллярного электрофореза, метод мультиплексного аллель-специфического диагностического анализа, прай мер-продлевающее «минисеквенирование», использование ДНК-биочипов и целый ряд других новейших разработок.
На последнем из названных методов следует остановиться чуть подробнее. ДНК-биочип представляет миниатюрную гелевую пластину, в ячейки которой с помощью специальных методов нанесен упорядоченный набор из десятков и сотен иммобилизованных коротких олигонуклеотидов. Данные олигонуклеотиды специфически гибридизуются с разнообразными флю- орохромно-мечеными молекулами ДНК, а результат реакции фиксируется с помощью флюоресцентной микроскопической техники и анализируется с использованием соответствующего компьютерного программного обеспечения. Применение на практике технологии ДНК-биочипов может позволить проводить автоматизированный и эффективный анализ большого числа известных мутаций и полиморфизмов, осуществлять быстрое секвенирование крупных фрагментов ДНК, а также одномоментно анализировать экспрессию большого числа генов в изучаемой ткани в заданный интервал времени, что сулит поистине уникальные возможности в изучении основ функционирования генома [Yershov G. et al., 1996; Brown P., Botstein D., 1999]. Многие методы параллельного молекулярно-генетического анализа находятся пока в стадии разработки, однако не вызывает сомнений, что они в самое ближайшие время будут внедрены в практику работы широкого круга специализированных диагностических лабораторий, сделав процедуру мутационного скрининга при большинстве наследственных заболеваний рутинной операцией.
