Важнейшей задачей молекулярной генетики применительно к медицине является идентификация генов наследственных заболеваний человека и выявление конкретных повреждений в них, приводящих к развитию фенотипических проявлений болезни. Эта задача может пить выполнена с помощью нескольких основных под-
\ОДОВ.
Первый подход к идентификации генов, остававшийся ведущим приблизительно до начала 90-х годов,
| чзируется на имеющейся информации об основном био- х11 мическом дефекте (первичном белковом продукте гена), ха- рактеризующем изучаемую болезнь | Шишкин С.С., Калинин В.Н., ] 992; Gardner Е. et al., 1991; Collins F., 1995].
I l'-реход от белкового анализа на уровень ДНК осуществлялся через секвенирование очищенного белкового продукта и получение ДНК-зондов, использование моноклональных антител и с помощью некоторых других методических приемов. Хромосомная локализация гена в данной схеме поиска является конечным результатом исследования. Описанный подход, использующий ту или иную предварительную информацию о функциональном значении искомого гена, получил название «функциональное клонирование» [Collins Е, 1995]. Примером успешного применения функционального клонирования является идентификация гена фенилкетонурии. К сожалению, данный метод может быть применен лишь к весьма ограниченному кругу заболеваний человека, тогда как для большинства наследственных болезней первичные продукты гена или патогномоничные биохимические маркеры неизвестны.
Совершенствование молекулярных технологий привело к созданию принципиально иной стратегии поиска гена, не требующей каких-либо предварительных знаний о его функции или первичном биохимическом продукте. Данная стратегия предполагает идентификацию гена на основании точного знания его локализации в определенном хромосомном локусе — «позиционное клонирование» (менее удачный термин «обратная генетика») [Collins Е, 1992; 1995; Davis М. et al., 1993]. Позиционное клонирование ведет к установлению молекулярной основы болезни «от гена к белку» и включает следующие основные этапы: 1) картирование гена болезни в определенном участке конкретной хромосомы (генетическое картирование); 2) составление физической карты изучаемой хромосомной области (физическое картирование); 3) идентификация экспрессирующихся последовательностей ДНК в изучаемой области; 4) секвенирование генов-кандидатов и выявление мутаций в искомом гене у больных лиц; 5) анализ структуры гена.
расшифровка последовательности и первичной структуры его продуктов - мРНК и белка [Leppert М., 1990; Gardner Е. etal., 1991; Cantor С., Smith С., 1993; Collins F., 1995]. В ряде случаев позиционное клонирование гена облегчается при обнаружении у больных видимых ци го- генетических перестроек или определяемых делеций в критической хромосомной области, позволяющих значительно повысить точность картирования мутантного гена. Выявление таких перестроек способствовало, в частности, успеху в клонировании генов миодистрофии Дюшепна/Бекера, нейрофиброматоза 1-го типа, туберозного склероза, адренолейкодистрофии и других наследственных заболеваний нервной системы.
Одним из важных промежуточных результатов исследовательского прост а «Геном человека» стало со- здапие все более и более насыщенной транскрипционной карты генома, содержащей сведения о тысячах уже известных генов и экспрессирующихся нуклеотидных последовательностей. Это способствовало значительному развитию еще одного подхода к идентификации первичного генетического дефекта, при котором после предварительного картирования мутантного гена проводится скрининг подходящих генов-кандидатов, расположенных в том же хромосомном участке (lt;lt;positional candidate approach») [Collins F., 1995]. Данный метод предполагает наличие определенных знаний о патофизиологии изучаемого заболевания, что дает возможность проводить рациональный отбор гепов-кандидатов для анализа из большого числа генов, которые могут быть расположены в «зоне интереса». Среди неврологических наследственных заболеваний, гены которых были идентифицированы таким образом благодаря анализу подходящих кандидатов в установленном хромосомном интервале, можно назвать дофа-зависимую дистонию и фридрейхо- подобную атаксию с дефицитом витамина Е. По существующим прогнозам, именно анализ «позиционных кандидатов» станет в ближайшем будущем ведущим методом идентификации генов наследственных болезней, чему в немалой степени способствует создание и постоянное расширение компьютерных баз данных экспрессирующихся последовательностей на хромосомах («expressed sequence tags») [Collins F., 1995].
Таким образом, определение хромосомной локализации искомого гена - генетическое картирование - является первым, ключевым шагом на пути к раскрытию молекулярной основы того или иного наследственного заболевания.
Существует несколько основных методов, позволяющих картировать неизвестный ген в конкретном хромосомном локусе: а) клинико-генеалогический (простейший и наиболее давний) - основан на анализе наследования признаков в больших родословных; примером может служить установление локализации гена на Х-хро- мосоме в случае передачи болезни по Х-сцепленному типу; б) цитогенетический - базируется на ассоциации выявляемых при микроскопии хромосомных перестроек с определенным клиническим фенотипом; в) метод гибридизации in situ (в том числе его современная модификация - флюоресцентная гибридизация in situ, FISH) — использует специфическую гибридизацию мРНК и кДНК искомого гена с денатурированными хромосомами на метафазных препаратах клетки; г) метод гибрид ных клеток - основан на анализе совместной сегрегации клеточных признаков и хромосом в клонированных in vitro гибридных соматических клетках [Фогель Ф., Мотульски А., 1990; Gardner Е. et al., 1991]. Все эти методы нашли свое применение в современной молекулярной генетике, однако они обладают серьезными ограничениями, связан ными как с недостаточной разрешающей способностью, так и с существованием жестких предусловий, необходимых для проведения исследования (таких как наличие зондов, доступность селективных систем для отбора гибридных клеток и т.п.). Наиболее мощным, продуктивным и широко используемым в настоящее время методом картирования генов наследственных болезней человека является так называемый linkage-анализ - анализ сцепления искомого гена с набором точно локализованных генетических маркеров [Ott J.,1991; Pulst S., 1999].
Центральное положение linkage-анализа заключается в том, что мерой относительного генетического расстояния между двумя локусами па хромосоме может служить частота рекомбинаций между этими локусами в результате кроссинговера гомологичных хромосом в мейозе. Чем ближе расположены локусы па хромосоме, I ем больше вероятность того, что они будут наследоваться как единое целое (группа сцепления); при значительной удаленности изучаемых локусов (т.е. слабой степени сцепления) они с большей вероятностью разойдутся после кроссинговера по разным хромосомам. Частота рекомбинации между локусами 1% принята за единицу
- енетического расстояния между ними - 1 сантиморга- ниду (сМ), что эквивалентно в среднем 1 миллиону п.о. Следует подчеркнуть, что частота рекомбинаций и, следовательно, генетическое расстояние, неодинаковы для мужчин и женщин (больше у женщин), для разных хромосом, а также для разных участков одной хромосомы («горячие точки» рекомбинации) [Cantor С., Smith С., 1.993; Merette С., Ott J., 1993].
Сущность анализа сцепления состой! в сопоставлении наследования патологического признака (болез-
- и) в родословной с наследованием различных полиморфных генетических маркеров с точно известной хромо- ' имной локализацией. Если все больные или их значи- I ельная часть в семье имеют, в отличие от здоровых, один
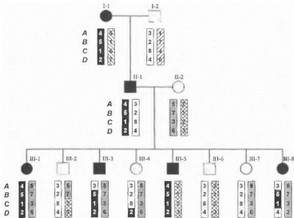
Рис. 30. Принцип анализа генетического сцепления на примере аутосомно-доминантного заболевания В данном примере исследованы 4 сцепленных маркера А, В, С и D, по которым реконструированы гаплотипы. Разные по происхождению хромосомы маркированы различными типами штриховки (исходная мутантная хромосома обозначена черным цветом). Все больные в родословной имеют одну и ту же общую (среднюю) часть исходной мутантной хромосомы. Например, в нижнем поколении хромосомы претерпели ряд рекомбинаций, однако у всех больных сибсов (в том числе у лиц Ш-З и Ш-8) сохраняется один и тот же мутантный гаплотип по маркерам В и С (гаплотип у ). Напротив, никто из здоровых сибсов в нижнем поколении не унаследовал от отца гаплотип j по маркерам В и С (индивидуум Ш-4 унаследовал хромосому, в которой рекомбинация произошла ниже критического сегмента). Таким образом, сегрегация маркерных аллелей и анализ гаплотипов свидетельствуют о том, что ген заболевания расположен в хромосомном сегменте, включающем в себя маркеры В и С. Соответственно, внешними границами участка хромосомы, в пределах которого расположен мутантный ген, являются маркеры А и D.
и тот же аллель исследуемого маркера, это свидетельствует об отсутствии рекомбинаций между искомым мутантным геном и данным маркером, т.е. о наличии сцепления между ними. Пример сцепления между геном аутосомно-доминантного заболевания и определенными генетическими маркерами представлен на рис. 30.
Для достоверного доказательства сцепления разработан специальный математический аппарат [Ott J., 1991]. Принцип расчета заключается в сопоставлении вероятностей гипотез о наличии и отсутствии сцепления при имеющихся семейных данных и выбранной частоте рекомбинаций 0; соотношение этих двух вероятностей (соотношение правдоподобий) выражает шансы за и против сцепления. Для удобства используется десятичный логарифм соотношения правдоподобий - Лод- балл (от англ. Logarithm of the Odds, или LOD):
Po
LOD = Logio —-
P1/2 , где P - вероятность
полученного распределения семейных данных для сцепленных генов с частотой рекомбинаций 0, Р - вероятность такого распределения для двух несцепленных свободно рекомбинирующих генов (частота рекомбинаций 0 = 1/2). Использование логарифмической формы расчета позволяет проводить сложение 27од-баллов, полученных при анализе отдельных родословных. Для доказательства генетического сцепления принято значение Лод- балла +3, которое означает соотношение шансов 1000:1 в пользу наличия генетического сцепления междgt; маркером и изучаемым признаком. Лод-балл -2 и ниже свидетельствует о достоверном отсутствии сцепления; значения Лод-балла от +3 до - 2 являются, соответственно, более или менее предположительными с точки зрения наличия сцепления и нуждаются в дальнейшем подтверждении. Частота рекомбинаций 0, для которой был выявлен максимальный Л од-балл, является отражением наиболее вероятного генетического расстояния между изучаемыми локусами; ориентировочно считается, что 1% рекомбинаций свидетельствует об очень тесном сцеплении, частота рекомбинаций около 5% - о хорошем сцеплении и частота 10-20% - о некотором умеренном сцеплении.
Расчет Лоб-баллов предполагает использование специального компьютерного программного обеспечения (программа LIPED, пакет программ LINKAGE и др.) [Lathrop G., Lalouel J., 1984; Ott J., 1991].
Для успеха linkage-анализа необходимо, чтобы исследуемые семьи были информативны по болезни и по генетическому маркеру. Первое означает наличие достаточного числа информативных мейозов в родословной, позволяющих анализировать расхождение признаков в данной родословной. С практической точки зрения это означает наличие большого числа доступных для анализа больных и здоровых родственников, как правило, из нескольких поколений. Информативность по маркеру предполагает его полиморфизм (т.е. существование большого числа аллелей) и гетерозиготность у ключевых членов семьи, что позволяет дифференцировать генетическое происхождение конкретных аллелей маркера. До конца 80-х годов основным типом маркеров, используемых в анализе сцепления, были участки ДНК хромосом, имеющие в своем составе вариацию в одной паре оснований и различаемые по наличию или отсутствию участка рестрикции для соответствующего фермента, т.е. по длине рестрикционных фрагментов («restriction fragment length polymorphism», RFLP) [Botstein D. et al., 1980]. Новая эра в генетическом картировании наступила с открытием класса высокополиморфных маркеров, представляющих собой участки ДНК, состоящие из вариабельного числа копий тандемных (СА)п-повторов и обладающие чрезвычайно высокой гетерозиготностью [Ott J., 1991]. Это позволило в значительной степени разрешить проблему информативности используемых маркеров и способствовало существенному прогрессу linkage-анализа. По некоторым оценкам, для скрининга полного гаплоидного генома и выявления генетического сцепления необходимо иметь 200-300 высокополиморфных маркеров, равномерно распределенных по хромосомам [Leppert М., 1990; Antonarakis S., 1994]. Генетические карты последнего поколения включают свыше 5000 таких маркеров [Dib С. et ak, 1996], что позволяет считать сегодня задачу установления генетического сцепления принципиально возможной в любых информативных родословных [Antonarakis S., 1994].
Серьезных проблемой, с которой приходится сталкиваться при проведении анализа сцепления на серии семей, является проблема возможной генетической гетерогенности изучаемого клинического синдрома. В случае, если изучаемый фенотип может вызываться мутациями в разных генах, механическое сложение полученных в отдельных семьях положительных (при наличии сцепления) и отрицательных (при его отсутствии) Лод- баллов ведет к нивелированию суммарного значения Лод- балла и ложному выводу о полном отсутствии сцепления. Примером может служить аутосомно-доминантная моторно-сенсорная невропатия 1 типа, обусловленная мутациями в разных генах, локализованных на 1-й, 17-й и других хромосомах [Chance Р., Hschbeck К., 1994]. В этой ситуации особое значение приобретает тщательное, детальное обследование больных и семей, направляемых для linkage-анализа, с целью отбора максимально однородных клинических групп. Дополнитеёгьным способом избежать ложно-отрицательного результата исследования является использование в процессе расче
та ,/7од-баллов специальной программы HOMOG или аналогичных ей программ, позволяющих оценивать вероятность генетической гетерогенности при полученном конкретном наборе семейных данных [Ott J., 1991; Merette С., Ott J., 1993]. Наиболее действенным подходом на первом этапе исследования является анализ сцепления в одной большой информативной родословной, что позволяет заведомо иск почить возможность генетической гетерогенности в изучаемой группе больных. Дополнительные сложности при проведении linkage-анализа связаны с нередко наблюдающейся неполной пенетрант- ностью и вариабельной экспрессивностью мутантного гена, наличием фенокопий среди обследуемых членов семьи, оценкой возраста начала болезни и возможности доклинического носительства мутации, оценкой распространенности конкретных аллелей изучаемых маркеров в популяции и т.д. [Ott J., 1991; Bird Т., 1993; Davis М. et al., 1993; Pulst S., 1999]. Неверный учет или недооценка этих факторов могут существенно повлиять на итоговый результат, поэтому качество подробного клинико-генеалогического анализа в изучаемых семьях выступает на первый план.
Разработано много новых методов, представляющих из себя дальнейшее развитие традиционной стратегии исследования генетического сцепления и существенно повышающих скорость выполнения, методические возможности и разрешающую способность данного анализа в локализации неизвестных генов наследственных заболеваний человека. Одним из таких методов является мультилокусный анализ (multipoint linkage analysis), позволяющий оценивать Лод-баллы для совокупности сцепленных локусов в соответствии с генетической картой изучаемого хромосомного участка и определять наиболее вероятную локализацию мутантного гена в пределах данного участка [Lathrop G. et al., 1984]. В инбредных
родословных с аутосомно-рецессивным заболеванием при наличии предположения об «эффекте основателя» исключительно продуктивным зарекомендовал себя метод гомозиготного картирования: он заключается в анализе «го- мозиготности по происхождению» {«homozygosUy-by- descent») и позволяет оценить степень гомозиготлости больных лиц по серии маркеров как результат наследования от единого предка общего хромосомного участка, включающего мутантный ген [Lander Е., Botstein D., 1988; Ben Hamida С. et al., 1993; Hillaire D. et al., 1994]. Многообещающим является метод «экономного сканирования генома», предполагающий преимущественное использование маркеров, локализованных в «стратегических» CG насыщенных хромосомных областях, богатых экспрессирующимися последовательностями [Antonaralas 3^ 1994]. Предложен также целый ряд других модификаций классического linkage-анализа [Bochnke М., 1986; Weeks D., Lange К., 1988; Oft J., 1991: Nelson S. et al., 1993; Ward P., 1993; Krnglyak L. et al., 1995].
Важно подчеркнуть, что анализ сцепления сохранит свое значение и после идентификации всего генома человека [Pulst S., 1999]. Например, при изучении все еще достаточно большой группы наследственных заболеваний с неустановленными генами первым шагом на пути к выяснению молекулярного дефекта может служить /ш/ш^е-апализ и определение хромосомного локуса болезни, с последующим скринингом подходящих генов в данной области. Чрезвычайно важной в успехе генетического картирования является роль клинициста. Она заключается в адекватном отборе репрезентативных семей, детальной оценке клинического статуса всех включенных в исследование членов семьи, точной диагностике болезни и оценке характера сегрегации мутантного гена, а также в решении многих других ключевых вопросов.
