1х106 КМ инкубируют в среде, содержащей изотоп Na251Cr04 (37х105 Bq или 100 мкКю, специфическая активность 5 мкКю/моль), при 37 °С в течение 1—1,5 ч, после чего тщательно отмывают от не вошедшего в клетки изотопа.
а) лунки с КМ, в которые не вносят КЭ, — это контроль спонтанного выхода метки;
б) лунки с КМ, в которые вместо КЭ вносят детергент Triton Х-100 1% (v/v), — это контроль максимально возможного высвобождения метки из КМ.
Цитотоксичность в опытных лунках рассчитывают обычно по следующей формуле:

где СРМ — это число импульсов в минуту соответственно в экспериментальных лунках (СРМ„), в лунках со спонтанным высвобождением метки (СРМспонтанно) и в лунках с максимально возможным высвобождением метки (СРМ,^.
Оценка цитотоксической активности с использованием проточной цитометрии
Кроме описанного «хромового» теста, существуют методики оценки клеточной цитотоксичности с использованием проточного цитофлуориметра. В данном случае для мечения клеток используют два реагента. Сначала метят КМ флуорохромом, который проникает в клетки, не повреждая их, и флуоресцирует, возбужденный лазерным излучением. Затем к КМ добавляют КЭ, инкубируют их совместно, чтобы дать возможность реализоваться киллерной атаке, и добавляют к смеси второй реагент, превращающийся во флуорохром только в живых клетках под действием их ферментов-эстераз. В результате в итоговой картине КЭ станут светиться одним цветом «живого флуо- рохрома», живые КМ будут двухцветными, погибшие КМ — одноцветными по первому флуорохрому.
Известен метод оценки антителозависимой клеточной цитотоксичности с использованием в качестве КМ эритроцитов (например, барана), покрытых IgG- антителами к ним. КЭ, несущие Fc-рецепторы к IgG, разрушают (лизируют) КМ, и по уровню освобождаемого в культуральную среду гемоглобина судят об активности таких киллеров (NK, В-клетки, моноциты, макрофаги и др.).


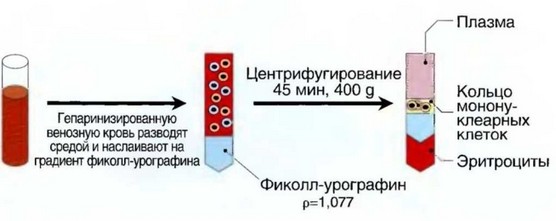
Рис. 2.2. Выделение мононуклеарных клеток в одноступенчатом градиенте плотности фиколл-урографина
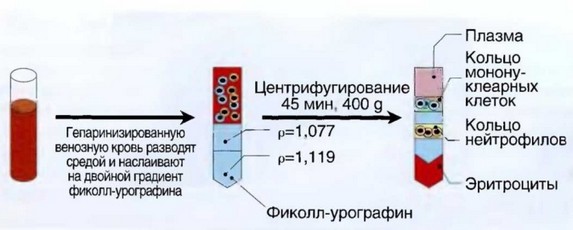
Рис. 2.3. Выделение нейтрофилов в двухступенчатом градиенте плотности фиколл-урографина
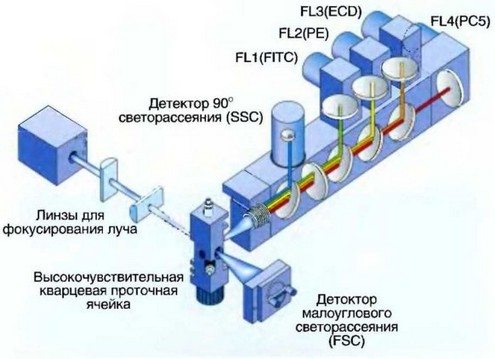
Рис. 2.4. Устройство проточного цитометра
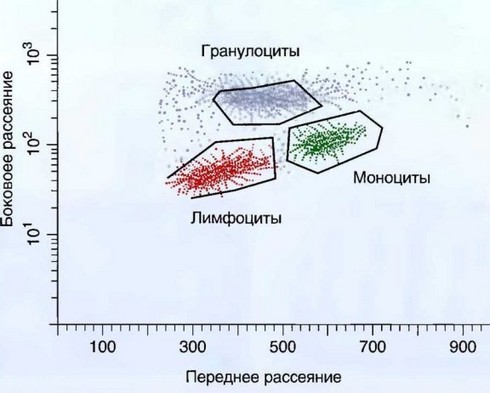
Рис. 2.5. Выделение окон лимфоцитов, моноцитов, нейтрофилов по светорассеянию

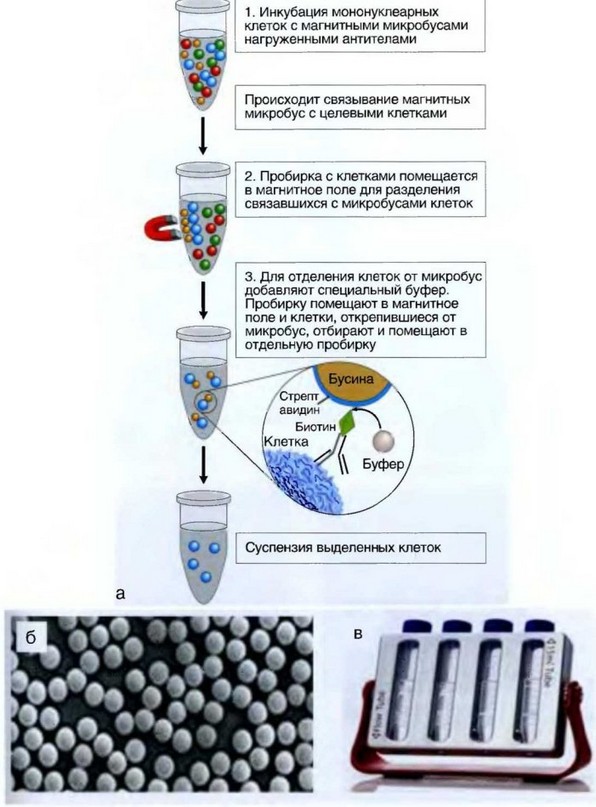
Рис. 2.8. Иммуномагнитная сепарация: а — основные этапы; б — магнитные бусы; в — пример магнитного штатива
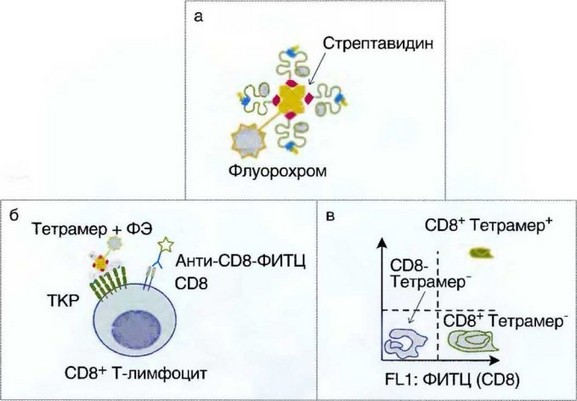
Рис. 3.1. Тетрамерные структуры: а — строение тетрамерной структуры; б — связывание тетрамера ЦТЛ; в — пример результатов, полученных при анализе тетрамерных структур на проточном цитофлуориметре; ФИТЦ — флуоресцеин-5-изотиоционат; ФЭ — фикоэритрин
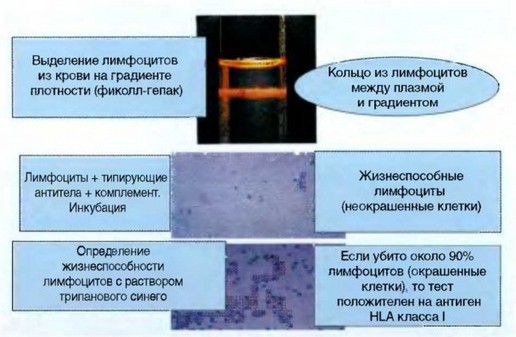
Рис. 3.2. Микролимфоцитотоксический тест (серотипирование HLA класса I)
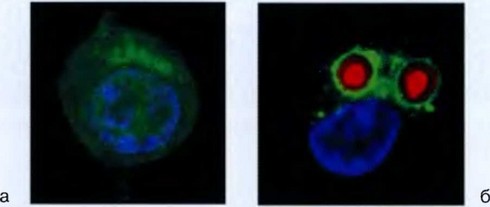
Рис. 3.3. Фагоцитоз зимозана макрофагом (конфокальная микроскопия и лазерная сканирующая конфокальная микроскопия): а — интактный макрофаг; б — макрофаг, захвативший зимозан (красный)
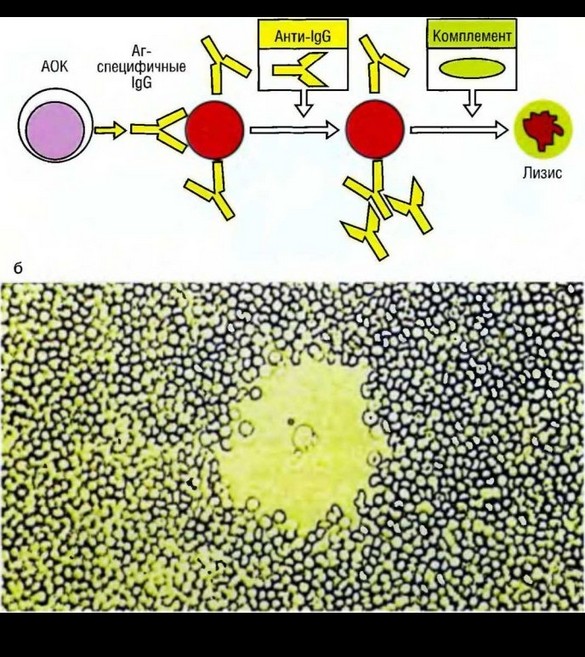
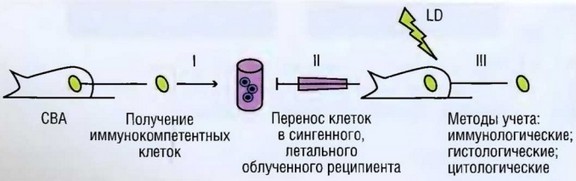
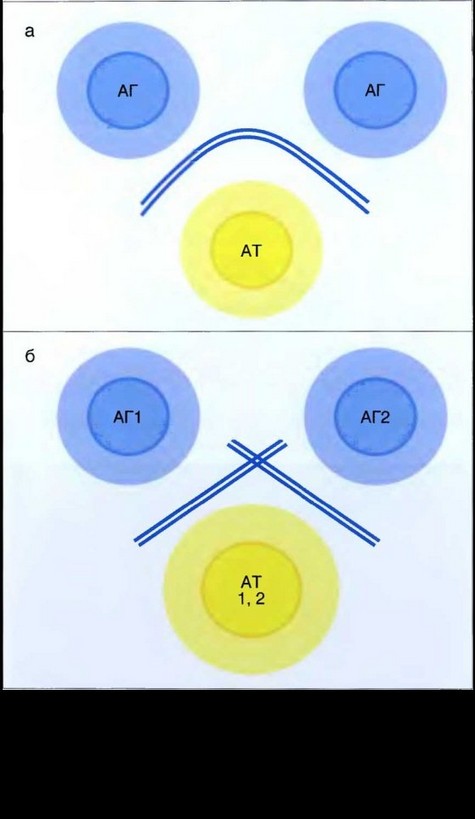
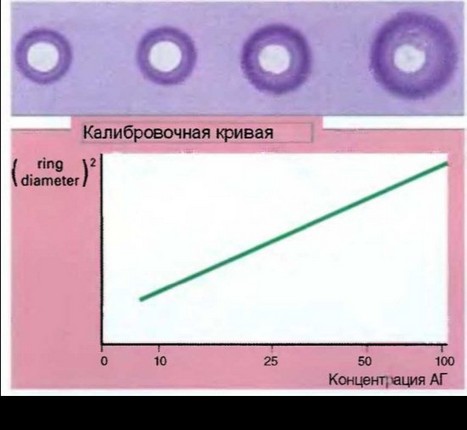
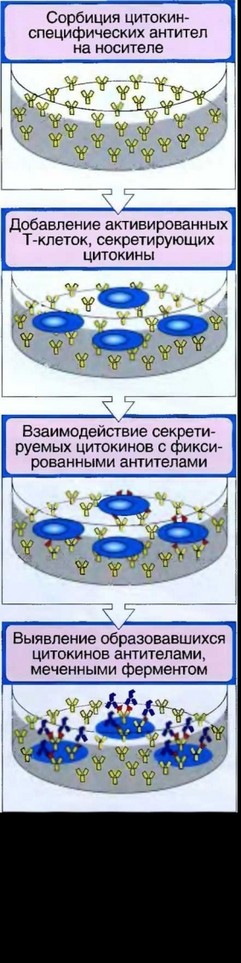
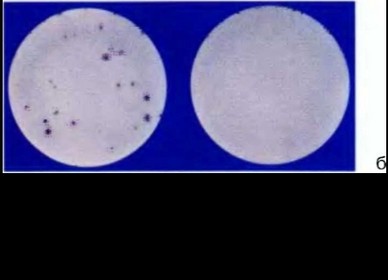


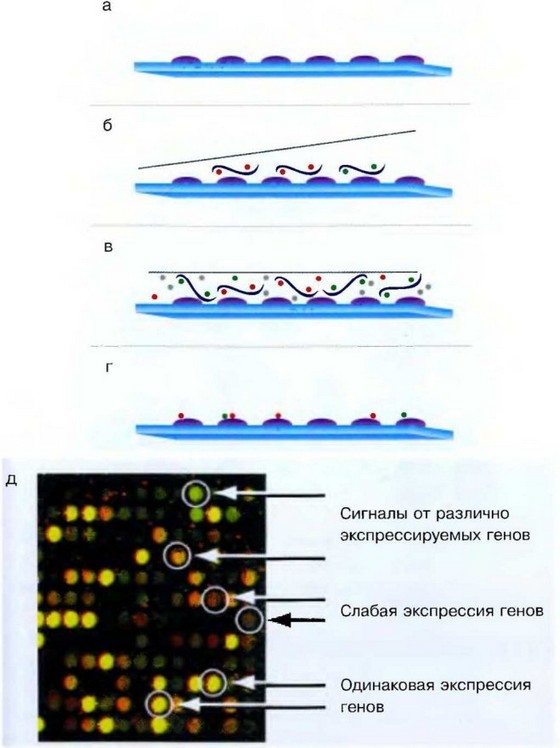
Рис. 6.10. Схема гибридизации меченой пробы с микрочипом: а — исходная поверхность микрочипа; б — добавление меченой пробы; в — гибридизация микрочипа с пробой в течение 16 ч; г — отмывка микрочипа от несвязавшейся пробы; д — детекция результатов
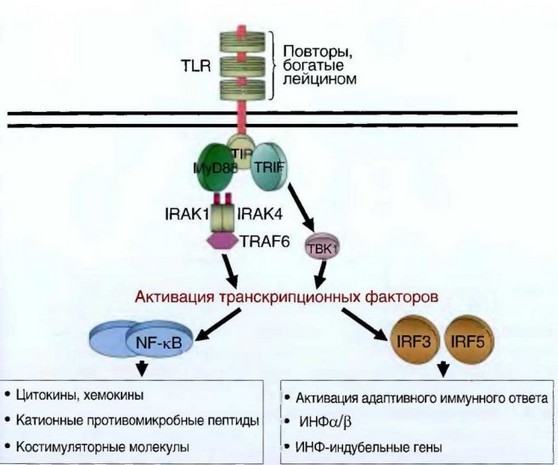
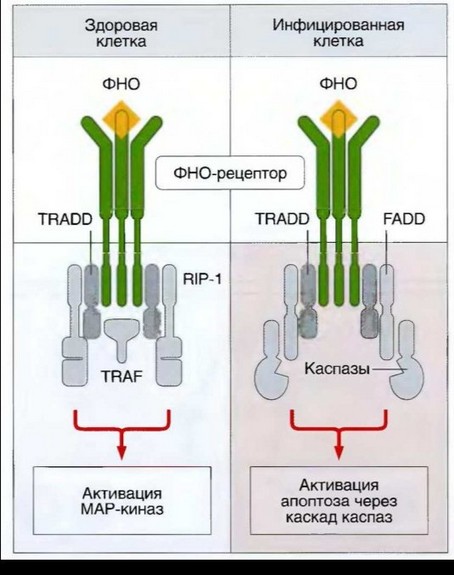
Рис. 7.4. TLR-опосредованная индукция выработки цитокинов клетками врожденного иммунитета

- КМ подсчитывают и раскапывают в подобранной дозе в лунки культуральных круглодонных микропланшетов.
- В те же лунки вносят КЭ. Соотношение КМ и КЭ обычно составляет от 1:10 до 1:500 в пользу КЭ.
- Плашки подвергают мягкому центрифугированию — 150 g в течение 1 мин, после чего помещают в С02-инкубатор при 37 °С на 4—6 ч.
- По завершении культивирования плашки центрифугируют при 250 g в течение 5 мин для плотного осаждения клеток.
- Супернатанты собирают в специальные пробирки, в которых радиоактивность подсчитывают в у-счетчике.
- В качестве контроля используют:
а) лунки с КМ, в которые не вносят КЭ, — это контроль спонтанного выхода метки;
б) лунки с КМ, в которые вместо КЭ вносят детергент Triton Х-100 1% (v/v), — это контроль максимально возможного высвобождения метки из КМ.
Цитотоксичность в опытных лунках рассчитывают обычно по следующей формуле:

где СРМ — это число импульсов в минуту соответственно в экспериментальных лунках (СРМ„), в лунках со спонтанным высвобождением метки (СРМспонтанно) и в лунках с максимально возможным высвобождением метки (СРМ,^.
Оценка цитотоксической активности с использованием проточной цитометрии
Кроме описанного «хромового» теста, существуют методики оценки клеточной цитотоксичности с использованием проточного цитофлуориметра. В данном случае для мечения клеток используют два реагента. Сначала метят КМ флуорохромом, который проникает в клетки, не повреждая их, и флуоресцирует, возбужденный лазерным излучением. Затем к КМ добавляют КЭ, инкубируют их совместно, чтобы дать возможность реализоваться киллерной атаке, и добавляют к смеси второй реагент, превращающийся во флуорохром только в живых клетках под действием их ферментов-эстераз. В результате в итоговой картине КЭ станут светиться одним цветом «живого флуо- рохрома», живые КМ будут двухцветными, погибшие КМ — одноцветными по первому флуорохрому.
Известен метод оценки антителозависимой клеточной цитотоксичности с использованием в качестве КМ эритроцитов (например, барана), покрытых IgG- антителами к ним. КЭ, несущие Fc-рецепторы к IgG, разрушают (лизируют) КМ, и по уровню освобождаемого в культуральную среду гемоглобина судят об активности таких киллеров (NK, В-клетки, моноциты, макрофаги и др.).





Рис. 2.2. Выделение мононуклеарных клеток в одноступенчатом градиенте плотности фиколл-урографина

Рис. 2.3. Выделение нейтрофилов в двухступенчатом градиенте плотности фиколл-урографина

Рис. 2.4. Устройство проточного цитометра

Рис. 2.5. Выделение окон лимфоцитов, моноцитов, нейтрофилов по светорассеянию


Рис. 2.8. Иммуномагнитная сепарация: а — основные этапы; б — магнитные бусы; в — пример магнитного штатива

Рис. 3.1. Тетрамерные структуры: а — строение тетрамерной структуры; б — связывание тетрамера ЦТЛ; в — пример результатов, полученных при анализе тетрамерных структур на проточном цитофлуориметре; ФИТЦ — флуоресцеин-5-изотиоционат; ФЭ — фикоэритрин

Рис. 3.2. Микролимфоцитотоксический тест (серотипирование HLA класса I)

Рис. 3.3. Фагоцитоз зимозана макрофагом (конфокальная микроскопия и лазерная сканирующая конфокальная микроскопия): а — интактный макрофаг; б — макрофаг, захвативший зимозан (красный)










Рис. 6.10. Схема гибридизации меченой пробы с микрочипом: а — исходная поверхность микрочипа; б — добавление меченой пробы; в — гибридизация микрочипа с пробой в течение 16 ч; г — отмывка микрочипа от несвязавшейся пробы; д — детекция результатов


Рис. 7.4. TLR-опосредованная индукция выработки цитокинов клетками врожденного иммунитета


