Распознавание PAMP подготавливает клетки врожденного иммунитета к выполнению их основной функции — удалению чужеродных агентов из внутренней среды организма. При этом происходит экспрессия ряда генов, появляются отсутствовавшие на покоящихся клетках молекулы, участвующие в выполнение клетками своих эффекторных функций. Переход клетки в состояние, обеспечивающее выполнение ею своих функций, обозначают термином «активация».
При активации происходит экспрессия определенных наборов инду- цибельных генов. Различия эффекторных функций разных типов клеток обусловлены экспрессией различных наборов генов. При активации для большинства клеток врожденного иммунитета характерны: появление новых молекул на поверхности клеток (в частности молекул адгезии и разнообразных рецепторов), секреция цитокинов и других гуморальных продуктов, усиление метаболизма.
Источник активации клеток врожденного иммунитета — связывание рецепторами своих лигандов с последующей передачей в клетку активационного сигнала, траснформируемого в сигнал, индуцирующий экспрессию генов. Для индукции генов необходимо образование в клетке ядерных (транскрипционных) факторов, обладающих сродством к определенным последовательностям ДНК и связывающихся с регуляторным (промоторным) участком соответствующих генов. В покоящихся клетках наборы транскрипционных факторов, необходимых для индукции этих генов, отсутствуют. Появление факторов транскрипции достигается разными путями: активацией предсуществующих неактивных факторов с их перемещением в ядро, синтезом этих факторов de novo или разрушением их инактиваторов. Факторы, необходимые для реализации этих процессов, должны быть в свою очередь индуцированы при активации клеток. Именно поэтому между мембранным рецептором, поставляющим активационный сигнал, и генами с их регуляторными участками расположена цепь передаточных (сигнальных) молекул. В процесс активации вовлечено несколько сигнальных путей, приводящих к образованию разных транскрипционных факторов. В состав внутриклеточных сигнальных путей входят ферменты — киназы (фосфорилируют белки или липиды, переводя их в активное состояние) и адапторные белки (передают промежуточные продукты активации между звеньями сигнальной цепи.
Основные факторы, вызвающие активацию клеток врожденного иммунитета — PAMP, узнаваемые патогенраспознающими рецепторами (в первую очередь — TLR). Передача сигнала по сигнальным путям проиллюстрирована на рис. 2.12 и 2.13. При связывании PAMP с мембранным TLR возникают конформационные изменения внеклеточной части рецептора, передающиеся на внутриклеточный домен TIR. В передаче активационного сигнала от TIR-домена ^R участвует несколько адапторных белков (MyD88, TIRAP, TRIF, TRAM), активирующих 2 основных сигнальных пути — MyD88-зависимый и TRIF-зависимый. MyD88-зависимый путь участвует в передаче сигнала от всех ^R, кроме TLR-3, использущего TRIF-зависимый путь. Передача сигнала от TLR-4 происходит с участием обоих сигнальных путей. MyD88 (при участии TIRAP) играет роль «мостика» между активным димером TLR и первой сигнальной киназой — серин- треониновой киназой IRAK-4. Активированная IRAK-4 запускает каскад реакций активации сигнальных ферментов: киназы IRAK-1, убиквитин- лигазы TRAF6 и киназы ТАК1.
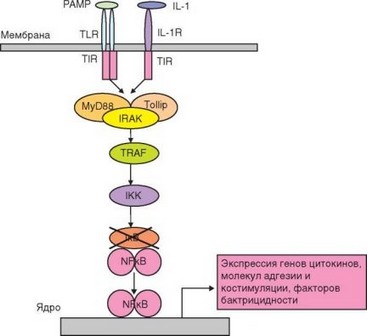
Рис. 2.12. Основной сигнальный путь, активируемый при связывании лигандов Toll-подобными рецепторами и приводящий к экспрессии транскрипционного фактора NF-kB и активации провоспалительных генов
На этом этапе передача сигнала может идти по двум путям. Один из них — активация тирозинфосфатазы IKK. Активация IKK происходит также при поступлении сигналов от эндолизосомального TLR-3 при посредстве адапторного белка TRIF и киназы RIP1. Основная мишень IKK — IkB (ингибирующая цепь неактивного комплекса, содержащего транскрипционный фактор NF-kB). Фосфорилирование IkB вызывает ее связывание с убиквитином, после чего она подвергается расщеплению в протеасоме. Освобожденный от IkB комплекс содержит активный димер NF-kB, миг- рирущий в ядро и связывающийся с промоторными участками многих провоспалительных генов (цитокинов, молекул адгезии, бактерицидных пептидов, ферментов и т.д.). Таким образом достигается главная цель активации — превращение клеток в эффекторы, обеспечивающие развитие воспалительной реакции и реализацию защитных функций врожденного иммунитета.
Второй путь передачи сигнала, раздваивающийся на уровне киназы ТАК1, состоит в активации MAP-каскада (MAP — от mitogen-activated proteinkinase) — серии последовательных активаций серинтреониновых
протеинкиназ от MAP-киназ 3-го (ТАК1) до 1-го уровня (JNK и p38). MAP-киназы 1-го уровня обеспечивают образование транскрипционного фактора АР-1 (Activation protein 1). АР-1 участвует в активации многочисленных генов, имеющих отношение к развитию не только воспаления, но и адаптивного иммунного ответа (см. раздел 3.5.2.1).
Передача сигнала от TLR, локализованных в эндолизосомах, происходит другим способом. От TLR-7, TLR-8, TLR-9 сигнал передается с участием адапторного белка MyD88 путем последовательной активации IRAK4, IRAK1, TRAF6 и ТАК1. Следующие за этим пути передачи сигнала также расходятся (рассмотрены выше). Они приводят к образованию транскрипционных факторов NF-kB и AP-1. Однако, в отличие от мембранных TLR, при передаче сигнала от эндолизосомальных TLR формируется дополнительная сигнальная ветвь. При формировании околорецепторного мультимолекулярного комплекса, включающего MyD88, IRAK4, IRAK1, TRAF3,
TRAF6, неактивный IRF7 (IRF — Interferone-responding factor) и некоторые другие факторы, происходит активация IRF7. Активированный IRF7 мигрирует в ядро и, соединяясь с последовательностью ISRE (Interferon-stimulated response element), играет роль транскрипционного фактора, ответственного за «включение» гена интерферона a (IFNa) (см. рис. 2.13).
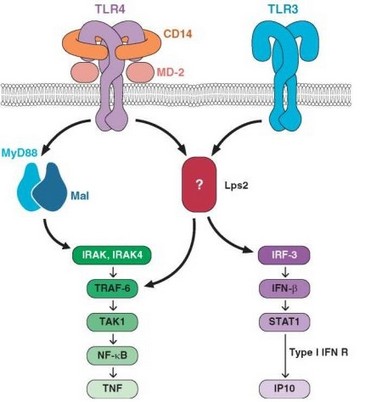
Передача сигнала от рецепторов TLR-3 и TLR-4 (при его экспрессии в эндолизосомах) происходит иным путем, но приводит к тем же результатам. Прежде всего в сигнальной цепи отсутствует MyD88. Роль первого адаптор- ного белка при этом играет TRIF (для TLR-4 — также TRAM). TRIF имеет участки связывания с белками RIP1 и TRAF3, инициирующими 2 пути передачи сигнала. Один из них состоит в активации киназы RIP1, активации IKK и формированию транскрипционного фактора NF-kB. Активация убиквитин-лигазы TRAF3 приводит (через промежуточную стадию с участием факторов TBK1 и IKKe) к активации фактора IRF3. Этот транскрипционный фактор индуцирует экспрессию генов интерферонов, причем в большей степени IFNp, чем IFNa.
Суммируя рассмотренные выше данные о сигнальных путях (см. рис. 2.13), можно констатировать образование 4 транскрипционных факторов, участвующих в развитии воспаления и проявлений врожденного иммунитета: NFkB (ключевой транскрипционный фактор провоспалительных генов), АР-1 (транскрипционный фактор для включения различных иммунологически значимых генов), IRF7 и IRF3 (транскрипционные факторы, ответственные за включение генов интерферонов — соответственно IFNa и IFNp). При этом мембранные TLR (TLR-5 и функциональный комплекс TLR-1/TLR-2/TLR-6) участвуют в активации NF-kB и АР-1, эндолизосомальные TLR (TLR-7, TLR-8 и TLR-9) ответственны за включение этих факторов и дополнительно IRF7, а мембранные рецепторы (TLR-3 и TLR-4) — за включение NF-kB и АР-1 и дополнительно IRF3. Таким образом, TLR, распознающие внеклеточные патогены, передают сигналы, приводящие к экспрессии провоспалительных генов, а TLR, распознающие внутриклеточные патогены (в частности вирусы), помимо провоспалительных, индуцируют гены интерферонов, обеспечивающих противовирусную защиту.
После взаимодействия мембранных TLR с лигандом происходит их интернализация и отделение от фактора MyD88. Это служит одним из факторов, обусловливающих временную «неотвечаемость» на повторное действие того же агента — толерантность, проходящую только через 2—3 сут. Реакция, развивающаяся при связывании TLR-4 с лигандом, отличается от описанной выше: TLR-4 интернализуется и теряет связь с MуD88, но сохраняет связь с фактором TRIF, что обусловливает его функционирование в составе эндолизосомы, о чем говорилось выше.
Изучение передачи сигнала от цитозольных паттернраспознающих рецепторов семейства NLR—NOD1/2 показало, что по результатам она сходна с передачей сигнала от мембранных TLR. Связывание с NLR их лигандов (мурамилпептидов) приводит к активации (при участии фактора RICK) комплекса IKK с последующим формированием фактора NF-kB и активацией каскада MAP-киназ c образованием транскрипционного фактора АР-1. При этом активации генов интерферонов не происходит.
Как уже сказано, к основным генам, активируемым под влиянием NF-kB, относят гены провоспалительных цитокинов. При экспрессии генов семейства IL-1 для синтеза функционально активного продукта (прежде всего IL-1P) необходим процессинг синтезированной молекулы- предшественницы, состоящий в ее расщеплении каспазой 1. В процессинге задействованы рецепторы NALP (цитозольные рецепторы семейства NLR), формирующие вместе с другими факторами и прокаспазой (все они содержат домен CARD) надмолекулярный комплекс инфламмосому, в которой и происходит активация каспазы 1.
Из приведенных выше данных следует, что PAMP-распознающие рецепторы, относящиеся к TLR и NLR, — главные факторы активации миелоид- ных клеток, задействованных в реакциях врожденного иммунитета. Другие паттернраспознающие рецепторы ответственны за выполнение функций, не требующих активации клеток, однако они могут участвовать в этом процессе в качестве корецепторов. Пример таких рецепторов — молекулы адгезии интегрины. Они связаны с тирозинкиназами и молекулами, имеющими активационные мотивы ITAM. Таким образом, интегрины способны активировать факторы, общие для нескольких путей активации ^м. 2.3.1.2), что способствует образованию транскрипционных факторов NF-kB и AP-1. Один из С-лектиновых рецепторов — дектин-1 имеет в своей цитоплазматической части последовательность ITAM, участвующую в передаче активационных сигналов. Связывание дектина-1 с р-глюканами дрожжевых форм грибов приводит к индукции провоспалительных генов, в том числе циклооксигеназы-2 и цитокинов, в частности TNFa, IL-6, IL-23, что определяет роль дектина-1 в защите от грибковой инфекции. Другие лектиновые рецепторы самостоятельно не участвуют в активации клеток, хотя и могут способствовать TLR-зависимой активации клеток.
Анализ сигнальных путей, активируемых при связывании провоспалительных цитокинов, выявляет очень высокую степень их сходства с MyD88-зависимой передачей сигнала (см. раздел 2.5.5.3). Для IL-1 эти пути идентичны сигнальным путям, запускаемым при связывании TLR, поскольку внутриклеточная часть рецептора для IL-1 представляет TIR-домен (что отражено в названии этого домена — Toll/IL-1 receptor and resistance domain). При образовании TNFa в передачу сигнала вовлечены факторы TRAF2 и TRAF3, что обусловливает наличие перекрестов с сигнальными путями TLR и TNFR. Результат сходства этих путей передачи сигнала — явление, называемое амплификацией ответа на PAMP. Оно заключается в том, что эффект, достигаемый при прямом действии патогенов и их продуктов в очаге инфицирования, дистантно воспроизводится полностью и даже в значительно большем масштабе за счет действия провоспалительных цитокинов на клетки врожденного иммунитета. Таким образом, амплифи- цирующие факторы —продукты PAMP-индуцированной активации.
Выше детально рассмотрен классический путь активации клеток врожденного иммунитета (прежде всего макрофагов), на котором основано вовлечение этих клеток в иммунную защиту и воспалительные реакции. Однако резидентным макрофагам и дендритным клеткам свойственны и другие формы ответа, направленные на осуществление гомеостатических функций, регенерацию тканей, а также ограничение воспалительных процессов. В их основе лежат иные пусковые факторы и сигнальные механизмы. Альтернативные пути активации миелоидных клеток на примере макрофагов представлены в табл. 2.12.
Таблица 2.12. Варианты активации макрофагов под влиянием различных сигналов
|
Показатель |
Варианты активации |
||
|
Классический |
Альтернативный |
Активация II типа |
|
|
Активирующий сигнал |
INFy + TNF (TLR) |
IL-4, IL-13 |
IgG-комплексы + TLR, CD40 или CD44 |
|
Секреторные продукты |
t TNF, t IL-12, IL-1, IL-6 |
t IL-1RA IL-10 |
t IL-10, i IL-12, TNF, IL-1, IL-6 |
|
Поверхностные маркеры |
t MHC-II, t CD86, i Маннозо-связы- вающий рецептор, i Fcy-RII |
t Маннозосвязывающий рецептор, t Рецепторы-мусорщики, t CD23, i CD14 |
t MHC II класса, t CD86 |
|
Ферменты |
t NO-синтаза, i Аргиназа |
t Аргиназа, i NO-синтаза |
i NO-синтаза |
|
Секретируемые хемокины |
IP-10 (CXCL10), MIP-1a (CCL3), MCP-1 (CCL2), |
PARC-1 (CCL18), MDC (CCL22), TARC (CCL17) |
Неизвестно |
|
Биологические эффекты |
Повышение бактерицидной и тумороцидной активности, презентация антигена |
Ускорение регенерации, подавление пролиферации Т-клеток, уменьшение бактери- цидности |
Противовоспалительная активность, усиление антителопродукции |
Таким образом, при действии разнообразных чужеродных (патогены) и эндогенных (цитокины) лигандов на рецепторы клеток врожденного иммунитета запускается весь комплекс процессов, необходимых для осуществления защиты — эндоцитоз (поглощение) чужеродных агентов и активация, приводящая к мобилизации защитных механизмов и секреции активных факторов защиты.
