Уже в начале 60-х годов XX века стало понятным, что макрофаги не являются единственным типом «вспомогательных» или, используя современную терминологию, АПК. Было сформулировано представление об А-клетках — малочисленных адгезивных клетках, обладающих очень высокой способностью обрабатывать антиген, делая его пригодным для стимуляции Т-лифмоцитов. В 1973 г. Р. Стейнман и З. Кон (R.M. Steinman, Z.A. Kohn) описали древовидные клетки лимфоидных органов и назвали их дендритными клетками. К концу 80-х годов были накоплены данные, позволяющие рассматривать эти клетки как главные «профессиональные» АПК. По эффективности презентации антигена они на 2 порядка превосходят макрофаги, что обусловлено прежде всего более высокой экспрессией на дендритных клетках продуктов генов МНС, особенно MHC-II, а также костимулирующих молекул. В результате только дендритные клетки способны активировать наивные Т-лимфоциты. Презентация антигена, являющаяся основной функцией дендритных клеток, служит сигналом для запуска иммунного ответа и в связи с этим будет рассмотрена в контексте адаптивного иммунитета (см. раздел 3.5.1). В этой главе представлено описание всех разновидностей гетерогенной популяции дендритных клеток, как миелоидных, так и лимфоидных.
Для зрелых дендритных клеток характерны 3 фундаментальных свойства, объединяющие все их разновидности:
- отростчатая, древовидная морфология в тканях и наличие псевдоподий и ворсинок (вуалевые клетки) в циркуляции и культуре клеток;
- высокая экспрессия зрелыми клетками молекул МНС не только I, но и II класса в сочетании с костимулирующими молекулами (CD80, CD86);
- способность захватывать (путем пиноцитоза и, в меньшей степени, фагоцитоза) и обрабатывать антиген с последующим его представлением Т-лимфоцитам, что вызывает активацию последних.
Дендритная морфология не является исключительной особенностью дендритных клеток. Так, в коже мышей присутствуют дендритные Т-лим- фоциты, гистогенетически не родственные дендритным клеткам. Только сочетание перечисленных свойств может служить основанием для отнесения клетки к разряду дендритных.
Дендритные клетки происходят от кроветворных стволовых клеток, т.е. имеют костномозговое происхождение. Представления о гистогенезе дендритных клеток объединены на рис. 2.8. Главные особенности развития дендритных клеток:
- дендритные клетки происходят как из миелоидных, так и из лимфоидных предшественников;
- способность к дифференцировке в дендритные клетки присуща представителям этих ростков на разных стадиях их развития. Наряду с этим допускается существование специализированного предшественника дендритных клеток;
- в периферической крови присутствуют дендритные клетки на промежуточных стадиях развития, после чего они мигрируют в ткани;
- по крайней мере для некоторых дендритных клеток характерно перемещение из барьерных тканей в лимфоидные, сопровождающееся их созреванием.
Большинство дендритных клеток принадлежит миелоидному ряду. В условиях культуры удается получить миелоидные дендритные клетки двумя способами: путем культивирования клеток костного мозга, обогащенных CD34+ стволовыми элементами, в присутствии GM-CSF и других цитокинов (чаще всего — TNFa, иногда — IL-3, SCF, FLT3L или TGFP) или при культивировании выделенных из крови моноцитов в присутствии GM-CSF и IL-4. Культивирование моноцитов in vitro в присутствии M-CSF приводит к дифференцировке CD14+ макрофагов, а культивирование в присутствии GM-CSF (для клеток человека — в сочетании с IL-4) — к дифференцировке CD14- дендритных клеток. Считают, что и in vivo миелоидные дендритные клетки могут развиваться как из гранулоцитарно-моноцитар- ных предшественников, так и из моноцитов.
Сходным образом происходит развитие лимфоидных дендритных клеток — они дифференцируются из CLP, а также из предшественников В- и Т-лимфоцитов, в частности из тимоцитов на самой ранней стадии их развития в тимусе — DN1 клеток ( см. раздел 3.3.2.3). Миелоидные и лимфоидные предшественники дендритных клеток экспрессируют цитокиновый рецептор FLT-3 (Fms-like tyrosine kinase 3), что отличает их от предшественн- ков других клеток (в частности моноцитов и лимфоцитов). Таким образом,
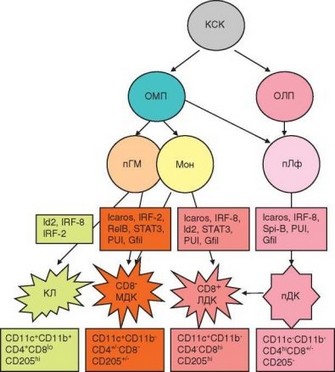
Рис. 2.8. Схема развития дендритных клеток с указанием мембранного фенотипа (нижние прямоугольники) и дифференцировочных факторов (верхние прямоугольники). КСК — кроветворная стволовая клетка; ОМП — общий миелоидный предшественник; ОЛП — общий лимфоидный предшественник; пГМ — грануло- цитарно-моноцитарный предшественник; пГ — предшественник гранулоцитов; пМ — предшественник моноцитов; пТц — претимоцит; пДК — предшественник дендритных клеток; Мон — моноцит, Мф — макрофаг; КЛ — клетки Лангерганса; МДК — миелоидные дендритные клетки; ЛДК — лимфоидные дендритные клетки
обычная дендритная клетка может дифференцироваться из 6—7 клеточных источников в пределах двух гистогенетических рядов.
Незрелые дендритные клетки обоих рядов циркулируют в крови, составляя в сумме менее 0,5% от общего числа лейкоцитов крови. В кровотоке присутствуют предшественники как миелоидных, так и лимфоидных дендритных клеток, а также клеток Лангерганса. Маркерами миелоидных предшествнеников служат молекулы CD11c и MHC-II.
Преобладающая разновидность циркулирующих в крови незрелых дендритных клеток — плазмоцитоидные дендритные клетки, относящиеся к лимфоидному ряду. Их название обусловлено внешним сходством с плазматическими клетками — потомками В-лимфоцитов, секретирующими антитела. Плазмоцитоидные дендритные клетки меньше моноцитов (8—10 мкм), а их ядро имеет менее выраженную выемку. В присутствии IL-3 и бактериальных продуктов они дифференцируются в зрелые лимфоидные дендритные клетки. На плазмоцитоидных клетках человека отсутствуют молекулы, характерные для миелоидных дендритных клеток (CD83, CD11b, CD11c), а также свойственные большинству миелоидных клеток — CD13 и CD14. Однако в них экспрессирован ген RAG, ответственный за запуск перестройки генов антигенраспознающих рецепторов (см. раздел 3.1.4.1) и выражены признаки перестройки генов TCR, характерные для Т-клеток (пре-Ta). Если для моноцитов характерна экспрессия CD45RA и рецептора для GM-CSF, то для плазмоцитоидных клеток — CD45R0 и рецептора для IL-3. Молекулы МНС-II на плазмоцитоидных клетках экспрессированы слабее, чем на миелоидных, и локализуются не только на поверхности, но и в цитоплазме. В спектре TLR (см. раздел 2.2.1), экспрессируемых плазмоцитоидными дендритными клетками, преобладают рецепторы, локализующиеся в цитоплазматических гранулах и распознающие нуклеиновые кислоты. Плазмоцитоидные дендритные клетки — главные источники интерферонов типа I (а, в, ю — см. раздел 2.5.6.1) синтез которых запускается в ответ на распознавание TLR специфического паттерна. Это определило их альтернативное название — клетки-продуценты интерферона (IPC — от Interferone-producing cells). Они секретируют большие количества этих цитокинов преимущественно в 1-е сутки после стимуляции вирусными нуклеиновыми кислотами.
Не достигнув полной зрелости, миелоидные и лимфоидные дендритные клетки мигрируют в ткани. Этому способствует наличие на поверхности этих клеток хемокиновых рецепторов практически ко всем р-хемокинам. Дендритные клетки широко представлены в различных органах и тканях, однако они присутствуют в них в малом количестве, что и послужило причиной их позднего открытия. По аналогии с макрофагами тканевые дендритные клетки иногда разделяют на резидентные (стационарные) и воспалительные. Резидентные дендритные клетки присутствуют преимущественно в барьерных тканях — коже и слизистых оболочках. Известно несколько разновидностей этих клеток, формирующихся под влиянием микроокружения — дендритные клетки дермы, эпидермиса, слизистой оболочки кишечника, слизистой оболочки легких.
Эпидермальные дендритные клетки обладают наибольшим своеобразием. Большинство из них представлено клетками Лангерганса, относящимися к миелоидному ряду. Эти клетки были описаны гистологами в конце XIX века как отростчатые клетки эпидермиса (по современной гистологической классификации — белые отростчатые эпидермоциты), но их природа и связь с иммунными процессами была установлена только в результате их изучения как дендритных клеток. Клетки Лангерганса имеют ряд существенных особенностей, отличающих их от других дендритных клеток. Прежде всего это присутствие в цитоплазме слоистых включений — гранул Бирбека. На поверхности клеток Лангерганса присутствует лектиновый рецептор лангерин (CD208) и «неклассическая» молекула МНС — CD1a, предназначенная для презентации липидных антигенов. Лангерин присутствует уже на циркулирующих предшественниках этих клеток. Гистогенез клеток Лангерганса до конца не выяснен. В настоящее время считают, что они развиваются местно из предшественников дендритных клеток, мигрирующих из костного мозга.
В условиях воспаления дендритные клетки барьерных тканей интенсивно поглощают (путем пино- или фагоцитоза) окружающий материал, в том числе чужеродные продукты; активируются патогенами (точнее «образами патогенности» — PAMP, представленными на поверхности патогенов) и подвергаются действию провоспалительных цитокинов. Под влиянием этих стимулов незрелые дендритные клетки покидают ткани и с тканевой жидкостью через лимфатические сосуды поступают в региональные лимфатические узлы. В процессе миграции происходит созревание дендритных клеток: их способность к эндоцитозу значительно ослабевает; они осуществляют переработку поглощенного материала и встраивают пептидные фрагменты белков в молекулы MHC (см. раздел 3.2.2.2); на поверхности клеток усиливается экспрессия молекул МНС-II и костимулирующих молекул CD80 и CD86. Усиленная экспрессия MHC-II, CD80 и CD86 способствует выполнению дендритными клетками их основного назначения — презентации антигенных пептидов Т-лимфоцитам. В ходе миграции изменяется набор экспрессируемых дендритными клетками мембранных рецепторов для хемокинов, что способствует попаданию их в зоны лимфатических узлов, занимаемые Т-лимфоцитами (Т-зоны). Вместо рецепторов для хемо- кинов, экспрессируемых клетками барьерных тканей, на созревающих дендритных клетках появляются рецепторы CCR7 и CXCR4. Именно эти рецепторы распознают хемокины, выделяемые стромальными клетками Т-зон лимфатических узлов. Рецепторы CCR7 и CXCR4 экспрессируют также наивные Т-лимфоциты, в результате чего они тоже мигрируют в Т-зоны лимфатических узлов. В Т-зонах происходит презентация антигена (см. раздел 3.5.1). Зрелые дендритные клетки, доставившие антиген в лимфатический узел, становятся частью стромы Т-зон и обозначаются как интердигитальные дендритные клетки, поскольку между их отростками- «пальцами» располагаются Т-лимфоциты. Сходное происхождение имеют интердигитальные клетки Т-зон пейеровых бляшек и селезенки, хотя пути миграции клеток в эти структуры иные (не лимфогенные).
Резидентные миелоидные дендритные клетки также заселяют органы на стадии незрелых и даже клеток-предшественников. Завершая свое развитие местно, они уже не покидают орган. Тканевое микроокружение достаточно сильно влияет на их свойства (сходно с резидентными макрофагами и тучными клетками). Многие из них сосредоточены в лимфоидных органах. Различают дендритные клетки тимуса, зародышевых центров, маргинальной зоны селезенки, печени и т.д.
Судьба плазмоцитоидных дендритных клеток в процессе и после их миграции в лимфоидные органы также изучена достаточно подробно. В отличие от предшественников миелоидных дендритных клеток, попадающих в лимфатические узлы с афферентной лимфой, плазмоцитоидные дендритные клетки проникают в лимфатические узлы тем же путем, что и Т-лимфоциты — через высокий эндотелий посткапиллярных венул. При стимуляции (вирусами или IL-3) плазмоцитоидные дендритные клетки в течение первых суток интенсивно секретируют интерфероны I типа, а затем в течение вторых суток дифференцируются в зрелые лимфоидные дендритные клетки. При этом на них значительно возрастает экспрессия молекул МНС-II, появляются костимулирующие молекулы CD80 и CD86. Клетка продолжает секретировать интерфероны, но в меньшем количестве. При стимуляции вирусами созревающая дендритная клетка способствует диф- ференцировке Т-клеток-продуцентов IFNy (Th1-клеток), а при стимуляции IL-3 — Т-клеток — продуцентов IL-4 (^2-клеток).
Наибольшие возможности для анализа структуры популяции дендритных клеток дает изучение мембранного фенотипа клеток методом проточной цитометрии с использованием моноклональных антител. Как уже отмечалось, характерная и функционально значимая особенность мембранного фенотипа зрелых дендритных клеток — присутствие на их мембране значительного количества молекул МНС-II (MHC-I присутствуют в более ограниченном количестве), а также костимулирующих молекул CD80 и CD86. Именно этот набор молекул делает дендритные клетки АПК. Во взаимодействии с Т-лимфоцитами (при получении от них стимулирующего сигнала) участвует мембранная молекула дендритных клеток CD40. Общий маркер миелоидных дендритных клеток и у человека, и у мыши — CD11c, т.е. %-цепь интегрина aXP2 (CD11c/CD18). Маркер зрелых миелоидных дендритных клеток — CD83. Из данных о центральной роли GM-CSF в качестве фактора роста дендритных клеток следует, что присутствие на их поверхности рецептора этого фактора (CD116) является обязательным. Данные о характерных молекулах и маркерах дендритных клеток и их субпопуляций представлены на рис. 2.6 и 2.9, а также в табл. 2.7 (в сопоставлении с моноцитами).
Таблица 2.7. Свойства дендритных клеток типов DC1 и DC2
|
Характеристика |
DC1 |
DC2 |
|
Гистогенез |
Миелоидные |
Лимфоидные |
|
Индуцирующие цитокины |
IL-12, IFNy |
IL-10 |
|
Фенотип |
CDUchi CD123llt;o |
CD11c- CD123hi |
|
Продуцируемые цитокины |
IL-12 |
IFNy |
|
Влияние на Т-клетки |
Активация |
Индукция анергии |
У мышей анализ субпопуляций дендритных клеток облегчает определение экспрессии молекул CD8 и CD4 (обычно рассматриваемых как корецепторы Т-клеток), характеризующих их основные субпопуляции. CD8 маркирует значительную часть лимфоидных дендритных клеток мыши. На некотрых CD8- клетках экспрессирована молекула CD4. Для различения субпопуляций дендритных клеток используют также определение лектино- вых рецепторов — DEC-205 ^D205) и лангерина (CD208), а также молекулы CD11b — аМ-цепи интегрина аМрз (Мас-1). По наличию и степени экспрессии этих маркеров у мышей выделяют 5 субпопуляций дендритных клеток: лимфоидные ^D4+ CD8hi CD205hi CD11b-); 3 субпопуляции миелоидных дендритных клеток ^D4+ CD8- CD205- CD11b+, СD4- CD8- CD205- CD11b+и СD4- CD8- CD205+ CD11b+) и клетки Лангерганса ^D4- CD8llt;o CD205hi CD11b+). Изучение распределения этих субпопуляций в лимфоидных органах показало, что в тимусе присутствуют преимущественно лимфоидные (но есть и
миелоидные) дендритные клетки. В селезенке и брыжеечных лимфатических узлах преобладают (в разных соотношениях) субпупопуляции миело- идных клеток. В лимфатических узлах, дренирующих кожу, наряду с мие- лоидными дендритными клетками, высоко содержание клеток Лангерганса. Пока не вполне ясно, являются ли зрелые клетки, развивающиеся из плаз- моцитоидных дендритных клеток, единственными лимфоидными дендритными клетками вторичных лимфоидных органов или же часть клеток этой популяции может развиваться из других источников.
У человека CD4 присутствует на некоторых дендритных клетках (делая их одной из мишеней ВИЧ), тогда как CD8 на них отсутствует. В связи с отсутствием экспрессии молекулы CD8 для характеристики мембранного фенотипа субпопуляций дендритных клеток человека используют частично другие маркеры. Для миелоидных дендритных клеток человека характерен фенотип — СDПc+ CD11b+ CD45R0hi, для лимфоидных дендритных клеток — CD11c+ CD11b- CD45R0\ для клеток Лангерганса — CD11c+ СD207+.
В настоящее время в качестве конечных продуктов дифференцировки миелоидных и лимфоидных дендритных клеток (особенно у человека) рассматривают соответственно субпопуляции DC1 и DC2 (табл. 2.7). Наиболее характерные отличительные черты этих клеток — особенности экспрессии молекул CD11c и рецептора для IL-3 — CD123: миелоидные клетки DC1 имеют фенотип CD11chi CD123llt;o (выявлена минорная разновидность миелоидных дендритных клеток с фенотипом CDUc^ CD123-), а лимфоидные DC2 — CD11c- CD123hi. В периферической крови содержится по 0,2% клеток DC1 и DC2. Дифференцировка DC1 и DC2 может регулироваться действием на клетки-предшественники различных комбинаций провоспалительных и противовоспалительных факторов (рис. 2.9). DO-клетки обладают сильной
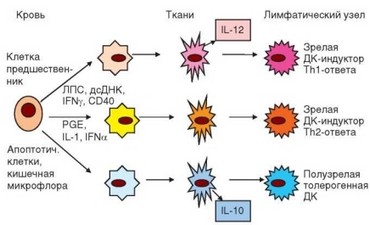
Рис. 2.9. Зависимость функционального потенциала дендритных клеток от условий их дифференцировки in vitro. Около стрелок, отходящих от «клетки-предшественницы», указаны факторы, определящие дифференцировку дендритных клеток в указанных направлениях
способностью активировать Т-лимфоциты при презентации антигена, а также индуцируют дифференцировку ТЫ-клеток (см. раздел 3.5.3.1), В то же время DC2-клетки при презентации антигена направляют дифференцировку Т клеток по ^2-пути. И наконец, можно получить дендритные клетки, избирательно индуцирующие регуляторные Т-клетки, т.е. являющиеся толерогенными (см. раздел 4.3.2.2).
