Селектины — тканевые лектины, обладающие сродством к концевым остаткам маннозы и фукозы. Для связывания селектинов с лигандами необходимо присутствие ионов Са2+ (свойство группы С-лектинов). Известно три варианта селектинов: P (от Platelet — тромбоцитарный), E (от Endothelial — эндотелиальный) и L (от Lymphocyte — лимфоцитарный) (рис. 2.14). Они имеют однотипное строение. В их состав входит 3 домена: наружный — собственно лектиновый, промежуточный — подобный эпидермальному фактору роста, и несколько коротких согласительных (consensus) повторов, прилегающих к мембране, — доменов контроля комплемента. Число согласительных повторов варьирует в разных видах селектинов и составляет основу их структурных различий: L — 2, Е — 6, Р — 9. Селектины — трансмембранные белки с коротким цитоплазматическим участком, связанным с молекулами кальмодулина, актина и белка ERM. Кальмодулин предотвращает «смывание» (шединг) молекул селектина. Под влиянием цитокинов (TNFa, IL-1) кальмодулин отсоединяется от внутриклеточной части селектина L, в результате чего происходит отделение внеклеточной части молекулы и ее смывание в окружающую среду.
Р-селектин содержится в секреторных гранулах эндотелиальных клеток и тромбоцитов. При активации эндотелиальных клеток он быстро мобилизуется на поверхность клетки и может быть смыт с нее во внеклеточную среду. Р-селектин участвует в активации тромбоцитов и ранних этапах
2.3. Клеточные механизмы врожденного иммунитета
миграции лейкоцитов в очаг воспаления. Е-селектин — основной селек- тин клеток эндотелия сосудов. Под влиянием активирующих воздействий (особенно провоспалительных цитокинов) Е-селектин экспрессируется на поверхности клеток и играет ведущую роль на ранних этапах эмиграции лейкоцитов из сосудистого русла. В отличие от двух вышеназванных, L-селектин присутствует не на эндотелиальных клетках, а на лейкоцитах. Он спонтанно экспрессируется на поверхности нейтрофилов, моноцитов и лимфоцитов и обеспечивает осуществление начального этапа миграции этих клеток — этапа перекатывания (см. раздел 2.3.3).
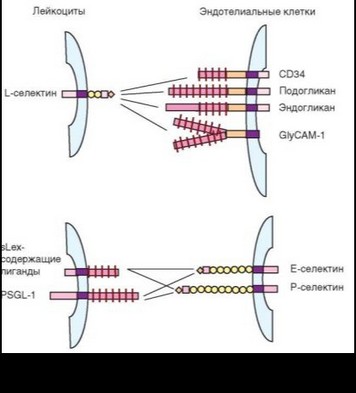
Селектины распознают концевые остатки маннозы и фукозы, входящие в состав полисахаридов и гликоконъюгатов (см. рис. 2.14). Рецепторами L-селектинов служат вещества, называемые адрессинами — PNAd (Peripheral lymph node adressin). Название связано с тем, что L-селектины и их лиганды были описаны при изучении миграции (хоминга) лимфоцитов в лимфоидные органы; адрессины служат тем «адресом», по которому направляются лимфоциты. По химической природе адрессины относят к муцинам — гликопротеинам, содержащим множественные О-гликановые группы
(т.е. углеводные группы, присоединенные к белку через остатки серина и треонина). Основные рецепторы L-селектина: молекула CD34, подокаликсин, эндогликан и GlyCAM-1 (экспрессированы на поверхности эндотелиальных клеток). Все перечисленные рецепторы — трансмембранные белки, имеющие в составе внеклеточной части цистеинсодержащий участок, и собственно муциновый домен различной величины; эндогликан содержит также N-концевой кислый участок. CD34 и подогликан присутствуют в неактивной форме на любых эндотелиоцитах. После активации этих клеток цитокинами CD34 и подогликан приобретают способность связываться с L-селек- тином. CD34 экспрессируют и кроветворные клетки-предшественники, в том числе стволовые, а также стромальные клетки лимфоидных органов. Молекула GlyCAM-1 существует в мембранной и растворимой формах. Этот муцин имеет разветвленную (2 ветви) структуру углеводного компонента. L-селектин распознает углеводную составляющую адрессинов. Чаще всего это — сиалированные детерминанты группового вещества Льюиса—sLex (CD15). Состав этой детерминанты: Sia а2^3 Gal pi^4Fuc al^GlcNAc. Связывание усиливается после сульфатирования детерминанты (SOj-группа присоединяется к остатку N-ацетилглюкозамина или галактозы).
L-селектин формирует слабую связь с адрессинами; к тому же его молекула, как упомянуто выше, легко смывается с поверхности клеток (шединг), в связи с чем опосредованный L-селектином контакт между лейкоцитом и эндотелиальной клеткой неустойчив. Это проявляется в перекатывании лейкоцитов вдоль сосудистой стенки — качение, или роллинг (rolling). Именно с качения начинается процесс эмиграции лейкоцитов из сосудистого русла.
На этом этапе определенный вклад вносит взаимодействие лейкоцитов с эндотелиальными клетками, обусловленное участием двух других селек- тинов. Однако Е- и Р-селектины экспресируются (под действием провоспалительных цитокинов) не на лейкоцитах, а на эндотелиальных клетках. Лейкоциты же несут на своей поверхности их рецепторы (см. рис. 2.14): PSGL-1 (P-selectin glycoprotein ligand-1 — CD162) и его фукозилированное производное — антиген кожных лимфоцитов CLA (Cutaneous lymphocyte antigen), а также муцины, содержащие sLex (CD66, CD24 и др.), и некоторые интег- рины (например, a4P7). PSGL-1 представляет собой сиаломуцин с участками О- и N-гликозилирования (через остатки тирозина). PSGL-1 представлен на нейтрофилах, моноцитах, большинстве лимфоцитов. Для взаимодействия PSGL-1 с селектинами необходимо присоединение сульфогруппы к тирозину в его N-концевой части. PSGL-1 имеет довольно протяженный цитоплазматический участок, связанный с тирозинкиназой Syk, что определяет способность этого рецептора передавать в клетку активационный сигнал. Фукозилированная форма PSGL-1 — CLA, формирующаяся с участием фермента а1,3-фукозилтрансферазы VII на некоторых Т-клетках, определяет их миграцию в эпидермис за счет специфического сродства CLA к Е-селектину сосудистого эндотелия.
