В геноме человека и млекопитающих выделяют 6 кластеров (скоплений) генов, кодирующих молекулы полипептидных цепей антигенраспознающих молекул — Н-, к- и Х-цепей иммуноглобулинов и а-, в- и у- цепей TCR ав- и у5-типов (табл. 3.5, рис. 3.12 и 3.13). Последовательности, кодирующие 5-цепь TCR, расположены внутри гена а-цепи, но обычно их рассматривают как отдельный, 7-й генетический кластер. Гены человека обозначают прописными буквами — сначала буквы, обозначающие молекулу, в состав которой входит кодируемая цепь (IG или TR), затем название цепи в латинском эквиваленте (Н, К, L, A и т.д.) и завершает обозначение тип кодируемого участка молекулы (вариабельный или константный — V или С). Например, ген IGHV кодирует вариабельный домен Н-цепей иммуноглобулинов. Гены расположены на четырех хромосомах — 2 (к), 7 (в, у), 14 (Н, а, 5) и 22 (X).
Таблица 3.5. Характеристика генов, кодирующих антигенраспознающие рецепторы
|
Моле кула |
Цепь |
Гены (V и C) |
Хро- мосо- ма |
Размер гена, кбаз |
Структура транскрипта |
Число сегментов |
||||
|
непере строенного |
перестро енного |
|||||||||
|
V |
D |
J |
С |
|||||||
|
ig |
H |
IGH |
14q |
957 |
300 |
VDJC |
45 (129)* |
12 |
14 |
9 |
|
к |
IGK |
2p |
Около 100 |
Нет данных |
VJC |
18 (40) |
— |
4 |
1 |
|
|
х |
IGL |
22q |
98 |
Нет данных |
VJC |
30 (71) |
— |
4 |
4 |
|
|
ТСЯар |
а |
TRA |
14q |
Около 1000 |
1,7 |
VJC |
45 (54) |
— |
61 |
1 |
|
в |
TRB |
7q |
680 |
1,3 |
VDJC |
41 (65) |
2 |
14 |
2 |
|
|
TCRy5 |
Y |
TRG |
7p |
160 |
1,6 |
VJC |
6 (15) |
- |
5 |
2 |
|
5 |
TRD |
14q |
60 |
2,0 |
VDJC |
3 |
3 |
4 |
4 |
|
* Указано число функционирующих сегментов, в скобках — общее число сегментов, включая псевдогены.
В каждом кластере присутствуют гены, кодирующие константные домены — С-гены (в случае кластера IGH — 9, по числу изотипов Н-цепей). В кластерах присутствуют также V-сегменты, кодирующие не весь вариабельный домен, а только 95—96 аминокислотных остатков, расположенных до участка CDR3. V-сегменты содержат около 300 пар оснований. Число V-сегментов, последовательно расположенных в 5’-части кластера, сильно

Рис. 3.12. Структура локусов иммуноглобулиновых генов (IG) человека
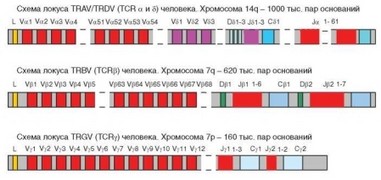
Рис. 3.13. Структура локусов, кодирующих Т-клеточный рецептор (TR) человека
варьирует — от 3 (в TRDV) до 129 (в IGHV). Некоторые V-сегменты не экспрессируются (псевдогены), так что реальное число кодирующих генов значительно меньше (для IGHV — 45). V-сегменты и C-гены пространственно разобщены. Между ними на значительном расстоянии от V-сегментов расположены короткие сегменты — J (соединительные — от Joining), содержащие 35—50 пар оснований, а в некоторых кластерах (Н, B, D) — также D-сегменты (от Diversity). Число сегментов J и D варьирует (J — от 4 до 61, D — от 2 до 12).
Между V-, D- и J-сегментами расположены рекомбинационные сигнальные последовательности (RSS — Recombination signal sequences). С З’-конца («справа» — см. рис. 3.12 и 3.13) от V-гена расположена консервативная последовательность из 7 нуклеотидных остатков (гептамер) 5’CACAGTG3’, далее — соединительный участок (спейсер), содержащий 12 или 23 основания, и нонамер (5’ACAAAAACC3’). И гептамеры, и нонамеры имеют палиндромные последовательности (при считывании в обоих направлениях они оказываются комплементарными). После участка с «нерегламентированной» последовательностью следует нонамер, участок из 23 или 12 оснований, гептамер и J- или D-сегмент. «Правило 12/23» соблюдается всегда: если правее (на 3’-конце) первого кодирующего участка (например, V) расположен 12-членный спейсер, то левее (на 5’-конце) второго участка (например, J) должен располагаться 23-членный спейсер, и наоборот. Последовательности рассмотренных участков для кластеров иммуноглобулиновых генов представлены на рис. 3.14. Кластеры генов TCR организованы аналогичным образом.
Приведенное выше строение кластеров рецепторных генов характерно для всех клеток, кроме зрелых лимфоцитов. Описанную конфигурацию генов называют зародышевой, и V-сегменты, кодирующие V-домен без 3-го гипервариабельного участка, также называют зародышевыми. В зрелых лимфоцитах эти участки организованы иначе — они содержат зрелый V-ген, кодирующий полный V-домен (образован за счет присоединения к зародышевому V-сегменту одного из DJ-сегментов). Описанные выше упорядоченные участки между сегментами V и DJ удаляются в результате глубокой перестройки структуры генетических кластеров, кодирующих рецепторные гены, называемой реаранжировкой (рекомбинацией) генов. Этот процесс происходит при дифференцировке в каждом лимфоците независимо, что приводит к формированию зрелого V-гена, уникального для данной клетки. Случайно отобранные V- и DJ-сегменты соединяются, при этом неиспользуемый генетический материал удаляется.
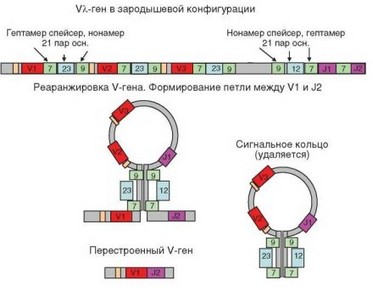
Рис. 3.14. Схема перестройки V-генов иммуноглобулинов на примере генов Х-цепи
Реаранжировка генов рецепторов лимфоцитов начинается с экспрессии под влиянием дифференцировочных стимулов генов ^Б^-рекомбинацион- ного комплекса. Это комплекс содержит 6 компонентов:
- димер рекомбиназ (экзонуклеаз) RAG-1/RAG-2;
- ДНК-зависимую протеинкиназу;
- ДНК-лигазу IV;
- терминальную дезоксинуклеотидилтрансферазу (TdT), кодирующую нематричный синтез олигодезоксинуклеотидов;
- гетеродимер HMG 1/2;
- гетеродимер Ku70/Ku80.
При наличии сегмента D (гены H-цепи иммуноглобулинов, в- и 5-цепей TCR) сначала происходит перестройка на участке между D- и J-сегментами с формированием тандема DJ. Далее перестройка захватывает участок между V- и DJ-сегментами. В обоих случаях сначала происходит реорганизация пространства между перестраиваемыми участками с помощью RSS. Этот процесс начинается с экспрессии генов RAG. Молекулы RAG-1 и RAG-2 присоединяются к концам последовательностей 12 и 23 соединяемых участков гена. Затем субъединицы RAG димеризуются и происходит сближение связанных с ними участков. Этому способствует комплементарное взаимодействие пар гептамеров и нонамеров, основанное на палиндромности этих последовательностей (см. рис. 3.14). Этот процесс осуществляется с участием гетеродимера HMG1/2. В местах примыкания RSS к кодирующим последовательностям происходит разрыв двух нитей ДНК (он катализируется рекомбиназой RAG), причем не в точно определенной позиции, а с возможными отклонениями в несколько нуклеотидных остатков. Разорванные нити ДНК замыкаются друг на друга. В результате формируется «шпилька», в которой ведущая нить ДНК переходит в комплементарную ей нить (рис. 3.15). Вырезанный отрезок, содержащий RSS, замыкается при соединении разорванных нитей. В результате формируется кольцевая структура — рекомбинационное вырезанное кольцо (REC — от Recombination excision circle).
На следующем этапе происходит «разрешение» шпилек с обеих сторон от места разрыва: при участии ДНК-зависимой протеинкиназы эндонуклеаза повторно разрывает ДНК, но не на вершине «шпильки», а сбоку, образуемые при этом отрезки ДНК различаются по длине. Более длинная нить разворачивается, и на ней комплементарно достраивается вторая. Описанные события приводят к появлению в составе ДНК новой последовательности, палинд- ромной по отношению к исходной. Такую последовательность называют «Р-вставка» (от Palindromic) (рис. 3.16). В этот же очень короткий промежуток времени с участием TdT происходит добавление на свободных концах ДНК олигонуклеотида случайного состава. Поскольку синтез этого олигонуклеотида происходит не на матрице ДНК, такой вариант вставки называют N-вставкой (от Non-template). Протяженность N-вставок не превышает 20 нуклеотидов (обычно меньше 10). Только после этого происходит воссоединение нитей ДНК с 5’- и 3’-концов. В процессах репарации ДНК участвуют ДНК-лигаза IV, ДНК-зависимая протеинкиназа и димер Ku70/Ku80. На этом процесс реаранжировки конкретного гена завершается. Сформированный
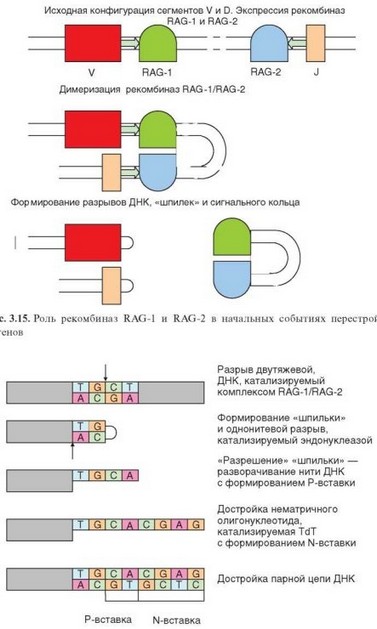
Рис. 3.16. Образование P- и N-вставок при реаранжировке V-генов

зрелый ген может транскрибироваться. После сплайсинга мРНК с нее транслируется белок — цепь иммуноглобулина или молекулы TCR (рис. 3.17).
Описанные процессы происходят в 3’-концевой части V-гена — в участке, сформированом при участии DJ-сегментов. Эта область соответствует третьему гипервариабельному участку — CDR3. В результате этот участок значительно превосходит по вариабельности CDR1 и CDR2, структура которых при реаранжировке V-генов не изменяется.
Реаранжировка происходит с соблюдением правил, обеспечивающих высокую упорядоченность этого сложного процесса. Прежде всего, запуск перестройки V-генов в кластерах, кодирующих антигенраспознающие структуры BCR и TCR, происходит под влиянием дифференцировочных сигналов. Лишь «подготовительная» перестройка в регионе D- и J-сегментов может проходить в других клетках (кроме Т- и В-лимфоцитов), например в естественных киллерах, родственных по своему происхождению Т-лимфоцитам. Перестройка конкретного V-гена всегда начинается в одной хромосоме. При ее успешном завершении прекращается экспрессия генов RAG, что означает прекращение перестройки (ген на второй хромосоме остается неперестроенным и не функционирует). Неудачи при реаранжировке генов чаще всего связаны со сдвигом рамки считывания, происходящим в 2/3 случаев. При подобном нарушении перестраивается V-ген на другой хромосоме аллельной пары. При успешном завершении реаранжировки он оказывается единственным функционирующим геном. Таким образом происходит «аллельное исключение», т.е. достигается моноспецифичность антигенраспознающих рецепторов. Поскольку в лимфоците всегда присутствует только 1 полноценно перестроенный ген, аллельное исключение затрагивает и C-гены. Именно поэтому иммуноглобулиновые рецепторы лимфоцитов однородны также по изотипу и аллотипу. При неудачной перестройке генов иммуноглобулинов на обоих хромосомах клетка погибает путем апоптоза. Это происходит примерно в 45% случаев.
Все антигенраспознающие рецепторы состоят из 2-х типов цепей, участвующих в формировании активного центра рецептора. Перестройке
подвергаются V-гены всех цепей, формирующих клеточный рецептор, но не одновременно, а последовательно: в В-клетках сначала перестраиваются гены Н-, а затем — L-цепей; в арТ-клетках — сначала гены Р-, а затем а-цепей. Только в у5Т-клетках перестройка V-генов у- и 5-цепей происходит почти одновременно. Условия перестройки 1-й цепи, как правило, более жесткие, чем аналогичные условия для 2-й цепи. Сначала перестраиваются V-гены к-, а затем ^-цепей; при этом в каждом случае последовательно перестраиваются гены сначала на одной, а потом на другой хромосоме. Именно поэтому вероятность успешной перестройки увеличивается в 2 раза. Кроме того, гены кластера к-цепей IGK организованы таким образом, что содержат 3 С-гена со своими J-сегментами. Один и тот же V-ген может повторно объединиться с разными J-сегментами. В арТ-клетках перестройка гена а-цепи сначала проходит так же, как предшествовавшая перестройка гена P-цепи. Однако при неудачной повторной перестройке а-гена происходит запуск механизмов редактирования — ген RAG экспрессируется повторно и перестраивается другой зародышевый Vа-сегмент, не попавший ранее в экс- цизионное кольцо. Этот процесс может повторяться до образования функционального гена легкой цепи. В результате потери клеток при реаранжировке генов второй цепи рецептора значительно ниже, чем при перестройке гена первой цепи. Редактирование гена а-цепи может происходить даже в периферическом отделе иммунной системы, например, при распознавании Т-клеткой аутоантигена или при беременности. Если перестраивается ген а-цепи, находящийся в зародышевой конфигурации во второй хромосоме, может возникнуть ситуация, нарушающая аллельное исключение. В этом случае в одной Т-клетке будет присутствовать 2 разных TCR с одинаковой Р- и разными а-цепями.
Хуже всего изучены механизмы выбора Т-клеткой формирования рецепторов у5 - или ар-типов. Перестройка генов TRBV, TRGV и TRDV начинается практически одновременно. Перестройка V-генов у- и 5-цепей завершается экспрессией мембранного рецептора в комплексе с CD3, а перестройка V-гена р-цепи — экспрессией «временного» пре-Т-рецептора; при ее успехе запускается реаранжировка гена а-цепи. Экспрессия у5 - или пре-Г-рецеп- торов служит источником сигналов (соответственно, сильного и слабого), блокирующих экспрессию рецептора альтернативного типа. При определении, какой из рецепторов будет экспрессирован, важную роль играют ингибирующие участки промоторов — сайленсеры, подавляющие активность других генов. Установлена активность сайленсеров, локализованых в генах у-цепей и подавляющих экспрессию этого гена и, следовательно, формирование TCRy5-типа. Выбор между линиями дифференцировки Т-лимфоцитов в ар - и у5-клетки происходит до перестройки гена а-цепи. После его перестройки возврат на у5-путь становится невозможным в связи с делецией гена 5-цепи (он попадает в эксцизионное кольцо при реаранжировке а-гена). На разных этапах онтогенеза срабатывают механизмы, обеспечивающие предпочтительность формирования TCR разных типов: у5 — в эмбриогенезе, ар — после рождения. Действительно, у взрослых даже при наличии перестроенных генов у- и 5-цепей перестройка гена р-цепи направляет развитие клетки в сторону арТ-лимфоцитов.
Описанные процессы повышают вариабельность рецепторных V-генов в разной степени. Во-первых, вариабельность этих генов заложена в их зародышевой конфигурации. При наличии 30—40 вариантов зародышевых V-генов (что соответствует действительности для цепей, образующих TCR ар-типа и иммуноглобулины) комбинирование V-доменов двух цепей при построении антигенсвязывающего участка приводит к формированию 1000—1500 вариантов клеточных рецепторов (т.е. в 1000 раз меньше, чем необходимо для распознавания всего множества антигенов). Комбинация различных зародышевых V- и J- (а для половины цепей — еще и D-) сегментов повышает эту величину на 1—2 порядка. При этом необходимо учитывать неточную локализацию разрывов цепей ДНК V-, D- и J-сегментов при реаранжировке генов, а также наличие Р- и N-вставок. Наконец, к троекратному увеличению вариабельности приводит смещение рамки считывания в D-сегменте. По некоторым данным, суммарная вариабельность антигенраспознающих участков достигает для BCR 1012—1017, для TCRaP — 1016—1019, для TCRy5 — 1012—1017 вариантов (табл. 3.6). Очевидно, что в полной мере такая вариабельность не может быть реализована (общее число клеток в организме человека составляет 1013—1014, из них менее 1012 — лимфоидные). Реальное число клонов Т-клеток, отражающее число вариантов антигенраспозна- ющих участков TCR, составляет 2,5х107, что заведомо превышает число объектов распознавания. Таким образом, процесс реаранжировки V-генов успешно решает задачу генерации разнообразия антигенраспознающих структур лимфоцитов.
Таблица 3.6. Источники разнообразия антигенраспознающих рецепторов
|
Источник вариабельности |
Н |
К |
X |
a |
р |
Y |
5 |
|
Число функционирующих V-сегментов |
45 |
18 |
30 |
45 |
41 |
4-6 |
3 |
|
Число вариантов D-сегментов |
14 |
- |
- |
- |
2 |
- |
2 |
|
Число вариантов J-сегментов |
12 |
4 |
4 |
45 |
41 |
3 |
2 |
|
Неточность разрывов-соединений нити ДНК |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
|
Использование 3-х рамок считывания D-сегмента |
+ |
- |
- |
- |
++ |
- |
- |
|
N-и Р-нуклеотиды |
++ |
+ |
+ |
+ |
++ |
+ |
++ |
|
Число комбинаций V(D)J |
104 |
103 |
70 |
||||
|
Число комбинаций цепей |
107 |
1011 |
106 |
||||
|
Всего вариантов |
1014 |
1016 |
109 |
||||
Вследствие полной независимости в каждой лимфоидной клетке описанных процессов структура зрелых V-генов в каждом лимфоците уникальна (вероятность повторения этой структуры 10-17—10-19, т.е. фактически равна нулю). Именно поэтому формирующиеся 107—108 вариантов V-генов распределены во всей популяции лимфоцитов. Таким образом, геном лимфоидных клеток отличается от генома других соматических клеток структурой генетических кластеров, кодирующих антигенраспознающие молекулы. Кроме того, этими же особенностями различаются В-, арТ- и у5Т-клетки.
