Комплекс полипептидных цепей, называемый CD3, выявили в 1979 г. с помощью моноклональных антител. Позже было установлено, что он входит в состав TCR и выполняет сигнальную функцию. Комплекс включает молекулы 4 типов — у, 5 (не путать с у- и 5-цепями димера TCR), е и Z (рис. 3.9). Димер Z-цепей в настоящее время выделяют в особый комплекс, имеющий свой CD-номер (CD247). Характеристика всех упомянутых цепей представлена в табл. 3.3.
Все цепи, образующие CD3 и CD247, представляют собой трансмембранные белки I типа (ориентированы своей N-концевой частью наружу). Внеклеточные части у-, 5- и е-цепей содержат по 1 домену суперсемейства
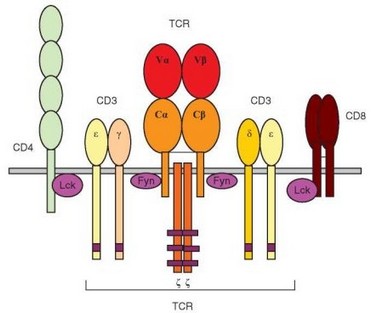
Рис. 3.9. Схема Т-клеточного рецептора и связанных с ним молекул. В рецепторный комплекс Т-лимфоцитов, помимо антигенраспознающего димера, (в данном случае — ар) входят трансмембранные полипептидные цепи, образующие комплекс CD3, а также Z-димер и связанные с рецептором внутриклеточные тирозинкиназы (киназы окрашены фиолетовым). Фиолетовые полосы в цитоплазматической части цепи — ITAM
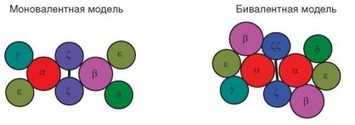
Рис. 3.10. Модели строения Т-клеточного рецептора. Кружки — полипептидные цепи, черная линия — дисульфидная связь
иммуноглобулинов и достаточно консервативны (межвидовая гомология — 70—80%). Структура доменов стабилизирована дисульфидными связями. Цепи CD3-комплекса связаны между собой, а также с димерами TCR и Z2 нековалентно. Во внутриклеточной части у-, 5- и е-цепей содержится мотив ITAM. К этим цепям примыкает (а при активации клетки формирует прямую связь) тирозинкиназа Fyn. Это свидетельствует об участии цепей комплекса CD3 во внутриклеточной передаче сигналов.
Z-Цепи не принадлежат к суперсемейству Ig. Они формируют димер, связанный расположенной над мембраной дисульфидной связью. Около 10% молекул представляют не гомо-, а гетеродимер Z- и П- цепей (продукт альтернативного сплайсинга гена, кодирующего Z-цепь). В Т-клетках слизистых оболочек в составе димера выявляют еще один тип цепей — у-цепь (т.е. образуется Zy-димер), идентичная у-цепи, входящей в состав FceRl и ряда других Fc-рецепторов (см. раздел 2.3.4.2). Z-Цепь не имеет участков гликозилирова- ния. Из 143 остатков Z-цепи только 9 расположены внеклеточно; 22 остатка образуют трансмембранный участок, а 112 — внутриклеточную часть. В ней содержится 3 активационных мотива ITAM, что свидетельствует об очень активном участии молекулы в передаче сигналов. И действительно, Z-димер, благодаря своей связи с киназой ZAP-70, передает сигнал от рецепторных структур к ферментам и адапторным белкам, направляющим его далее по основным путям внутриклеточной передачи сигнала.
Существует несколько моделей четвертичной структуры TCR-CD3 комплекса (рис. 3.10). Согласно моновалентной модели, комплекс содержит по одной цепи каждого типа, кроме е- и Z-цепей, представленных по две цепи каждая. При этом a-цепь пространственно связана с димером уе, а р-цепь — с димером 5е; Z-димер расположен между а- и p-цепями. В соответствии с бивалентной моделью комплекс содержит 2 симметричных тетрамера состава аРуе и ар5е, между которыми расположен Z-димер. Последняя модель в большей степени соответствует данным анализа молярного соотношения полипептидных цепей комплекса. В то же время суммарная молекулярная масса такого комплекса составляет около 300 кДа, что превышает ее расчетную (на основе второй модели) величину — 235 кДа.
TCR, содержащие антигенраспознающие димеры ар и у5, организованы сходным образом. Полипептидные цепи комплекса CD3 синтезируются в
избытке. Их сборка происходит в эндоплазматическом ретикулуме. При этом сначала формируется тетрамер, состоящий из одной у, одной в и двух е-цепей, затем к нему присоединяется димер ав или у8. В аппарате Гольджи происходит их гликозилирование и полимер перемещается на мембрану, где к нему подсоединяется Z-димер. Экспрессия CD3 без включения антигенспецифического димера ав/у8 невозможна и свободный комплекс CD3 остается в цитоплазме.
