Двойная дуга аорты (ДДА) является одной из аномалий, образующей сосудистое кольцо и вызывающей компрессию трахеи и пищевода. Порок впервые описан W. Hommel в 1773 г.
ДДА представляет собой одновременное существование правой и левой аортальных дуг (рис. 47). Восходящая аорта расположена впереди трахеи, она разделяется на две дуги, которые затем проходят по обе стороны трахеи и пищевода. От каждой дуги отходят общая сонная и подключичная артерия; позади пищевода дуги соединяются с нисходящей аортой, которая спускается в грудную клетку справа или слева от срединной линии. Чаще правая (задняя) дуга проходит сзади трахеи и пищевода, а левая (передняя) дуга — спереди. Наиболее часто при ДДА обе дуги не заращены, правая дуга шире и находится выше левой, открытый артериальный проток (или артериальная связка) и нисходящая аорта расположены слева (реже справа); другой вариант: одна дуга не заращена, вторая (левая) атрезирована [Bankl Н., 1980].
ДДА обычно существует как изолированная аномалия, но может сочетаться с тетрадой Фалло, правосторонней нисходящей аортой, ДМЖП, ДМПП, коарктацией аорты, транспозицией магистральных сосудов.
Клинические проявления порока разнообразны. При незначительном давлении на пищевод и трахею единственным проявлением порока могут быть тупые боли за грудиной, некоторое затруднение при дыхании и глотании твердой пиши, в связи с чем возникает подозрение на опухоль пищевода. У грудных детей основным проявлением сосудистого кольца является стридорозное дыхание с момента рождения или вскоре после него. Другими причинами стридорозного дыхания могут быть ларингомаляция, предшествующая интубация, атрезия хоан, инфекция, родовая травма. Обычно у детей без ДДА стридорозное дыхание проходит через 2—3 мес, а при наличии ДДА клинические проявления его сохраняются и прогрессируют. Одновременно наблюдаются одышка, кашель, приступы удушья, апноэ, цианоза, рецидивирующие бронхопневмонии (из-за аспирации пищи), срыгивание, рвота, дисфагия, снижение массы тела. Дети принимают вынужденное положение на боку с запрокинутой назад головой (улучшается проходимость трахеи). Дыхательная недостаточность со временем прогрессирует и угрожает жизни больного [Крив- ченя Д. Ю., 1985]. При объективном обследовании изменений со стороны сердца нет, тоны громкие, шум отсутствует, за исключением случаев с сопутствующими ВПС.
Определить ДДА по обычной рентгенограмме нельзя, но ее иногда можно заподозрить по дополнительному образованию, напоминающему праворасположенную дугу аорты. В боковой проекции видно сужение трахеи на уровне дуги аорты.
Д. Ю. Кривченя (1985), наблюдая и успешно оперируя таких детей, считает наиболее высокоинформативным диагности
ке
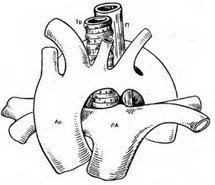
Рис. 47. Схема анатомического расположения аорты, пищевода и трахеи при двойной дуге аорты.
П — пищевод; Тр — трахея.
ческим методом эзофагографию с введением через зонд водорастворимого контрастного вещества (15—20 мл) в пищевод. Использование жировых и барийсодержащих растворов имеет некоторую опасность из-за возможности их аспирации и развития асфиксии. На эзофагограммах в боковой проекции определяются типичные для порока компрессионные деформации тени пищевода. При бронхоскопии обнаруживаются сужение просвета и пульсация надбифуркационного сегмента трахеи. При трахеогра- фии с водорастворимым контрастным веществом в боковой проекции выявляются деформация и сужение надбифуркационной части трахеи. После исследования контрастное вещество надо тщательно отсосать.
Аортография, как метод обследования, остается в резерве, так как она не всегда информативна, например, в случае, если сосуды накладываются друг на друга или одна из дуг атрезиро- вана.
В настоящее время для выявления сосудистого кольца используется двухмерная эхокардиография J. Huhta и соавт. (1986) обследовали 22 ребенка первого года жизни со стридором и в 35 % причиной стридора было сосудистое кольцо.
Авторы считают, что двухмерная эхокардиография должна быть первым методом обследования детей со стридором и респираторными нарушениями.
Хирургическое лечение показано только в случаях, когда имеются клинические проявления сдавления пищевода или трахеи. Цель операции — восстановление нормальной функции этих органов. При операции выделяют и пересекают артериальную связку или открытый артериальный проток и оставляют длинную культю на его левой дуге. Меньшую по диаметру (левую) дугу перевязывают, прошивают и фиксируют с помощью культи боталлова протока к грудине, тем самым вызывая декомпрессию трахеи и пищевода [Кривченя Д. Ю., 1985].
Врожденная аневризма синуса Вальсальвы (АСВ) — мешотчатое или пальцеобразное расширение либо выпячивание аортальной стенки синуса, нередко сопровождающееся прорывом в предлежащие полости сердца. Первое описание этой патологии принадлежит J. Норе (1839), а в отечественной литературе — Ф. М. Опенховскому (1894).
Частота врожденной АСВ составляет 0,1—3,5% всех ВПС [Некласов Ю. Ф. и др., 1975; Королев Б. А. и др., 1979; Meyer J. et al., 1975]. Если к концу 1975 г. в литературе содержались сведения о 220 таких наблюдениях, то к концу 1985 г. было описано уже около 350.
Анатомия. Отличительной особенностью врожденных АСВ является их мешотчатая или пальцеобразная форма и выпячивание в смежные отделы сердца. Чаще всего аневризма заканчивается одним или несколькими перфорационными отверстиями, приводящими к сообщению корня аорты с соответствующей камерой сердца. Размеры аневризматического мешка бывают в пределах от 0,8 до 3 см, диаметр перфорационного отверстия — от 0,2 до 1,8 см.
Аневризма может исходить из любого синуса Вальсальвы, однако наиболее часто (75—95%) — из правого коронарного синуса. Частота локализации аневризмы в некоронарном синусе составляет 5—25 %. Исключительную редкость представляют аневризмы, исходящие из левого коронарного синуса.
Существует закономерность разрыва аневризм в определенные полости сердца. Аневризмы, исходящие из левой или центральной части правого коронарного синуса, обычно разрываются в выводной отдел правого желудочка. Если аневризма расположена в правой части правого коронарного синуса, то в '/* случаев она прорывается в приточный отдел правого желудочка и видна сразу же ниже септальной створки трикуспидального клапана, а в 3/4 случаев разрыв происходит в полость правого предсердия. Аневризма, исходящая из некоронарного синуса, как правило, разрывается в полость правого предсердия и лишь иногда — в полость правого желудочка. Аневризмы левого коронарного синуса, представляющие исключительную редкость, могут прорываться в полости правого предсердия, правого желудочка и экстракардиаль- но.
Среди сопутствующих ВПС следует отметить ДМЖП, который обычно встречается при аневризмах правого коронарного синуса; дефект располагается выше наджелудочкового гребня и ниже клапана легочной артерии. Частота ДМЖП при врожденных АСВ составляет 40—50 %. Реже встречаются ДМПП, ОАП, коарктация аорты, аортальная недостаточность, стеноз легочной артерии.
Гемодинамика. Неразорвавшаяся АСВ протекает без гемо- динамических нарушений. Однако в ряде случаев, выбухая в выводной отдел правого желудочка, она может создавать препят-
ствие току крови в ствол легочной артерии и крайне редко, сдавливая проводящие пути сердца, вызывает различного характера нарушения ритма.
Нарушения гемодинамики при прорыве аневризмы обусловлены сбросом крови из аорты в ту или иную камеру сердца, но чаще всего — в правый желудочек или правое предсердие. Кровь из аорты поступает постоянно, на протяжении всего сердечного цикла, так как систолическое и диастолическое давление в ней значительно выше, чем в правых отделах сердца. Объем сброса крови зависит как от диаметра перфорационного отверстия, так и от легочно-сосудистого сопротивления.
Сброс крови слева направо приводит к увеличению не только легочного кровотока, но и возврата крови в левое предсердие и левый желудочек, следовательно, возникает объемная перегрузка как правых, так и левых отделов сердца. Давление в малом круге кровообращения обычно составляет менее 70 % от системного. Если вскоре после прорыва аневризмы развивается высокая легочная гипертензия и быстро прогрессирующая сердечная недостаточность, то промедление с операцией может привести к летальному исходу.
Клиника, диагностика. Большинство (70—80%) больных с врожденной АСВ — лица мужского пола. Прорыв аневризмы чаще всего происходит в возрасте 25—40 лет, однако возможен и у детей раннего возраста. Чаще всего прорыв аневризмы наступает при резком физическом напряжении, хотя возможен и в состоянии покоя. К предрасполагающим факторам следует отнести бактериальный эндокардит.
АСВ без фистулы между аортой и полостью сердца обычно ничем себя не проявляет и ее обнаруживают случайно при ангиографии или во время операции по поводу какого-либо другого сопутствующего порока сердца или на аутопсии.
Если после разрыва аневризмы сообщение между аортой и правыми отделами сердца большое, то развивается и быстро прогрессирует сердечная недостаточность; при небольших размерах отверстия она отсутствует или купируется медикаментозным лечением. По характеру клинического течения всех больных можно разделить на две группы: а) с постепенным ухудшением состояния (при сочетании АСВ с другими ВПС, когда с рождения имели место нарушения гемодинамики, но ухудшение наступает при разрыве АСВ); б) с внезапным ухудшением состояния (обычно наступает при изолированной форме порока на фоне разрыва) [Бураковский В. И. и др., 1987]. В момент разрыва аневризмы появляются боли в области сердца, одышка и сердцебиение. Нередко больные могут отметить не только день, но и час начала заболевания, реже начало бывает бессимптомным. Одышка обусловлена внезапно увеличивающимся легочным кровотоком. а тахикардия и боли в области сердца — уменьшением коронарного кровотока и минутного объема большого круга кровообращения из-за сброса крови в правые отделы сердца.
Одновременно с появлением одышки и болей в области сердца впервые выслушивается продолжительный, машинообразный систолодиастолический шум над областью сердца. В отличие от ОАП при АСВ шум локализуется во втором и четвертом межреберьях, слева у грудины — при прорыве в правый желудочек и над центром или справа от грудины в третьем и четвертом межреберьях при прорыве в правое предсердие; шум более поверхностный и часто сопровождается дрожанием над грудной клеткой, определяемым при пальпации. Наблюдается умеренное снижение диастолического АД (в среднем до 40 мм рт. ст.) и повышение пульсового давления (в среднем до 80 мм рт. ст.).
ЭКГ не имеет специфических изменений, определяются признаки гипертрофии миокарда обоих желудочков (больше левого) и левого предсердия. Иногда обнаруживаются проявления полной или неполной атриовентрикулярной блокады, узловой ритм, блокады правой ножки пучка Гиса как результат механического сдавления этих отделов проводящей системы сердца. Описаны случаи желудочковой и наджелудочковой тахикардии и синко- пальных состояний на их фоне.
На ФКГ фиксируется высокоамплитудный систолодиастолический шум, реже — только диастолический. При рентгенологическом исследовании легочный рисунок усилен за счет артериального русла, определяется выраженная кардиомегалия, обусловленная увеличением правых и левых отделов сердца.
Большое значение в обследовании больных с разрывом АСВ имеет эхокардиография. Одномерная эхокардиография не выявляет специфических изменений, имеют место синдром объемной перегрузки левых отделов сердца, увеличение полости правого желудочка, тенденция к расширению основания аорты. При двухмерной эхокардиографии (рис. 48) можно непосредственно увидеть аневризму и место ее прорыва — видны хаотичные плотные эхосигналы в полости правого желудочка, перерыв эхосигнала в области фистулы. Определяется выпячивание правого коронарного синуса Вальсальвы в полость ПЖ, на вершине, аневризмы — место прорыва (указано стрелкой на рис. 48, а). В фазе диастолы видны сомкнутые створки аортального клапана; анев- ризматически расширенный правый коронарный синус Вальсальвы выбухает в полость правого желудочка, на вершине его видно отверстие (указано стрелкой на рис. 48,6). В фазе систолы определяются открытые створки аортального клапана, утолщение правой коронарной створки, аневризматическое выпячивание правого коронарного синуса (рис. 48, в). В выводном отделе ПЖ непосредственно под створками легочного клапана видна верхняя часть аневризмы (рис. 48,г).
При допплер-кардиографии определяется турбулентный систолический и диастолический поток крови в той камере, в которую произошел разрыв аневризмы.
При катетеризации полостей сердца обычно выявляются умеренная степень легочной гипертензии, высокие показатели насы-
Рис. 48. Прорыв аневризмы синуса Вальсальвы в правый желудочек. Эхокар диограмма.
а — парастернальная проекция длинной оси левого желудочка; б, в — парастерналь- ная проекция короткой оси на уровне корня аорты; г — парастернальная проекция длинной оси выводного тракта правого желудочка.
щения крови кислородом в правом желудочке или правом предсердии, т. е. в полости, куда произошел прорыв аневризмы. При выбухании аневризмы в выводной отдел правого желудочка определяется систолический градиент давления между правым желудочком и стволом легочной артерии до 10—40 мм рт. ст.
Среди различных методов ангиокардиографического исследования предпочтение отдается ретроградной аортографии. При введении контрастного вещества в корень аорты контрастируется мешкообразное аневризматическое выпячивание, пролабирующее в выводной отдел правого желудочка или правое предсердие, через которое контрастное вещество поступает в соответствующий отдел сердца. У ряда больных провисают створки аортального клапана, что обусловливает поступление контрастного вещества в полость левого желудочка; это свидетельствует о сопутствующей аортальной недостаточности.
Дифференциальный диагноз проводится с ОАП, ДМЖП с аортальной недостаточностью, дефектом аортолегочной перегородки, коронарной артериовенозной фистулой.
Течение, лечение. Как правило, больные с АСВ нуждаются в хирургическом лечении, так как средняя продолжительность жизни после рызрыва составляет 1—2 года. Описаны случаи внезапной смерти на фоне разрыва и случаи, когда больные прожили после разрыва до 17 лет [Королев Б. А. и др., 1979]. Показаниями к операции служат нарушения гемодинамики, обусловленные сбросом крови слева направо. При быстро прогрессирующей сердечной недостаточности следует прибегать к срочному хирургическому вмешательству, не дожидаясь эффекта от медикаментозного лечения.
Первые операции по поводу АСВ проведены С. W. Lillehei (1957), у нас в стране — В. И. Бураковским (1963).
Операции по устранению АСВ выполняются в условиях искусственного кровообращения и умеренной гипотермии. Основные принципы хирургической коррекции порока: резекция аневризматического мешка и устранение образовавшегося отверстия, соединение медии аорты с фиброзным кольцом аортального клапана, коррекция сопутствующих ВПС. Подходы могут быть через полость, в которую произошел разрыв аневризмы, или трансаортально. Доступом через правый желудочек или правое предсердие выполняют резекцию аневризматического мешка с последующим ушиванием образовавшегося отверстия отдельными швами, укрепленными прокладками, или закрытие его заплатой. Доступом через аорту в зависимости от диаметра отверстия, ведущего в аневризму, его закрывают отдельными швами или заплатой. Осуществляют ревизию аортального клапана и при необходимости выполняют восстановительную операцию (плика- ция створок) или протезирование-
Летальность после коррекции порока составляет 2,2—11,7% [Meyer J. et. al., 1975; Pan Chin et al., 1981]. Летальные исходы обычно связаны с тяжелым состоянием больных, оперированных
на фоне быстро прогрессирующей сердечной недостаточности, развитием бактериального эндокардита, реже они возникают при протезировании аортального клапана у детей. В Институте сердечно-сосудистой хирургии им. А. Н. Бакулева АМН СССР на 1 мая 1985 г. прооперировано 25 больных, из них два летальных исхода [Бураковский В. И. и др., 1986].
Отдаленные результаты, как правило, благоприятные. В ряде случаев развитие или обострение бактериального эндокардита может приводить к аортальной недостаточности, требующей замены аортального клапана протезом.
ДДА представляет собой одновременное существование правой и левой аортальных дуг (рис. 47). Восходящая аорта расположена впереди трахеи, она разделяется на две дуги, которые затем проходят по обе стороны трахеи и пищевода. От каждой дуги отходят общая сонная и подключичная артерия; позади пищевода дуги соединяются с нисходящей аортой, которая спускается в грудную клетку справа или слева от срединной линии. Чаще правая (задняя) дуга проходит сзади трахеи и пищевода, а левая (передняя) дуга — спереди. Наиболее часто при ДДА обе дуги не заращены, правая дуга шире и находится выше левой, открытый артериальный проток (или артериальная связка) и нисходящая аорта расположены слева (реже справа); другой вариант: одна дуга не заращена, вторая (левая) атрезирована [Bankl Н., 1980].
ДДА обычно существует как изолированная аномалия, но может сочетаться с тетрадой Фалло, правосторонней нисходящей аортой, ДМЖП, ДМПП, коарктацией аорты, транспозицией магистральных сосудов.
Клинические проявления порока разнообразны. При незначительном давлении на пищевод и трахею единственным проявлением порока могут быть тупые боли за грудиной, некоторое затруднение при дыхании и глотании твердой пиши, в связи с чем возникает подозрение на опухоль пищевода. У грудных детей основным проявлением сосудистого кольца является стридорозное дыхание с момента рождения или вскоре после него. Другими причинами стридорозного дыхания могут быть ларингомаляция, предшествующая интубация, атрезия хоан, инфекция, родовая травма. Обычно у детей без ДДА стридорозное дыхание проходит через 2—3 мес, а при наличии ДДА клинические проявления его сохраняются и прогрессируют. Одновременно наблюдаются одышка, кашель, приступы удушья, апноэ, цианоза, рецидивирующие бронхопневмонии (из-за аспирации пищи), срыгивание, рвота, дисфагия, снижение массы тела. Дети принимают вынужденное положение на боку с запрокинутой назад головой (улучшается проходимость трахеи). Дыхательная недостаточность со временем прогрессирует и угрожает жизни больного [Крив- ченя Д. Ю., 1985]. При объективном обследовании изменений со стороны сердца нет, тоны громкие, шум отсутствует, за исключением случаев с сопутствующими ВПС.
Определить ДДА по обычной рентгенограмме нельзя, но ее иногда можно заподозрить по дополнительному образованию, напоминающему праворасположенную дугу аорты. В боковой проекции видно сужение трахеи на уровне дуги аорты.
Д. Ю. Кривченя (1985), наблюдая и успешно оперируя таких детей, считает наиболее высокоинформативным диагности
ке

Рис. 47. Схема анатомического расположения аорты, пищевода и трахеи при двойной дуге аорты.
П — пищевод; Тр — трахея.
ческим методом эзофагографию с введением через зонд водорастворимого контрастного вещества (15—20 мл) в пищевод. Использование жировых и барийсодержащих растворов имеет некоторую опасность из-за возможности их аспирации и развития асфиксии. На эзофагограммах в боковой проекции определяются типичные для порока компрессионные деформации тени пищевода. При бронхоскопии обнаруживаются сужение просвета и пульсация надбифуркационного сегмента трахеи. При трахеогра- фии с водорастворимым контрастным веществом в боковой проекции выявляются деформация и сужение надбифуркационной части трахеи. После исследования контрастное вещество надо тщательно отсосать.
Аортография, как метод обследования, остается в резерве, так как она не всегда информативна, например, в случае, если сосуды накладываются друг на друга или одна из дуг атрезиро- вана.
В настоящее время для выявления сосудистого кольца используется двухмерная эхокардиография J. Huhta и соавт. (1986) обследовали 22 ребенка первого года жизни со стридором и в 35 % причиной стридора было сосудистое кольцо.
Авторы считают, что двухмерная эхокардиография должна быть первым методом обследования детей со стридором и респираторными нарушениями.
Хирургическое лечение показано только в случаях, когда имеются клинические проявления сдавления пищевода или трахеи. Цель операции — восстановление нормальной функции этих органов. При операции выделяют и пересекают артериальную связку или открытый артериальный проток и оставляют длинную культю на его левой дуге. Меньшую по диаметру (левую) дугу перевязывают, прошивают и фиксируют с помощью культи боталлова протока к грудине, тем самым вызывая декомпрессию трахеи и пищевода [Кривченя Д. Ю., 1985].
Врожденная аневризма синуса Вальсальвы (АСВ) — мешотчатое или пальцеобразное расширение либо выпячивание аортальной стенки синуса, нередко сопровождающееся прорывом в предлежащие полости сердца. Первое описание этой патологии принадлежит J. Норе (1839), а в отечественной литературе — Ф. М. Опенховскому (1894).
Частота врожденной АСВ составляет 0,1—3,5% всех ВПС [Некласов Ю. Ф. и др., 1975; Королев Б. А. и др., 1979; Meyer J. et al., 1975]. Если к концу 1975 г. в литературе содержались сведения о 220 таких наблюдениях, то к концу 1985 г. было описано уже около 350.
Анатомия. Отличительной особенностью врожденных АСВ является их мешотчатая или пальцеобразная форма и выпячивание в смежные отделы сердца. Чаще всего аневризма заканчивается одним или несколькими перфорационными отверстиями, приводящими к сообщению корня аорты с соответствующей камерой сердца. Размеры аневризматического мешка бывают в пределах от 0,8 до 3 см, диаметр перфорационного отверстия — от 0,2 до 1,8 см.
Аневризма может исходить из любого синуса Вальсальвы, однако наиболее часто (75—95%) — из правого коронарного синуса. Частота локализации аневризмы в некоронарном синусе составляет 5—25 %. Исключительную редкость представляют аневризмы, исходящие из левого коронарного синуса.
Существует закономерность разрыва аневризм в определенные полости сердца. Аневризмы, исходящие из левой или центральной части правого коронарного синуса, обычно разрываются в выводной отдел правого желудочка. Если аневризма расположена в правой части правого коронарного синуса, то в '/* случаев она прорывается в приточный отдел правого желудочка и видна сразу же ниже септальной створки трикуспидального клапана, а в 3/4 случаев разрыв происходит в полость правого предсердия. Аневризма, исходящая из некоронарного синуса, как правило, разрывается в полость правого предсердия и лишь иногда — в полость правого желудочка. Аневризмы левого коронарного синуса, представляющие исключительную редкость, могут прорываться в полости правого предсердия, правого желудочка и экстракардиаль- но.
Среди сопутствующих ВПС следует отметить ДМЖП, который обычно встречается при аневризмах правого коронарного синуса; дефект располагается выше наджелудочкового гребня и ниже клапана легочной артерии. Частота ДМЖП при врожденных АСВ составляет 40—50 %. Реже встречаются ДМПП, ОАП, коарктация аорты, аортальная недостаточность, стеноз легочной артерии.
Гемодинамика. Неразорвавшаяся АСВ протекает без гемо- динамических нарушений. Однако в ряде случаев, выбухая в выводной отдел правого желудочка, она может создавать препят-
ствие току крови в ствол легочной артерии и крайне редко, сдавливая проводящие пути сердца, вызывает различного характера нарушения ритма.
Нарушения гемодинамики при прорыве аневризмы обусловлены сбросом крови из аорты в ту или иную камеру сердца, но чаще всего — в правый желудочек или правое предсердие. Кровь из аорты поступает постоянно, на протяжении всего сердечного цикла, так как систолическое и диастолическое давление в ней значительно выше, чем в правых отделах сердца. Объем сброса крови зависит как от диаметра перфорационного отверстия, так и от легочно-сосудистого сопротивления.
Сброс крови слева направо приводит к увеличению не только легочного кровотока, но и возврата крови в левое предсердие и левый желудочек, следовательно, возникает объемная перегрузка как правых, так и левых отделов сердца. Давление в малом круге кровообращения обычно составляет менее 70 % от системного. Если вскоре после прорыва аневризмы развивается высокая легочная гипертензия и быстро прогрессирующая сердечная недостаточность, то промедление с операцией может привести к летальному исходу.
Клиника, диагностика. Большинство (70—80%) больных с врожденной АСВ — лица мужского пола. Прорыв аневризмы чаще всего происходит в возрасте 25—40 лет, однако возможен и у детей раннего возраста. Чаще всего прорыв аневризмы наступает при резком физическом напряжении, хотя возможен и в состоянии покоя. К предрасполагающим факторам следует отнести бактериальный эндокардит.
АСВ без фистулы между аортой и полостью сердца обычно ничем себя не проявляет и ее обнаруживают случайно при ангиографии или во время операции по поводу какого-либо другого сопутствующего порока сердца или на аутопсии.
Если после разрыва аневризмы сообщение между аортой и правыми отделами сердца большое, то развивается и быстро прогрессирует сердечная недостаточность; при небольших размерах отверстия она отсутствует или купируется медикаментозным лечением. По характеру клинического течения всех больных можно разделить на две группы: а) с постепенным ухудшением состояния (при сочетании АСВ с другими ВПС, когда с рождения имели место нарушения гемодинамики, но ухудшение наступает при разрыве АСВ); б) с внезапным ухудшением состояния (обычно наступает при изолированной форме порока на фоне разрыва) [Бураковский В. И. и др., 1987]. В момент разрыва аневризмы появляются боли в области сердца, одышка и сердцебиение. Нередко больные могут отметить не только день, но и час начала заболевания, реже начало бывает бессимптомным. Одышка обусловлена внезапно увеличивающимся легочным кровотоком. а тахикардия и боли в области сердца — уменьшением коронарного кровотока и минутного объема большого круга кровообращения из-за сброса крови в правые отделы сердца.
Одновременно с появлением одышки и болей в области сердца впервые выслушивается продолжительный, машинообразный систолодиастолический шум над областью сердца. В отличие от ОАП при АСВ шум локализуется во втором и четвертом межреберьях, слева у грудины — при прорыве в правый желудочек и над центром или справа от грудины в третьем и четвертом межреберьях при прорыве в правое предсердие; шум более поверхностный и часто сопровождается дрожанием над грудной клеткой, определяемым при пальпации. Наблюдается умеренное снижение диастолического АД (в среднем до 40 мм рт. ст.) и повышение пульсового давления (в среднем до 80 мм рт. ст.).
ЭКГ не имеет специфических изменений, определяются признаки гипертрофии миокарда обоих желудочков (больше левого) и левого предсердия. Иногда обнаруживаются проявления полной или неполной атриовентрикулярной блокады, узловой ритм, блокады правой ножки пучка Гиса как результат механического сдавления этих отделов проводящей системы сердца. Описаны случаи желудочковой и наджелудочковой тахикардии и синко- пальных состояний на их фоне.
На ФКГ фиксируется высокоамплитудный систолодиастолический шум, реже — только диастолический. При рентгенологическом исследовании легочный рисунок усилен за счет артериального русла, определяется выраженная кардиомегалия, обусловленная увеличением правых и левых отделов сердца.
Большое значение в обследовании больных с разрывом АСВ имеет эхокардиография. Одномерная эхокардиография не выявляет специфических изменений, имеют место синдром объемной перегрузки левых отделов сердца, увеличение полости правого желудочка, тенденция к расширению основания аорты. При двухмерной эхокардиографии (рис. 48) можно непосредственно увидеть аневризму и место ее прорыва — видны хаотичные плотные эхосигналы в полости правого желудочка, перерыв эхосигнала в области фистулы. Определяется выпячивание правого коронарного синуса Вальсальвы в полость ПЖ, на вершине, аневризмы — место прорыва (указано стрелкой на рис. 48, а). В фазе диастолы видны сомкнутые створки аортального клапана; анев- ризматически расширенный правый коронарный синус Вальсальвы выбухает в полость правого желудочка, на вершине его видно отверстие (указано стрелкой на рис. 48,6). В фазе систолы определяются открытые створки аортального клапана, утолщение правой коронарной створки, аневризматическое выпячивание правого коронарного синуса (рис. 48, в). В выводном отделе ПЖ непосредственно под створками легочного клапана видна верхняя часть аневризмы (рис. 48,г).
При допплер-кардиографии определяется турбулентный систолический и диастолический поток крови в той камере, в которую произошел разрыв аневризмы.
При катетеризации полостей сердца обычно выявляются умеренная степень легочной гипертензии, высокие показатели насы-
Рис. 48. Прорыв аневризмы синуса Вальсальвы в правый желудочек. Эхокар диограмма.
а — парастернальная проекция длинной оси левого желудочка; б, в — парастерналь- ная проекция короткой оси на уровне корня аорты; г — парастернальная проекция длинной оси выводного тракта правого желудочка.
щения крови кислородом в правом желудочке или правом предсердии, т. е. в полости, куда произошел прорыв аневризмы. При выбухании аневризмы в выводной отдел правого желудочка определяется систолический градиент давления между правым желудочком и стволом легочной артерии до 10—40 мм рт. ст.
Среди различных методов ангиокардиографического исследования предпочтение отдается ретроградной аортографии. При введении контрастного вещества в корень аорты контрастируется мешкообразное аневризматическое выпячивание, пролабирующее в выводной отдел правого желудочка или правое предсердие, через которое контрастное вещество поступает в соответствующий отдел сердца. У ряда больных провисают створки аортального клапана, что обусловливает поступление контрастного вещества в полость левого желудочка; это свидетельствует о сопутствующей аортальной недостаточности.
Дифференциальный диагноз проводится с ОАП, ДМЖП с аортальной недостаточностью, дефектом аортолегочной перегородки, коронарной артериовенозной фистулой.
Течение, лечение. Как правило, больные с АСВ нуждаются в хирургическом лечении, так как средняя продолжительность жизни после рызрыва составляет 1—2 года. Описаны случаи внезапной смерти на фоне разрыва и случаи, когда больные прожили после разрыва до 17 лет [Королев Б. А. и др., 1979]. Показаниями к операции служат нарушения гемодинамики, обусловленные сбросом крови слева направо. При быстро прогрессирующей сердечной недостаточности следует прибегать к срочному хирургическому вмешательству, не дожидаясь эффекта от медикаментозного лечения.
Первые операции по поводу АСВ проведены С. W. Lillehei (1957), у нас в стране — В. И. Бураковским (1963).
Операции по устранению АСВ выполняются в условиях искусственного кровообращения и умеренной гипотермии. Основные принципы хирургической коррекции порока: резекция аневризматического мешка и устранение образовавшегося отверстия, соединение медии аорты с фиброзным кольцом аортального клапана, коррекция сопутствующих ВПС. Подходы могут быть через полость, в которую произошел разрыв аневризмы, или трансаортально. Доступом через правый желудочек или правое предсердие выполняют резекцию аневризматического мешка с последующим ушиванием образовавшегося отверстия отдельными швами, укрепленными прокладками, или закрытие его заплатой. Доступом через аорту в зависимости от диаметра отверстия, ведущего в аневризму, его закрывают отдельными швами или заплатой. Осуществляют ревизию аортального клапана и при необходимости выполняют восстановительную операцию (плика- ция створок) или протезирование-
Летальность после коррекции порока составляет 2,2—11,7% [Meyer J. et. al., 1975; Pan Chin et al., 1981]. Летальные исходы обычно связаны с тяжелым состоянием больных, оперированных
на фоне быстро прогрессирующей сердечной недостаточности, развитием бактериального эндокардита, реже они возникают при протезировании аортального клапана у детей. В Институте сердечно-сосудистой хирургии им. А. Н. Бакулева АМН СССР на 1 мая 1985 г. прооперировано 25 больных, из них два летальных исхода [Бураковский В. И. и др., 1986].
Отдаленные результаты, как правило, благоприятные. В ряде случаев развитие или обострение бактериального эндокардита может приводить к аортальной недостаточности, требующей замены аортального клапана протезом.
