Оценка интраоперационного повреждения миокарда
Повреждение миокарда лазерным излучением является проблемой широко обсуждаемой в среде специалистов. Действительно, ряд авторов отмечает, что при сочетанных ТМЛР С02-ла- зером и твердотельными лазерами имеется значимое повышение уровня креатининфосфокиназы MB-фракции, которое связывается с эффектом вапоризации миокарда и зоной термического околоканального повреждения, а у 2-8% больных регистрируется периоперационный ИМ, подтвержденный биохимическими маркерами и ЭКГ [14,101,139]. В качестве адекватного теста оценки интраоперационного повреждения миокарда после ТМЛР применялось серийное исследование уровня кардиоспецифич- ного фермента миокардиального повреждения тропонина I (Тн(). По данной методике было обследовано 24 пациента, подвергнутых операции ТМЛР, в том числе 1 - в сочетании с резекцией аневризмы ЛЖ и АКШ, 3 - изолированные операции ТМЛР, 20 - в сочетании с АКШ.
В плазме крови больных определяли уровень кардиоспеци- фичного фермента миокардиального повреждения тропонина I (Тн1) по методике МНИИ медицинской экологии (Москва) и ООО “Хема-Медика” набором реактивов фирмы Biocon (Германия) на этапах: перед началом операции, сразу после реваскуляризации миокарда, через 4, 8, 12, 24, 48 ч и на 7-е сутки после операции.
Выбор тропонинов в качестве маркера ишемических повреждений обусловлен тем, что сердечные тропонины имеют 100% чувствительность и специфичность для поврежденного миокарда. Кроме того, что наиболее важно, они дают прогностическую информацию, позволяя количественно оценить признаки ишемических изменений в миокарде в различные сроки после операции [223, 300].
Известно, что в клинической практике используют определение уровня тропонина I и тропонина Т. Выбор именно тропонина I был обусловлен тем, что тропонин Т имеет двухфазный характер выделения в кровь, включая наличие фазы снижения (или, как минимум, фазы плато), а большие разбросы времени максимального повышения и снижения концентрации тропонина Т в крови от исходного значения говорят о меньшей достоверности поведения данного кардиомаркера при развитии острого коронарного синдрома. Тропонин I имеет только один пик. Также маркеры имеют различное временное окно: тропонин Т обнаруживается до 14 дней, тогда как уровень тропонина I падает до нормального значения в пределах от 5 до 7 дней. Это имеет важное значение для облегчения исследовательской работы, позволяет сделать большее количество исследований в определенный промежуток времени и способствует применению тропонина I в диагностике реинфарктов в большей степени, чем тропонина Т [100, 116].
Определение уровня фермента перед началом операции, сразу после реваскуляризации миокарда, через 4, 8, 12, 24, 48 ч и на 7-е сутки после операции было обусловлено кинетикой данного маркера - высвобождением в течение нескольких первых часов после начала некроза миокарда и достижением пика за 12-24 ч от начала. В дальнейшем уровень тропонина постепенно падает до нормального значения в пределах от 5 до 7 дней [167]. Разумеется, наряду с определением тропонина всем больным проводились мониторирование ЭКГ, постоянные биохимические исследования, в том числе определение уровня креатинфосфо- киназы (КФК) и ее MB-фракции. Т.о. диагноз инфаркта миокарда ставился нами только комплексно, в свете всех исследований и клинического состояния больного.
Перед операцией исходный уровень Тн! у обсуждаемых больных был близок к нулю. В дальнейшем анализ полученных данных позволил распределить всех пациентов на три группы по степени и обратимости периоперационного повреждения миокарда при реваскуляризирующих операциях (табл. 4.3).
Первую группу сформировали 18 (75%) пациентов. Из них 3 больным были выполнены изолированные операции ТМЛР и 15 человек перенесли лазерную реваскуляризацию в сочетании с АКШ. После операции у них не было выявлено значимого повышения биохимических маркеров повреждения миокарда (табл. 4.4).
У пациентов этой группы непосредственно после завершения основного этапа операции уровень Тн! повышался незначительно (0,17 нг/мл), через 8-12 ч после реваскуляризации достигал 0,84 нг/мл, причем пик его приходился именно на зти точки, а через 12 ч после операции начинал снижаться. Затем, к 24- му часу наблюдения, отмечалось уменьшение концентрации Тн! до 0,50 нг/мл, а через двое суток показатель регистрировался
Таблица 4.3
Количество пациентов в анализируемых группах в зависимости от степени ишемического поражения миокарда поданным исследования уровня тропонина I
|
Степень ишемического повреждения миокарда |
Всего п=24 |
|
Без ишемического повреждения миокарда (1 -я группа) |
18(75%) |
|
Преходящая ишемия миокарда (2-я группа) |
4(16,7%) |
|
Периоперационный инфаркт миокарда (3-я группа) |
2(8,3%) |
Таблица 4.4
Динамика уровня тропонина I при ТМЛР и коронарном шунтировании в зависимости от степени повреждения миокарда
|
Этап исследования 1 группа 2 группа 3 группа |
|||
|
До операции (1) |
0,04(0,02:0,09) |
0,05(0,05:0,19) |
0,07 (0,05; 0,18) |
|
Завершение операции (II) |
0,17(0,08;0,27) |
1,77(0,22; 1,25)* |
6,57(0,24:1,25)* |
|
4 ч после операции (III) |
0,42 (0,36:0,27) |
3,56(1,41:3,1)* |
11,66(1,48:3,6)* |
|
8 ч после операции (IV) |
0,66(0,42:1,2) |
5,16(1,58:3,21)* |
14,06 (2,1; 4,1)* |
|
12 ч после операции (V) |
0,84(0,35:0,97) |
3,06 (2,15; 4,1)* |
16,60(1,56:3,6)* |
|
24 ч после операции (VI) |
0,50(0,25; 0,90) |
2,08(1,2:2,9)* |
12,83(1,2:2,91)* |
|
48 ч после операции (VII) |
0,29(0,16:0,52) |
0,95(0,49:1,4) |
10,95(0,44;1,46)* |
|
7-е сутки после операции (VIII) |
0,06(0,04; о,13) |
0,07(0,16:0,2) |
6,48 (0,14; 0,2)* |
|
Примечание: * - рlt;0,05 пр |
1 сравнении обсуж |
маемых групп. Стати |
стическая обработка |
выполнена с применением критерия Манна-Уитни.
на уровне 0,29 нг/мл. К 7-м суткам наблюдения концентрация этого биохимического маркера ишемического повреждения миокарда в крови возвращалась к исходным значениям (0,06 нг/ мл). Электрокардиографических изменений и гемодинамических нарушений среди больных данной группы не было зарегистрировано.
Ко 2-й группе были отнесены 4 (16,7%) пациента, у которых в раннем послеоперационном периоде отмечались обратимые кратковременные ишемические изменения миокарда. Из них 3 больным ТМЛР дополнялась АКШ и у одного пациента сочеталась с резекцией аневризмы ЛЖ. Пиковые значения Тн1 были зарегистрированы через 8 ч после шунтирования - 5,16 нг/мл. Необходимо отметить, что среди пациентов этой подгруппы в период 4-12 ч после операции отмечался подъем уровня Тн1 выше 3 нг/мл. Однако динамика уровня Тн! соответствовала графику первой группы, а к 7-м суткам наблюдения концентрация Тн1 снизилась до исходных значений. Кроме того, у пациентов этой группы в первые часы после операции на ЭКГ отмечались преходящие изменения сегмента ST и гемодинамическая потребность в инотропной поддержке. Через сутки ЭКГ не отличалась от дооперационной, а дозы инотропных препаратов были уменьшены до ренальных.
Третью группу составили 2 (8,3%) пациента. У обоих пациентов ТМЛР сочеталась с АКШ. Критерием, по которому выделена зта группа, стал зарегистрированный периоперационный ИМ. Уровень Тн1 и его динамика значительно отличались от показателей двух предыдущих групп. Уровень Тн1 у них превышал 11 нг/мл уже в первые 4 ч после операции, достигал к 8-му часу наблюдения максимальных значений - 14,06 нг/мл. При этом пик концентрации Тн! наблюдался к 24 ч (16,6 нг/мл) и сохранялся на субмаксимальных значениях 2-3 суток с тенденцией к снижению только в конце первой недели послеоперационного периода. На 7-е сутки послеоперационного периода уровень Тн1 оставался выше 6 нг/мл. Т.о., максимальный уровень Тн! превышал средние значения 1-й группы более чем пятикратно, а 2-й группы более чем в 2,5 раза. На ЭКГ после операции у обоих пациентов этой группы была отмечена стойкая злевация сегмента ST с последующим формированием Q-зубца на фоне нестабильной гемодинамики и потребности высоких доз катехоламинов. Графически результаты исследования приведены на рисунке 4.5.
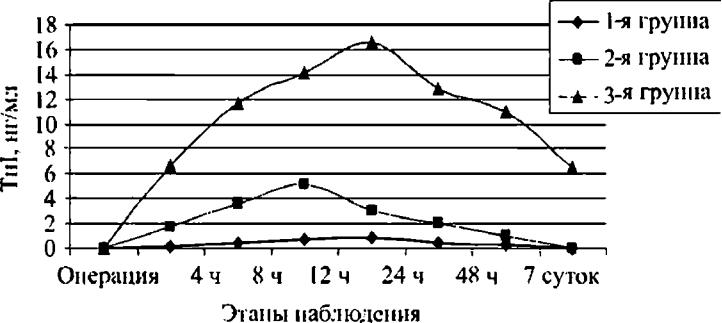
Рис. 4.5. Динамика тропонина I на этапах исследования в зависимости от степени ишемического повреждения миокарда в группах пациентов
Мы не связываем повышение маркеров повреждения миокарда с проведенной ТМЛР. Нам представляется более обоснованной ишемическая природа повреждения миокарда, сопутствующая операциям в условиях ИК с пережатием аорты в целом и операциям АКШ в частности, так как, несмотря на попытки варьировать компонентами, ни один современный состав кар- диоплегии не исключает полностью глобальную или локальную кардиальную ишемию [2]. Частота развития периоперационно- го ИМ при коронарном шунтировании в условиях ИК составляет, поданным разных авторов, от 1,6 до 8,2% [2, 34, 209]. Подобные же цифры частоты ИМ отмечаются большинством исследователей и после сочетанных операций - АКШ и ТМЛР [11,23]. Кроме того, транзиторная ишемия миокарда, не сопровождающаяся некрозом кардиомиоцитов, так называемый stunning, развивается гораздо чаще: от 54 до 66% случаев [119]. Обратимая миокардиальная ишемия может вызвать функциональную дезинтеграцию мембран клетки и последующий выброс цитолитичес- ких ферментов без клеточного некроза и нарушения функции.
Тот факт, что у большинства (75%) обсуждаемых нами пациентов концентрация Тн! в раннем послеоперационном периоде не превышала 3 нг/мл, что соответствует нормальным значениям этого маркера при АКШ в условиях ИК [209], свидетельствует о несущественном вкладе ТМЛР в периоперационное повреждение миокарда. Кроме того, по данным С. Brilla с соавт., отношение совокупной площади трансмиокардиальных лазерных каналов к площади левого желудочка несопоставимо мало, чтобы обусловить клинически и биохимически значимое миокардиальное повреждение [121].
Необходимо отметить, что, согласно данным Л.А. Бокерия с соавт., послеоперационное повышение биохимических маркеров повреждения миокарда может зависеть и от количества выполненных лазерных каналов в стенке сердца и, если оно превышает 20-30 при использовании С02-лазера, следует значимое повышение концентрации КФК MB-фракции и тропонина; то же, но в меньшей степени отмечали исследователи и для твердотельного лазера [15, 230]. Нами выполнялось около 50-60 лазерных каналов в миокарде, но, как уже сообщалось выше, в большинстве случаев мы не наблюдали значимого повышения уровня Тн1 у больных после операции. По нашему мнению, минимальное влияние ТМЛР на степень периоперационного повреждения миокарда как изолированно, так и в сочетании с АКШ связано с тем, что мы использовали полупроводниковый лазер. Применение низкознергетического лазера с длиной волны 970 нм, на которую приходятся локальные максимумы поглощения биоткани, оказывает значительно меньшее повреждающее действие на сердечную мышцу.
Для наглядности приведем клинические примеры.
Пример 1. Пациент К., 55 лет (ИБ № 7359), поступил в КХО ГУ НИИ кардиологии ТНЦСО РАМН 13.11.2007 г. Основной диагноз: 1) ИБО: стенокардия напряжения IIIФК. Стенозирующий атеросклероз коронарных артерий. Постинфарктный кардиосклероз (2005 г.) Н НА ФК III; 2) стенозирующий атеросклероз сонных артерий. Окклюзия внутренней сонной артерии справа. Хроническая дисциркуляторная энцефалопатия II ст. Остаточные явления острого нарушения мозгового кровообращения (2000 г.) в бассейне среднемозговой артерии справа. Фоновое: гипертоническая болезнь III ст., риск 4; сахарный диабет 2-го типа, средней степени тяжести, субкомпенсация. Сопутствующее: облитерирующий атеросклероз сосудов нижних конечностей; окклюзия бедренных артерий с обеих сторон; хроническая артериальная недостаточность II Б; хронический гастрит, ремиссия; хронический бронхит, ремиссия.
При проведении коронаровентрикулографии отмечено следующее. Тип кровоснабжения: левый. Левая коронарная артерия: ствол - б/о, ПНА окклюзирована в пр/3 и д/3.1 ДА - 60-70%, ОА - 60-70% в средней трети, ПКА развита слабо.
По данным обследования, выполнено оперативное лечение: маммаро-коронарное шунтирование ДА, аутовенозное (“v. saphena magna dextrae”) аортокоронарное шунтирование задней межжелудочковой ветви, лазерная реваскуляризация верхушки и переднебоковой стенки левого желудочка (37 каналов) в условиях искусственного кровообращения. В послеоперационном периоде отмечено развитие мелкоочагового переднебокового острого инфаркта миокарда. При проведении тропонинового теста отмечена характерная динамика по контрольным точкам (табл. 4.5).
Таблица 4.5
Динамика уровня тропонина I при ТМАР и АКШ у пациента К.
|
Этап исследования |
Концентрация тропонина 1, нг/мл |
|
До операции (1) |
0,33 |
|
Завершение операции (II) |
4,42 |
|
4 ч после операции (III) |
10,96 |
|
8 ч после операции (IV) |
13,25 |
|
12 ч после операции (V) |
11,8 |
|
24 ч после операции (VI) |
16,96 |
|
48 ч после операции (VII) |
12,9 |
|
7-е сутки после операции (VIII) |
9,18 |
Пример 2. Больной С., 43 года (ИБ № 6711), поступил в КХО ГУ НИИ кардиологии ТНЦ СО РАМН 18.11.2003 г. Основной диагноз: ИБС: стенокардия напряжения III ФК. Стенозирующий атеросклероз коронарных артерий. Постинфарктный кардиосклероз (08.2004 г.). Недостаточность кровообращения I ст. Фоновое: гипертоническая болезнь III ст., риск 4; атерогенная дислипопро- теидемия. Сопутствующее: атеросклероз аорты, бедренных артерий; хронический пиелонефрит, неполная ремиссия; хроническая почечная недостаточность 0.
При выполнении коронарографии отмечено следующее. Тип кровоснабжения: правый. Левая коронарная артерия: ствол сужен до 40%. ПНА умеренно узурирована с максимальным стено- зированием 20-30%. ОА без стенозов. ПКА окклюзирована в ср/3 на протяжении. По данным обследования, выполнено оперативное лечение: маммарокоронарное шунтирование ПНА, аутоартериальное аортокоронарное шунтирование (a. radialis sinistrae) ВТК, аутовенозное (“v. saphena magna dextrae”) аортокоронарное шунтирование задней межжелудочковой ветви, лазерная реваскуляризация заднебоковой стенки левого желудочка в условиях искусственного кровообращения. В послеоперационном периоде состояние больного стабильное, осложнений выявлено не было, в том числе не было отмечено признаков ишемии миокарда как клинически, так и по данным ЭКГ.
Таблица 4.6
Динамика уровня тропонина I при ТМЛР и коронарном
шунтировании у пациента С.
|
Этап исследования |
Концентрация тропонина 1, нг/мл |
|
До операции (1) |
0,54 |
|
Завершение операции (II) |
2,29 |
|
4 ч после операции (III) |
4,23 |
|
8 ч после операции (IV) |
2,82 |
|
12 ч после операции (V) |
1,52 |
|
24 ч после операции (VI) |
1,83 |
|
48 ч после операции (VII) |
1,86 |
|
7-е сутки после операции (VIII) |
0,65 |
При проведении тропонинового теста отмечена стабильная динамика по контрольным точкам, при этом концентрация тропонина I не превышала 6 нг/мл. Данная динамика приведена в таблице 4.6.
Приведенные клинические примеры демонстрируют тесную взаимосвязь между уровнем тропонина I в крови пациента и развитием повреждения миокарда в послеоперационном периоде. Соответственно концентрация тропонина I является четким количественным показателем для оценки повреждения миокарда при проведении операции ТМЛР для лечения больных ИБС.
А так же в разделе «Оценка интраоперационного повреждения миокарда »
- Функциональная диагностика
- Радионуклидные методы обследования
- Решпгенодиагностические исследования
- Биохимические исследования
- Отбор больных на операцию
- Клиническая характеристика больных
- Операция трансмиокардиальной лазерной реваскуляризации Методика проведения ТМАР полупроводниковым лазером
- Клиническая характеристика интраоперационного периода