Тяжелая миастения (Miastenia gravis) — хроническое рецидивирующее аутоиммунное заболевание, характеризующееся развитием прогрессирующей слабости и быстрой утомляемости скелетных мышц различной локализации.
Клиническая картина тяжелой миастении описана еще в 1672 г. Т. Willis, однако современное название это заболевание получило от F. Golly в 1895 г. Первая тимэктомия при тяжелой миастении в качестве терапевтической процедуры была выполнена в 1911г. Однако лишь в 1960 г. впервые D. Simpson высказал предположение об аутоиммунной природе этого заболевания. Благодаря достижениям иммунологии в последние 20 лет доказано, что основные клинические проявления при тяжелой миастении связаны с дефицитом ацетилхолиновых рецепторов на мышечном волокне в пределах нейромышечного комплекса.
Тяжелая миастения сегодня представляет одно из самых доказанных аутоиммунных заболеваний и может служить моделью для понимания механизмов, лежащих в основе других аутоиммунных болезней.
Частота миастении gravis, по данным разных авторов, варьирует в довольно широких пределах: от 0,5 до 14,2 на 100 000 населения. Интересно, что в возрасте 20—30 лет тяжелая миастения поражает чаще женщин. После 60 лет, напротив, несколько чаще болеют мужчины.
У большинства больных тяжелой миастенией выявляются нарушения тимуса: в 10% случаев макроскопически выражена его гиперплазия, приблизительно у такого же числа больных обнаруживается ти- мома, и у 70% больных гиперпластические нарушения вилочковой железы выявляются микроскопически.
Морфофизиологической основой заболевания является уменьшение количества ацетилхолиновых рецепторов в нервно-мышечном синапсе, развивающееся под влиянием аутоантител (рис. 21).
Степень уменьшения числа рецепторов к ацетилхолину коррелирует с тяжестью заболевания. Уплощается область постсинаптической мембраны и увеличивается просвет между нервным окончанием и постсинаптической мышечной мембраной.
Рецептор к ацетилхолину является гликопротеином с молекулярной массой 2,5 • 105 KD, СОСТОИТ ИЗ 5 субъединиц, расположенных вокруг центрального канала: альфа (2), бета, гамма, дельта и эпсилон. Каждая из двух альфа-субъединиц имеет ацетихолинсвязывающие сайты, расположенные экстрацеллюлярно в районе 192-й и 193-й аминокислотных последовательностей.
На альфа-субъединицах расположены главные (основные) иммуногенные области (эпитопы).
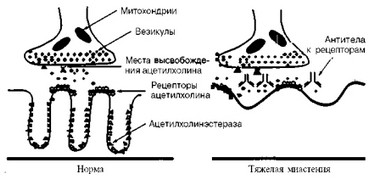
Рис. 21. Нервно-мышечный синапс в норме и при тяжелой миастении.
В настоящее время рецепторы к ацетилхолину выделены, очищены, выяснена их молекулярная структура, клонирован ген рецептора для всех его субъединиц и все они получены генноинженерным способом. Получена модель на животных и разработаны методы диагностики с использованием чистых антигенов.
Иммунопатогенез. В основе заболевания лежит антителозависимый механизм поражения рецепторов к ацетилхолину. Установлено, что повреждение рецепторов под влиянием аутоантител может быть опосредовано тремя путями.
- Связывание аутоантител с ацетилхолиновыми рецепторами усиливает скорость деградации последних, облегчая их фагоцитоз клетками моноцитарно-макрофагального ряда.
- Образование комплекса аутоантитела — ацетилхолиновые рецепторы приводит к активации системы комплемента и последующему повреждению рецепторов.
- При связывании аутоантител с ацетилхолиновыми рецепторами происходит блокада последних и нарушение их функции. В этом случае аутоантитела, по-видимому, связываются не с самими специфическими сайтами на рецепторе, которые фиксируют ацетилхолин, а с иммунногенными областями, лежащими рядом. В последующем вследствие стерических изменений блокируется способность ацетилхолиновых рецепторов связываться с ацетилхолином. Блокирующий эффект отмечен у 50—;80% больных. Следует учитывать, что концентрация в крови аутоантител к ацетилхолиновым рецепторам не всегда коррелирует с тяжестью миастении gravis (возможно, за счет их "потребления").
Установлено, что антитела к ацетилхолину у разных больных об-
ладают различными свойствами: у одних более выражен эффект усиления деградации, у других — блокадный и т. д. Все это обьясняется гетерогенностью антител, связанной с самими Ig, а также с их специфичностью. Около 10—20% больных не имеют в сыворотке крови антител . к рецепторам ацетилхолина (рАХ). Однако сыворотка таких "антителоотрицательных" больных способна влиять на функцию рАХ в культуре клеток (т. е., в сыворотке таких больных видимо недостаточное количество антител, из-за того, что они все связаны).
Считают, что основная роль в аутоиммунном ответе при тяжелой миастении принадлежит Т-лимфоцитам. Из периферической крови и тимуса выделены Т-лимфоциты, аутореактивные к рАХ, т. е., в развитии антительного ответа Т-лимфоциты играют ключевую роль, а сами как эффекторные клетки не участвуют в разрушении рАХ, что обеспечивают воспалительные клетки — макрофаги, нейтрофилы.
Доказано, что Т-лимфоциты-хелперы (CD4+ клетки) больных с тяжелой миастенией способны распознать пептиды, происходящие из ацетилхолиновых рецепторов и расположенные в пептидсвязывающих бороздках молекул HLA класса II антигенпредставляющих клеток. Оказалось, что таких пептидов может быть около 30; отсюда такое разнообразие аутоантител по их свойствам изменять функцию ацетилхолиновых рецепторов.
Предполагают, что антигены, индуцирующие аутоиммунный ответ при тяжелой миастении, расположены в тимусе, поскольку у большинства больных отмечается патология вилочковой железы.
Известно, что в тимусе имеются мышечноподобные (миоидные) клетки, на поверхности которых есть рАХ. В тимических экстрактах, в связи с этим, обнаруживаются альфа-субъединицы рАХ. Находясь в тимусе, миоидные клетки могут вызывать аутоиммунный ответ либо за счет своего разрушения и представления рАХ, либо за счет иммунорегуляторных нарушений и срыва толерантности. Обсуждается роль вирусного поражения тимуса в качестве триггерного сигнала.
Еще один механизм развития заболевания — молекулярная мимикрия — иммунный ответ на инфекционный агент, имеющий сходные антигенные детерминанты с рАХ. Например у 40% больных антитела к рАХ связываются с Herpes virus simplex (ГВС), поскольку рАХ и ГВС имеют высокую гомологию, особенно альфа-субъединицы.
Важную роль играют иммуногенетические факторы. Тяжелая миастения ассоциируется с HLA-B8, DR3 и другими HLA-антигенами. С миастенией gravis ассоциируются другие аутоиммунные заболевания: тиреоидит Хашимото, болезнь Грейвса, ревматоидный артрит, системная красная волчанка, кожная патология.
Клиника. Основные симптомы заболевания — слабость, быстрая утомляемость скелетных мышц с характерной локализацией. Рано выявляются птоз и диплопия; больные жалуются на трудность жевания и глотания. У 85% больных имеются жалобы на общую слабость. Со временем поражаются мышцы диафрагмы и шеи. При указанной симптоматике рефлексы, чувствительность и координация не нарушены.
На основании клинико-лабораторной симптоматики заболевания больных с тяжелой миастенией, можно отнести к четырем группам, что подтверждает полиэтологичность заболевания.
Первая группа. Самая многочисленная, составляет 40—50% общего числа больных. К ней относятся молодые женщины с гиперплазией тимуса и высоким титром антител к ацетилхолиновым рецепторам, предъявляющие жалобы на системную мышечную слабость. В
- фенотипе этих больных выявляются HLA-антигены A1B8DR3. У больных этой группы наиболее эффективным оказалось сочетание тим- эктомии с последующей иммуносупрессивной терапией. Эффект от тимэктомиии регистрировался не ранее, чем через 2 года после операции.
Вторая группа — 15—30% общего числа больных. Эту группу
- составляют пожилые мужчины с атрофией вилочковой железы, низкими титрами антител к ацетилхолиновым рецепторам, жалобами на общую слабость с симптоматикой поражений глаз (птоз, диплопия). В HLA-фенотипе — антигены B7DR2. У больных этой группы наиболее эффективным лечением оказалось сочетанное применение преднизо- лона и азатиоприна.
Третья группа — 15—20% общего числа больных. Характерной особенностью больных этой группы является наличие опухоли вилочковой железы (тимомы). Антитела к ацетилхолиновым рецепторам выявляются непостоянно; жалобы преимущественно на общую слабость. Взаимосвязь с HLA-антигенами не обнаружена. У больных этой группы наиболее эффективным терапевтическим подходом оказалась ти- мэктомия. Если после операции имеется положительная динамика, выражающаяся в улучшении мышечного тонуса — показана иммуносупрессивная терапия.
Четвертая группа —15% общего числа больных. У этих больных не выявляются антитела к ацетилхолиновым рецепторам, нет точных сведений о состоянии тимуса, не обнаружено взаимосвязи с HLA- антигенами. Имеются жалобы на диплопию, птоз, общую мышечную слабость. Эффективным у данной группы больных оказалось сочетанное применение преднизолона и азатиоприна.
Лечение. Антихолинэстеразные препараты— неостигмин и пи-
ридостигмин (mestinon), особенно в начале развития заболевания. В большинстве случаев назначают 30—120 мг каждые 4—6 ч.
Тимэктомия. В настоящее время операция считается целесообразной у больных с прогрессирующей симптоматикой заболевания в возрасте, начиная от пубертатного периода и до 60 лет. Цель — индуцировать ремиссию. Эффект заметен через 1—12 месяцев: у 35% (ремиссия); у 50% улучшение. Количество антител к ацетилхолиновым рецепторам после операции уменьшается.
Иммуносупрессия. А. Кортикостероиды: 15—20 мг/день постепенно повышая до 60 мг/день (каждые 2—3 дня на 5 мг). Через 3 месяца ежеденевного приема переходят на прием через день и постепенно (в течение месяцев — года) снижают дозу до нуля. Терапевтический эффект наступает через 2—3 недели после начала лечения. Б. Азати- о п р и н — терапевтический эффект наступает медленно, через месяцы. Назначают по 50 мг ежедневно в течение 1 недели. Если переносится хорошо, дозу увеличивают до 2—3 мг/кг массы тела .в день. Нужно следить за кровью (лейкоциты, лимфоциты, тромбоциты), функцией печени. В. Циклоспорин А (сандиммун-неорал) —5мг/кг массы тела в день, разделив на 2 приема в день, в течение 2—12 недель. Более подробно об этом препарате см. раздел "Ревматоидный артрит".
Хорошие результаты получены при использовании плазмафереза. с помощью которого вместе с плазмой из организма удаляются аутоантитела, после чего, как правило, наступает ремиссия.
Согласно данным литературы, эффективным является внутривенное введение нормального иммуноглобулина человека; на курс лечения — 400 мг/кг массы тела в день в течение 5 дней.
