Тромбоциты — кровяные пластинки, имеющие важное значение в сложном процессе гемостаза — защитного механизма, предотвращающего кровотечения и кровоточивость из сосудистых капилляров.
Тромбоциты — пластинки округлой или овальной формы с диаметром
- 5 мкм. В 1 мкл крови содержится 180 000—300 000 тромбоцитов. Срок циркуляции (жизнеспособности) тромбоцитов — 8—11 дней. В кровотоке взрослого человека циркулирует 10х 1011—15* 1011 тромбоцитов. Часть циркулирующих тромбоцитов находится в пристеночных резервуарах, расположенных в конечных сосудах селезенки, печени, легких и в меньшей степени в других органах. Ретикуло-макрафагальные элементы селезенки и печени являются главными местами секвестрации тромбоцитов из циркуляции.
При световой микроскопии в крови здорового человека различают четыре основные формы тромбоцитов:
- нормальные (зрелые) тромбоциты (87,0±0,19%) круглой или овальной формы; видна бледно-голубая наружная зона (гиаломер) и центральная (грану- ломер) с азурофильной зернистостью;
- юные (незрелые) тромбоциты (3,20±0,19%) с базофильной «цитоплазмой»; в центре — азурофильная грануляция;
- старые тромбоциты (4,1±0,21%) круглой, овальной, зубчатой формы с узким ободком темной «цитоплазмы» с обильной грубой грануляцией;
- формы раздражения (2,5±0,1%) — тромбоциты больших размеров, вытянутые, колбасовидные, хвостатые.
Мембрана тромбоцитов толщиной 7—9 нм состоит из двух белковых и одного липидного (бимолекулярного) слоя. На поверхности тромбоцитов адсорбированы факторы свертывания плазмы — фибриноген, факторы V, VII, VIII, IX, X, XI и XII.
Особое свойство тромбоцитов прилипать и распластываться по чужеродной смачивающейся поверхности (адгезия) — на поврежденных сосудах, стекле и др., а также образовывать агрегаты способствует начальной стадии образования тромба. Тромбоциты имеют значение также на заключительном этапе гемостаза — ретракции кровяного сгустка, закупоривающего кровяной со- еуд. Распластываясь на поврежденных сосудах или чужеродных поверхностях, тромбоциты увеличиваются в размерах и меняют свою форму, превращаясь в звездчатые фигуры с короткими отростками или удлиненными псевдоподиями. Тромбоциты содержат многочисленные ферменты и осуществляют процессы потребления кислорода, гликолиз и биосинтез, в том числе и белка (тромбостенина). Тромбоциты принимают непосредственное участие в биохимических механизмах процесса гемостаза. При повреждении сосудистых капилляров на их раневой несмачиваемой поверхности in vivo прилипают и распластываются тромбоциты, которые выпускают отростки гиалоплазмы. В образовании гиаломера при распластывании тромбоцитов значительную роль играет фибриноген. Отростки гиаломера соединяются с нитями фибрина и образуют агрегаты пластинок (адгезия).
Агрегация тромбоцитов индуцируется тромбином, который образуется в результате взаимодействия тромбопластина поврежденного эндотелия со свертывающими факторами плазмы. Из кровяных пластинок в плазму выделяется свертывающий фактор III, он взаимодействует с факторами свертывания плазмы и образует тромбопластин, который вызывает превращение протромбина в тромбин. В возбуждении адгезии и агрегации тромбоцитов большое участие принимает АДФ. В результате сложного, до конца не изученного механизма тромбоциты прилипают к поврежденному эндотелию сосудов, образуют агрегаты и возникает тромб, закрывающий просвет сосуда. Процесс образования тромба завершается ретракцией — уплотнением кровяного сгустка.
В процессе гемостаза большое значение имеет и ангиотрофическая функция тромбоцитов, осуществляющих «подкормку» эндотелиальных клеток сосудов. При глубокой тромбоцитопении в эндотелии сосудов происходят дистрофические изменения и стенка микрососудов начинает пропускать эритроциты и образуется кровоизлияние (кровоточивость, кровотечение, петехии, гематома).
Для выполнения основных физиологических функций тромбоцитов: агрегации, свертывания крови, образования и уплотнения кровяного сгустка, способности поддерживать спазм поврежденных сосудов, необходима морфофункциональная полноценность кровяных пластинок, стабильность в них уровня АДФ.
Жидкое состояние крови в большой степени зависит от так называемых противосвертывающих факторов. Как мы указывали, свертывание крови осуществляется последовательно в несколько этапов, среди которых значительную роль играют тромбоциты. Вопросы коагуляции и коагулопатии подробно изложены в отдельной главе этой книги и известной монографии
З.С. Баркагана.
Трансфузии концентратов тромбоцитов (КТ) в лечебной практике применяют главным образом для нормализации гемостаза- они предупреждают и прекращают кровотечения и кровоточивость, связанные с недостатком тромбоцитов в циркулирующей крови (тромбоцитопения) или с их функциональной неполноценностью (тромбоцитопатия). Эти свойства тромбоцитов привели к всевозрастающей потребности лечебных учреждений в трансфузиях КТ, что способствовало разработке эффективных методов их выделения и консервирования.
Известно, что консервированная кровь в процессе хранения претерпевает определенные изменения, приводящие к нарушению обменных процессов в клетках с последующим снижением их функциональной полноценности. Это имеет прямое отношение к тромбоцитам консервированной крови, которые являются крайне лабильными к различным воздействиям, в том числе при их выделении из цельной крови и хранении.
Наш опыт и литературные данные свидетельствуют о наличии взаимосвязанных факторов, влияющих на жизнеспособность и функциональную полноценность тромбоцитов, заготавливаемых из донорской крови. Такими факторами являются:
- состав и свойства гемоконсерванта для крови;
- метод приготовления КТ;
- концентрация клеток, pH и объем плазмы в КТ;
- состав, площадь поверхности, толщина стенок и газопроницаемость полимерного контейнера для хранения КТ;
- температура хранения КТ;
- постоянное перемешивание во время хранения.
Количество тромбоцитов в крови здорового человека колеблется от 180 х 109 до 300 х 109/л.
Концентраты тромбоцитов в дозах, необходимых для трансфузионной терапии, могут быть получены несколькими методами:
- методом дифференцированного центрифугирования в полимерных контейнерах свежезаготовленной консервированной крови, полученной от рандомизированных доноров;
- методом дифференцированного центрифугирования отдельных доз консервированной крови, полученных повторно от одного и того же донора, с выделением из нее концентратов тромбоцитов и возвратом донору плазмы и эритроцитной массы;
- методом автоматического (непрерывного или прерывистого) сепарирования крови — тромбоцитафереза с выделением необходимой лечебной дозы концентратов тромбоцитов от одного донора.
Последний из указанных методов является наиболее совершенным, так как позволяет от одного донора выделить лечебную дозу КТ (4х10и/л и более клеток) за относительно короткое (2—2,5 ч) время. Метод прерывистого (повторного) ручного 4-кратного тромбоцитофереза на рефрижераторных центрифугах (А.И. Воробьев, В.М. Городецкий, 1981, 1988) не требует больших экономических затрат и позволяет также получить от одного донора лечебную дозу КТ (3,2х10и/л и более клеток). Преимуществом этого метода является и ограничение контакта больного в процессе курса трансфу- знойного лечения с меньшим числом доноров, что снижает опасность аллоиммунизации, рефрактерности и опасность инфицирования реципиента вирусами (гепатит, СПИД, цитомегаловирус).
Суть этого метода состоит в проведении у донора последовательных 4-х эксфузий (по 400—430 мл) крови. После каждой эксфузии кровь подвергается 2-этапному центрифугированию; выделяют концентрат тромбоцитов, взвешенных в 60—70 мл аутоплазмы; эритроциты, взвешенные в физиологическом растворе хлорида натрия, и бедную тромбоцитами плазму реинфузи- руют донору.
Метод получил распространение в практике и подтвердил свою эффективность и жизнеспособность. Однако, наряду с явными преимуществами, недостатком его являются большие временные затраты (3,5 ч) для донора, кроме того, эффективность этого метода во многом определяется применяемыми оптимальными режимами центрифугирования.
Наиболее простым и приемлемым (из-за высокой стоимости аппаратов- фракционаторов) методом заготовки КТ для широкой практики нашей службы крови, несмотря на некоторые недостатки (использование не одного, а несколько доноров), является метод дифференцированного центрифугирования отдельных доз консервированной крови.
В результате многолетних исследований в нашей лаборатории (В.А. Агра- ненко, А.Н. Компаниец, Р.И. Волкова, Л.В. Балезина, 1985—1992) были отработаны два метода выделения КТ из консервированной крови:
- Метод выделения КТ из обогащенной тромбоцитами плазмы (ОТП).
- Метод выделения КТ из лейкотромбоцитарного слоя (ЛТС).
Исследования распределения клеток крови при различных режимах центрифугирования донорской крови позволили отобрать оптимальные из них, дающие возможность получить этими двумя методами максимальную концентрацию тромбоцитов в КТ — в среднем около 70% (0,55—0,7* 1011) исходного содержания клеток в дозе (500 мл) консервированной крови.
Метод выделения КТ из обогащенной тромбоцитами плазмы состоит из двух этапов (см. рис.1). На 1-м этапе (А) контейнер N1 с консервированной кровью (хранившейся не более 4—6 ч после кроводачи при комнатной температуре) подвергается «мягкому» (Б) центрифугированию (режим 680g*13 мин), в результате чего тромбоциты концентрируются (В) в плазме, под ней располагается эритроцитная масса. Обогащенная тромбоцитами плазма (ОТП) с помощью плазмоэкстракгора (Г) переводится в контейнер N2. Контейнер N1 отсоединяется. На 2-м этапе ОТП (Е) подвергают «жесткому» (Ж) центрифугированию (режим 2400gx20 мин), так чтобы тромбоциты (3) осели на дно контейнера. Бесклеточную плазму сразу же с помощью плазмоэкстрак- тора (И) переводят в контейнер N3, оставляя в контейнере N2 около 55 мл плазмы для дальнейшего ресуспендирования осадка тромбоцитов. Контейнер N3 с бесклеточной плазмой (К) герметизируют и отсоединяют, а контейнер N2 с тромбоцитами (Л) оставляют в покое при комнатной температуре (22 °С) на 1—1,5 ч, так как немедленное ресуспендирование осажденных тромбоцитов приводит к образованию агрегатов, что связано с высвобождением содержимого тромбоцитарных гранул. Через 1—1,5 ч покоя контейнер с тромбоцитами помещают для их полного ресуспендирования в аппарат для авто-
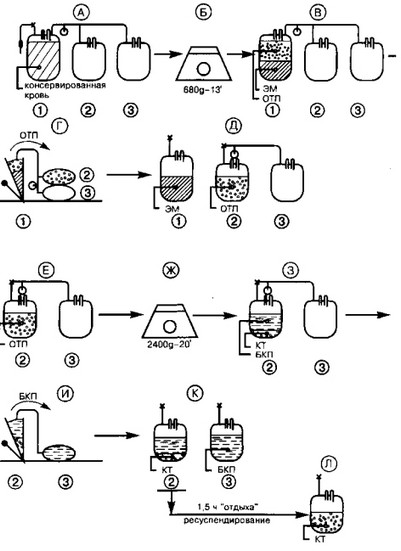
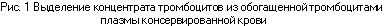
матического перемешивания, где в течение 3—4 ч при постоянном вращении 2 об/мин и температуре 22±1 °С агрегаты расходятся. Процедура приготовления КТ из ОТП занимает более 2-х ч.
В результате использования этого метода при фракционировании дозы (500 мл) консервированной крови получают:
- концентрат тромбоцитов, содержащий 0,78±0,13х 1011 клеток в плазме объемом 55±5 мл, предназначенный для трансфузии больным или для дальнейшего хранения;
- эритроцитную массу с гематокритом 0,75-0,85 в объеме 200—250 мл, предназначенную для дальнейшего хранения и лечебного использования;
- плазму, бедную тромбоцитами и лейкоцитами, в объеме 180—200 мл, предназначенную для дальнейшего замораживания, хранения, лечебного применения или фракционирования на препараты.
Метод выделения КТ из лейкотромбоцитарного слоя (ЛТС). На 1-м (А) этапе (см. рис.2) консервированную кровь (контейнер N1), хранившуюся не более 4—6 ч после кроводачи при комнатной температуре, подвергают (Б) «жесткому» центрифугированию (режим 2150g*20 мин). При этом тромбоциты (В) максимально концентрируются над эритроцитами в ЛТС, над которым располагается бесклеточная плазма. Большую часть бесклеточной плазмы (Г) переводят с помощью плазмоэкстрактора в контейнер N2, оставляя в контейнере N1 над эритроцитами слой плазмы высотой 4—5 см (65—75 мл). Контейнеры N1 и N2 отсоединяются (Д). Далее ЛТС с плазмой и минимальным слоем подлежащих эритроцитов (Е), общим объемом 115—125 мл тщательно перемешивают. На 2-м этапе контейнер N3 с ЛТС подвергают (Ж) «мягкому» центрифугированию (режим 190gx 10 мин), в результате которого лейкоциты и эритроциты, отличающиеся по удельной массе от тромбоцитов, оседают на дно контейнера (3), а тромбоциты оказываются над ними, взвешенными в плазме, близкой им по удельной массе, которую с помощью плазмоэкстрактора (И) переводят (К) в контейнер N4. Приготовление КТ из ЛТС занимает 30—40 мин.
В результате использования метода выделения КТ из ЛТС получают:
- концентрат тромбоцитов, содержащий 0,67±0,16х 1011 клеток в плазме объемом 64±10 мл, предназначенный для трансфузий больным или дальнейшего хранения;
- эритроцитную массу с гематокритом 0,85—0,95, объемом 180—200 мл, предназначенную для ресуспендирования, дальнейшего хранения и лечебного использования;
- плазму, бедную тромбоцитами и лейкоцитами, в объеме 200—240 мл, предназначенную для дальнейшего замораживания, хранения, лечебного применения или фракционирования на препараты;
- концентрат лейкоцитов, содержащий 1,5хДОи клеток в плазме объемом 50—60 мл, предназначенный для трансфузий, криоконсервирования или переработки на интерферон.
Мы провели сравнительную оценку описанных двух методов выделения КТ, проанализировали преимущества и недостатки каждого и приемлемость для применения в практике работы учреждений Службы крови страны (табл. 3).
Рис. 2 Выделение концентрата тромбоцитов из лейкотромбоцитарного слоя консервированной крови
Известно, что в процессе заготовки КТ существует опасность активации и даже повреждения тромбоцитов. Активация тромбоцитов легко вызывается самыми разными факторами (центрифугирование, ресуспендирование, изменение pH среды, качество полимерного контейнера и др.) и может сопровождаться высвобождением содержимого гранул во внеклеточную среду, что приводит к снижению функциональной активности и гемостатического потенциала клеток. Все это имеет большое значение для последующей сохранности полноценности тромбоцитов в процессе консервирования и их лечебной эффективности при трансфузиях больным.
Сравнительная оценка методов выделения и консервирования
концентратов тромбоцитов из отдельных доз консервированной крови
|
Сравниваемые показатели |
Методы выделения КТ |
|
|
|
из обогащенной тромбоцитами плазмы |
из лейкотромбо- цитарного слоя |
|
Доза консервированной крови, мл |
500 |
500 |
|
Число используемых полимерных контейнеров |
3 |
4 |
|
Режимы центрифугирования |
|
|
|
1-й этап |
680gxl3 мин |
2150gx20MHH |
|
2-й этап |
2400gx20 мин |
190gxiOMHH |
|
Результирующая сила воздействия |
1,89x10 10 |
о 'о X о |
|
на тромбоцит, Н |
||
|
Время приготовления КТ |
2-2,5 часа |
30—40 мин |
|
Получаемые компоненты крови |
концентрат |
концетрат тромбоцитов, |
|
|
тромбоцитов, |
эритроцитная масса, |
|
|
эртроцитная масса, |
плазма, концентрат |
|
|
плазма |
лейкоцитов 1,19±0,30 |
|
Концентрация тромбоцитов, х 10 /л |
1,42±0,41 |
64+10 |
|
Объем концентрата тромбоцитов, мл |
55+5 |
0,67+0,16 |
|
Количество тромбоцитов в дозе КТ, хю11 |
0,78+0,13 |
|
|
„ 8 |
‘ |
0,22+0,15 |
|
Примесь лейкоцитов в КТ, х 10 |
1,20±0,30 |
|
|
Допустимые сроки хранения КТ (часы) при постоянном перемешивании и температуре 22 °С |
120 |
|
|
72 |
|
|
Большое значение имеет также то, что при выделении тромбоцитов из ЛТС КТ имели меньшую примесь лейкоцитов и эритроцитов. Установлено, что при больших силах воздействия центрифугирования (метод выделения из ОТП) и при наличии примеси лейкоцитов и эритроцитов могут возникать повреждения тромбоцитов при ресуспендировании (Racz amp; Thek, 1984); примесь эритроцитов может оказывать неблагоприятное воздействие на функциональные свойства тромбоцитов при их консервировании. В процессе хранения КТ в результате изменений эритроцитов из них высвобождается АДФ в окружающую среду, что может вызывать состояние рефракгер- ности тромбоцитов — потерю способности к агрегации. По-видимому, это сказывается на сниженной функциональной активности КТ, выделенных из ОТП, в которых присутствует видимая примесь эритроцитов.
Кроме того, следует иметь в виду, что лейкоциты поглощают кислород, необходимый для дыхания тромбоцитов, и выделяют токсические продукты
метаболизма, поэтому может произойти критическое снижение pH в результате перехода тромбоцитов к анаэробному дыханию (Grade, 1980; Pietersz, 1988; Sloand amp; Klein, 1990).
В этом отношении является важным тот факт, что в КТ, полученных из ЛТС, эритроциты практически отсутствуют, а примесь лейкоцитов на порядок меньше, чем при выделении их из ОТП (соответственно 0,22±0,15* 108 и 1,2±0,3 х 108).
Меньшая загрязненность КТ эритроцитами и лейкоцитами создает определенные трансфузиологические преимущества методу выделения КТ из ЛТС.
Различные способы выделения КТ приводят к различной активации тромбоцитов, что сказывается на функциональных характеристиках полученных КТ и оказывает влияние на эффективность их хранения.
При использовании метода выделения из ОТП мы получали 0,78±0,13х 108 клеток, а при выделении из ЛТС — 0,67±016х 108, что на 15% меньше, чем из ОТП, хотя эти отличия статистически не достоверны. Также концентрация клеток в КТ, выделенных из ОТП, выше при меньшем объеме концентратов.
При этом следует учитывать, что метод выделения КТ из ОТП дает возможность регулировать объем плазмы и, следовательно, объем КТ. В отличие от этого, объем КТ, полученных из ЛТС, всегда больше и оказывается заданным оставленной бедной клетками плазмы на этапе подготовки к выделению ЛТС.
В свежевыделенных КТ, полученных разными методами, наблюдались различия в уровне внутриклеточного АТФ: в КТ, полученных из ОТП, на 13% снижен внутриклеточный АТФ по сравнению с уровнем АТФ в КТ, выделенных из ЛТС, хотя статистически эти различия не подтверждаются.
Значения pH характеризовались высокими показателями и были практически одинаковыми: 6,84 в КТ из ОТП и 6,87 в КТ из ЛТС.
Нами наблюдались различия в активности тромбоцитов агрегировать в ответ на парные стимулы (АДФ + арахидоновую кислоту). Она была достоверно снижена (рlt;0,05) в КТ, выдеденных из ОТП, по сравнению с КТ из ЛТС (соответственно 51±4% и 67±5%), т.е. составляла всего 76% от агрега- ционной способности тромбоцитов, выделенных из ЛТС.
Способность тромбоцитов, выделенных двумя методами, агрегировать на одиночный стимул (АДФ) не имела достоверных различий (рgt;0,05), хотя КТ, выделенные из ОТП, характеризовались более низкими показателями, чем КТ, выделенные из ЛТС (соответственно 38±6% и 46±8%).
Можно предположить, что эти различия агрегационной способности тромбоцитов в зависимости от метода их выделения проявлялись лишь при сильном воздействии парного агрегирующего агента (АДФ + арахидоновая кислота).
Анализ наших данных позволил сделать заключение о том, что функциональная активность тромбоцитов, полученных двумя методами, была на достаточно высоком уровне, позволяющем им обеспечивать гемостаз при трансфузиях больным с тромбоцитопеническими геморрагиями. Отмеченную нами несколько сниженную функциональную активность тромбоцитов, выделенных из ОТП, можно отнести за счет различной технологии их получения. Так, при выделении КТ из ЛТС силы воздействия на тромбоци-
ты и травматизация клеток ниже в связи с тем, что тромбоциты при «жестком» центрифугировании оседают на мягкую эритроцитарную «подушку». В то же самое время при выделении КТ из ОТП при «жестком» центрифугировании тромбоциты оседают на дно контейнера и при ресуспендировании тесно контактируют с примесью лейкоцитов и эритроцитов, что, по-видимому, и приводит к угнетению их функциональной активности.
Следует подчеркнуть, что преимущество КТ, выделенных из ЛТС, состоит и в том, что клетки в них находятся уже во взвешенном состоянии, поэтому не требуют времени для дезагрегации, на процедуру приготовления КТ из ЛТС консервированной крови затрачивается лишь 30—40 мин, в то время как на приготовление КТ из ОТП — 2—2,5 ч.
Таким образом, сравнивая два метода приготовления КТ, следует отметить, что в обоих случаях получаются тромбоциты, характеризующиеся высокой функциональной активностью. При этом КТ, выделенные из ОТП, содержат незначительно большее число клеток, а КТ, полученные из ЛТС, отличаются меньшими затратами времени на заготовку и более высокими показателями функциональной полноценности.
Мы также считали необходимым сравнить влияние метода выделения КТ на сохранность тромбоцитов при последующем консервировании: существуют ли различия, а также преимущества и недостатки в каждом из 2-х методов.
В процессе хранения КТ происходило постепенное плавное снижение концентрации тромбоцитов, достоверным оно становилось лишь к 120 ч хранения. Следует отметить, что в КТ из ОТП этот показатель всегда оказывался на более высоком уровне (рlt;0,02), чем в КТ из ЛТС, за исключением дня выделения, когда различия в показателях оказывались недостоверными
(рgt;0,2).
В связи с тем, что хранение КТ при комнатной температуре в результате накопления продуктов метаболизма (углекислоты и молочной кислоты) приводило к снижению уровня pH среды, условием, определяющим сохранность консервированных КТ при 22 °С, явилось поддержание pH среды выше критического уровня (6,0). Как показали наши исследования, в течение 72 ч значения pH в КТ, выделенных из ЛТС, были стабильными (6,87—6,89), в отличие от КТ из ОТП, и соответствовали значениям pH в день заготовки. Через 120 ч хранения на мешалке pH в КТ из ЛТС был равен 6,68, а это практически не отличалось (рgt;0,2) от величины pH в КТ из ОТП через 72 ч хранения. Надо отметить, что в 18% случаев в КТ из ОТП через 120 ч значения pH падали ниже 6,0, в отличие от КТ из ЛТС, у которых критическое падение pH отмечали лишь через 168 ч хранения.
Исследования содержания внутриклеточного АТФ в тромбоцитах показали, что различия в день заготовки между КТ из ОТП и из ЛТС носили недостоверный характер (рgt;0,5) и углублялись уже через 24 ч хранения; преимущество КТ, выделенных из ЛТС, прослеживалось на протяжении всего периода хранения. Уровень внутриклеточного АТФ в КТ, выделенных из ЛТС, через 120 ч хранения оказывался достоверно выше (рlt;0,02) по сравнению с 72 ч хранения КТ из ОТП и почти такой же, как в этих же концентратах через сутки хранения. Возможно, лучшую сохранность АТФ в КТ, выделенных из ЛТС, также можно объяснить меньшей травматичностью этого метода заготовки, так как известно, что при тесном контакте между тромбоцитами, осуществляемом при осаждении клеток из ОТП, в них происходит реакция высвобождения, что может быть причиной снижения внутриклеточного АТФ.
При хранении КТ при 22±1 °С в условиях постоянного перемешивания на протяжении всего периода наблюдений сохранялась агрегационная способность тромбоцитов реагировать на парный агрегирующий агент (АДФ + арахидоновая кислота). Даже к 120 ч хранения сохранялось 60% от исходного уровня агрегационной активности тромбоцитов, полученных обоими методами. При этом агрегационная способность тромбоцитов, выделенных из ЛТС, по абсолютной величине всегда была выше, чем в КТ, выделенных из ОТП, в те же сроки наблюдения. Через 120 ч хранения средняя степень агрегации тромбоцитов, полученных из ЛТС, совпадала по величине со степенью агрегации тромбоцитов, наблюдаемой с КТ, выделенных из ОТП, хранившихся 72 ч, и нет достоверных различий (рgt;0,5) с КТ из ОТП, хранившимися 24 ч.
Возможно, лучшая сохранность КТ, выделенных из ЛТС, по сравнению с КТ из ОТП, связана с высокой стабильностью pH в этих КТ. Это может быть связано с меньшей травмируемостью клеток, поскольку этот метод является более щадящим по сравнению с выделением тромбоцитов из ОТП, так как клетки испытывают меньшие силы механического воздействия при центрифугировании. Важно также то, что при выделении тромбоцитов из ЛТС эти КТ меньше загрязнены примесями лейкоцитов и эритроцитов, что и должно оказывать влияние на эффективность хранения, а также способствовать снижению частоты аллоиммунизации.
Таким образом, сравнительный анализ методов выделения КТ показывает, что двумя методами возможно получать из дозы консервированной крови достаточно высокое число функционально полноценных тромбоцитов. Метод выделения КТ из ЛТС в сравнении с выделением из ОТП отличается меньшими трудовыми и временными затратами, малой травматизацией клеток, значительным снижением примеси лейкоцитов и эритроцитов в концентратах. КТ, полученные обоими методами, возможно хранить в отечественных пластикатных контейнерах «Гемакон» и «Компопласт» при 22±1 °С и постоянном автоматическом перемешивании. КТ в процессе 72 ч хранения являются полноценными, а в последующие сроки (96—120 ч) в КТ, выделенных из ОТП, отмечается иногда даже критическое снижение pH, содержания внутриклеточного АТФ, агрегации. Это дало нам основание ограничить срок хранения КТ из ОТП 72-мя ч.
Функциональная полноценность КТ, выделенных из ЛТС, в процессе 120 ч остается на удовлетворительном уровне, что позволяет хранить их 120 ч. Свойства КТ, выделенных из ЛТС, в течение первых 24 ч полностью сохраняются на исходном уровне, и, следовательно, их можно приравнять к свежевыделенным. Через 120 ч хранения КТ, выделенные из ЛТС, по своим характеристикам не отличаются от КТ, выделенных из ОТП после 72 ч хранения при температуре 22±1°С и постоянном автоматическом помешивании.
Наши клинические исследования (Аграненко В.А., Компанией А.М., 1989— 1995) лечебной эффективности многих сотен трансфузий КТ, выделенных и консервированных по разработанному выше методу у больных с тромбоци- топеническим геморрагическим синдромом, показали, что КТ, сохраняемые в течение 72—120 ч в отечественных полимерных контейнерах типа «Гема- кон» и «Компопласт» при 22 °С, обеспечивают адекватный гемостатический и заместительный эффект, сопоставимый с результатами трансфузий свеже- заготовленных тромбоцитов.
