По определению де Фриза (1901), мутации (от лат. mutare - изменять) - это внезапные, скачкообразные изменения наследственных свойств. В современном понимании мутации представляют собой структурные изменения генов, приводящие к появлению нового признака. Мутации у микроорганизмов долгое время не признавались, и все изменения, в том числе и наследственные, истолковывались как прямое приспособление организма к среде (адаптация). Считалось, что изменчивость микроорганизмов определяется исключительно условиями среды и носит направленный характер. Основанием для таких утверждений служила слабая защищенность генетического материала микробных клеток от влияния среды.
Понадобились веские доказательства независимости мутаций от внешних факторов, т. е. доказательства их спонтанного (самопроизвольного) характера. Это было сделано рядом исследователей:
С. Луриа и М. Дельбрюком (1943), Г. Ньюкомбом (1949) и другими учеными, использовавшими для выявления мутантов метод реплик, предложенный Е. и Дж. Ледербергами (1952). С. Луриа и М. Дельбрюк изучали условия появления фагоустойчивых мутантов в культуре кишечной палочки, чувствительной к фагу
(флукгуационный тест). Свежую бульонную культуру Е. coli, предварительный анализ которой не выявил наличия фагоустойчивых мутантов, разводили до концентрации 10 клеток на 1 мл и делили на две части: в одну пробирку помещали 10 мл, а в 20 пробирок разливали по 0,5 мл. После инкубации в течение суток в термостате из каждой пробирки производился высев равных объемов культуры на агар, содержащий фаг. При этом предполагалось, что если фагоустойчивые мутанты возникают в результате контакта бактерий с фагом (гипотеза адаптации), то на всех чашках должно быть примерно одинаковое число колоний. Если же мутанты возникают спонтанно, то число их в каждой пробирке, содержащей по 0,5 мл культуры, а следовательно, и колоний на чашке будет разное. Это зависит от времени возникновения мутации: число мутантов будет большим там, где мутации произошли раньше, соответственно и колоний здесь будет больше. При анализе культуры из одной пробирки больших колебаний в числе фагоустойчивых клеток не должно наблюдаться.
Подсчет выросших фагоустойчивых колоний показал, что число колоний в пробах из разных пробирок (по 0,5 мл) сильно колебалось (флуктуировало), тогда как число их из пробы, взятой из одной пробирки (10 мл), было примерно одинаковым. Эти данные позволили заключить, что мутации фагоустойчивости происходили спонтанно, до контакта с фагом и в разное время развития культуры.
Аналогичные результаты были получены в еще более простом опыте Ньюкомба (перераспределительный тест). Культура кишечной палочки, чувствительная к фагу, высевалась на чашки с питательным агаром и инкубировались 6 ч (до появления микроколоний). Затем на ряде чашек производилось перераспределение (перерассев) колоний шпателем, остальные оставались нетронутыми (контроль). После этого все чашки засевались фагом, повторно инкубировались и подсчитывалось число колоний, выросших из фагоустойчивых клеток. Оказалось, что на чашках, где было произведено перераспределение, оно было значительно большим, чем на контрольных. Если бы фагоустойчивые мутанты возникали только при контакте с фагом (прямая адаптация), то число колоний на опытах и контрольных чашках было бы примерно одинаковым. Если же они возникают самопроизвольно (спонтанно) до контакта с фагом, то в зависимости от времени их образования может появиться колония мутантных клеток, при перераспределении которых каждая из них даст колонию фагоустойчивых клеток. Поэтому на чашках, где было произведено перераспределение, число таких колоний оказалось значительно большим.
Результаты опытов Г. Ньюкомба, как и более ранние опыты С. Луриа и М. Дельбрюка, доказали спонтанность мутаций у микроорганизмов и несостоятельность гипотезы «прямой адаптации».
Мутации у микроорганизмов возникают ненаправленно, до воздействия селектирующего агента. В одной бактериальной культуре могут содержаться мутанты, устойчивые или чувствительные к разным агентам. Это легко выявить методом отпечатков, или реплик, исключающим всякий контакт клеток с селективным агентом. Сущность метода состоит в следующем. На цилиндр с диаметром, немного меньшим диаметра чашки Петри, закрепляется стерильный бархат (ворсом наружу). На него слегка накладывается матричная чашка (чашка, из которой производится пересев или «перепечатка» колоний), и в результате на ворсинках бархата остается часть клеток. Затем на бархатный штамп накладываются чашки-реплики (чашки, на которые пересеваются колонии) и клетки с ворса попадают на питательную среду. В зависимости от состава среды на ней могут развиваться не все колонии исходной чашки. Используя различные селективные среды, из колоний, выросших на матричной чашке, можно отобрать различные мутанты: фотоустойчивые, антибиотикоустойчивые,
ауксотрофные. Но при этом надо одновременно производить пересев на селективную и полноценную среду и точно фиксировать место расположения колоний в чашке. Таким путем производится непрямой отбор мутантов.
Применение прямых и косвенных методов показало, что устойчивость бактерий к фагам, антибиотикам, ауксотрофность
мутагенными, а мутации, возникающие в результате их действия, - индуцированными.
Возможность искусственного индуцирования мутаций впервые была показана Г. А. Надсоном и Г. С. Филипповым (1925). Они первыми обнаружили мутагенное действие лучей Рентгена на дрожжи. Затем в 1927 г. Г. Меллер подтвердил мутагенность рентгеновских лучей и возможность индуцированного мутагенеза на дрозофиле. Позднее, в 1938 г., И. Раппопорт установил, что химические вещества также вызывают мутагенный процесс.
Мутагены по своей природе делятся на две большие группы: физические и химические. К физическим мутагенам относят рентгеновские лучи, а- и (3-частицы, у-лучи, испускаемые радиоактивными элементами, нейтроны, ультрафиолетовые лучи (УФ), низкие и высокие температуры; к группе химических мутагенов - азотистую кислоту, аналоги азотистых оснований, алкилирующие вещества и ряд других соединений. Это более «мягкие» мутагены, чем физические, они реже дают летальный эффект, так как действуют избирательно.
В основе механизма действия мутагенов лежит их прямое или косвенное влияние на ДНК или на ее предшественников - основания. Многие химические агенты изменяют состав оснований ДНК, вызывая тем самым ошибки при репликации. Например, азотистая кислота дезаминирует аденин, гуанин, цитозин. Аденин при этом превращается в гипоксантин и спаривается не с тимином, а с цитозином. В результате появляется пара не АТ, а ГЦ (пурин- аденин заменяется пурином-гуанином; пиримидин может заменяться другим пиримидином). Такого рода изменения, т. е. замена одного основания другим, одинаковым по типу, называются транзициями.
Алкилирующие агенты (например, этиленимин, азотные и серные аналоги иприта), являющиеся наиболее сильными мутагенами, обусловливают образование алкилированных производных азотистых оснований. Последние отщепляются от цепи ДНК, вследствие чего возникают бреши (пропуски). При репликации в это место могут вставляться несоответствующие им «неправильные» основания.
УФ-облучения приводят к образованию в ДНК димеров тимина (см. гл. 6).
Типы мутаций. Как спонтанные, так и индуцированные мутации являются результатом нарушения нуклеотидной последовательности в ДНК. Они могут затрагивать либо только один ген (генные мутации), либо большее количество генов (хромосомные мутации).
Если изменения происходят в одном нуклеотиде, мутации называются точковыми. Точковые мутации по характеру изменений в ДНК можно разделить на транзиции, трансверсии, мутации со сдвигом рамки (вставка лишнего нуклеотида или выпадение - делеции).
Как указывалось выше, простые замены, или транзиции, заключаются в замещении одной пары пурин-пиримидин на другую пару пурин-пиримидин, т. е. происходит замещение АТ на ГЦ или ГЦ на АТ. Это значит, что пурин в одной из цепей замещается другим пурином, а пиримидин в комплементарной цепи - другим пиримидином.
При трансверсиях (перекрестные замены) пара пурин- пиримидин замещается парой пиримидин-пурин. Трансверсии, как и транзиции, часто возникают спонтанно.
Мутации со сдвигом рамки, обусловленные вставкой или выпадением нуклеотида, нарушают нормальную последовательность «считывания» нуклеотидных триплетов. В процессе репликации ДНК в новообразованную комплементарную цепь «напротив» вставленного нуклеотида также включается лишний нуклеотид. При последующей репликации продолжают синтезироваться цепи с лишним основанием.
Делеции относятся также к мутациям со сдвигом рамки, но в отличие от последних обусловлены выпадением одного основания. Делеции могут возникать в результате гидролитического отщепления пуринового основания (например, при повышении температуры), а также под действием алкилирующих или дезаминирующих веществ, которые приводят к образованию азотистых оснований, неспособных к комплементарному спариванию.
На жизнеспособности клетки точковые мутации сказываются по-разному. Транзиции и трансверсии - сравнительно «мягкие» мутации, поскольку в худшем случае обусловливают замену только одной аминокислоты в соответствующей полипептидной цепи (а иногда в силу вырожденности генетического кода вообще не происходит аминокислотной замены). Дефектный белок с одной замененной аминокислотой функционально не отличается от нормального белка. Такие мутации, при которых не происходит функциональных изменений, называются молчащими мутациями. Вставки и делеции чаще всего детальны для клетки, так как вызывают неправильное считывание ДНК за пределом мутировавшего участка.
У микроорганизмов с точковыми мутациями наблюдаются обратные мутации, приводящие к возврату исходных свойств, т. е. к дикому типу. Обратные мутации могут происходить путем истинной реверсии, например восстановлением первоначальной пары оснований. Если прямая мутация произошла в результате замены АТ на ГЦ, то реверсия сводится к обратной замене ГЦ на АТ. Такие организмы называются ревертантами. Однако мутанты могут ревертировать к дикому типу и в результате вторичной мутации, произошедшей в другом, отдаленном от первой мутации, участке ДНК. Такая мутация может оказать подавляющее (супрессорное) действие на свойство, возникшее в результате первой мутации. Такие мутации называются супрессорными. В противоположность истинным реверсиям образовавшиеся таким путем ревертанты фенотипически отличаются от организмов дикого типа меньшей выраженностью исходных функций.
Мутации, возникающие в результате делений, чрезвычайно стабильны. У делеционных мутантов ни истинные, ни супрессорные реверсии невозможны.
Влияние мутаций на свойства фенотипа проявляется обычно через изменение структуры белка вследствие нарушений транскрипции или трансляции. По характеру изменений фенотипа различают морфологические, физиологические и биохимические мутации. К морфологическим относятся мутации, приводящие к видимым изменениям - формы клеток, колонии и пигментации; к физиологическим - мутации, влияющие на жизнеспособность,
скорость роста; к биохимическим - все мутации, нарушающие синтез и активность ферментов, вызывающие нарушения в метаболических путях. Результатом проявления биохимических мутаций является образование ауксотрофных мутантов, которые в отличие от микроорганизмов дикого типа - прототрофов - неспособны синтезировать необходимые для жизнедеятельности вещества - аминокислоты, витамины и т. д. К биохимическим мутациям относятся также все изменения, нарушающие синтез ферментов, участвующих в репликации ДНК, репарации повреждений, транскрипции и трансляции.
Некоторые генные мутации могут вызвать изменения фазу нескольких свойств организма. Они получили название плейотропных - множественных. Примером может служить мутация, инактивирующая фермент биосинтеза капсульного полисахарида бактерий. Следствием ее является потеря клеткой способности к образованию капсулы, изменение морфологии колоний и, в случае патогенных бактерий, потеря вирулентности.
Плейотропное действие мутация оказывает в том случае, когда затрагивает ген, продукт которого (белок) выполняет несколько функций.
Примером плейотропных мутаций является также мутация гена, кодирующего синтез одного из минорных оснований, входящих в состав транспортных РНК. В результате такой мутации при повышенной температуре синтезируются дефектные тРНК, что может привести к нарушению трансляции и гибели мутантных клеток.
Генные мутации являются причиной большинства изменений морфологических, физиологических и биохимических свойств микроорганизмов.
Репарация повреждений. Большинство повреждений ДНК, вызываемых физическими и химическими агентами, исправляются с помощью специальных механизмов репарации, направленных на восстановление целостности структуры ДНК. Действие механизмов репарации обеспечивается конструктивными и индуцибельными ферментами.
Лучше других изучены процессы репарации повреждений ДНК, вызванные действием УФ-облучения. Еще в 1949 г. было установлено, что освещение видимым светом (с длиной волны больше 400 нм) дрожжей, облученных летальной дозой УФ, восстанавливает их жизнеспособность на 25-50 %. Это явление получило название фотореактивации.
В основе фотореактивации лежит действие фермента дезоксириботидпиримидинфотолиазы, который связывается с пиримидиновым димером и, используя энергию поглощаемого света (наиболее эффективен голубой свет), расщепляет его на мономеры. Фотореактивация распространяется только на одну цепь ДНК, независимо от того, одно- или двухцепочечная молекула повреждена.
Более универсальным механизмом восстановления повреждений является темновая репарация. Она имеет место не только после УФ-облучения, но и после действия ионизирующей
 радиации, алкилирующих соединений и др. В отличие от фотореактивации темновая репарация не нуждается в энергии света. Сущность ее состоит в вырезании димеров и восстановлении целостности поврежденной нити. Поэтому темновую репарацию называют эксцизион- ной (эксцизия - вырезание). Темновая репарация имеет свою особенность - восстановление одноцепочечных повреждений происходит лишь в том случае, когда не
радиации, алкилирующих соединений и др. В отличие от фотореактивации темновая репарация не нуждается в энергии света. Сущность ее состоит в вырезании димеров и восстановлении целостности поврежденной нити. Поэтому темновую репарацию называют эксцизион- ной (эксцизия - вырезание). Темновая репарация имеет свою особенность - восстановление одноцепочечных повреждений происходит лишь в том случае, когда неповреждена комплементарная цепь. Двухцепочечные повреждения клетка не способна репарировать.
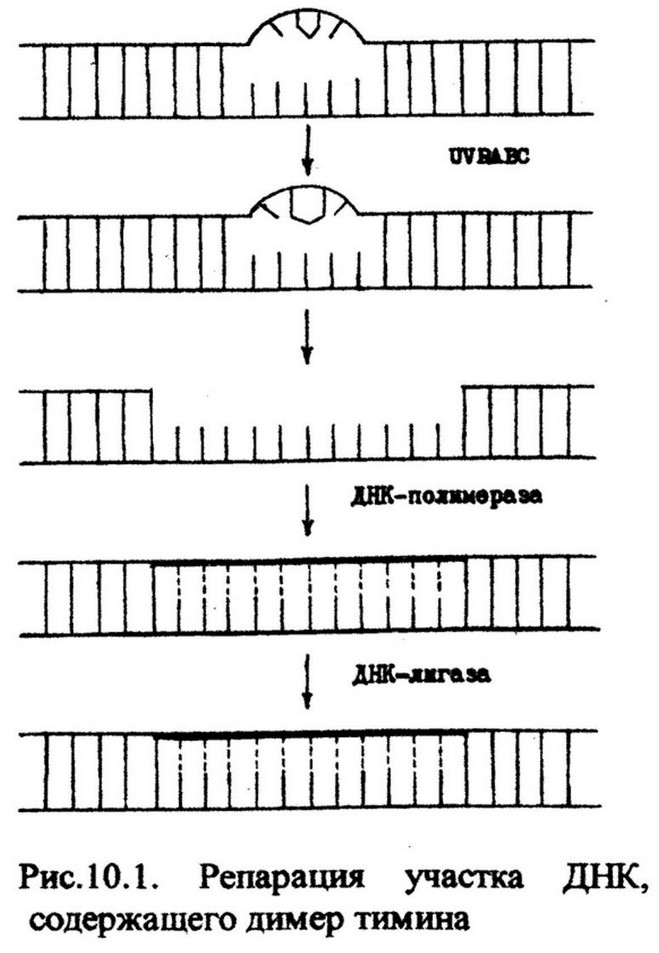
В темновой репарации ведущую роль играют четыре ферментативные реакции, которые определяют четыре этапа репарации (рис. 10.1).
На первом этапе эксцизионная нуклеаза UVRABC (от англ, ultraviolet radiation - UVR, А, В, С - обозначения белков, кодируемых генами UVR), обладающая эндонуклеазной активностью, «узнает» повреждения и надрезает нить ДНК по обе стороны вблизи пиримидинового димера. Затем, под действием этого же фермента надрезанный участок нити, включающий 12-13 нуклеотидов вместе с димером, удаляются. Образовавшаяся брешь заполняется фрагментом комплементарной нити ДНК, образующейся в ходе репаративного синтеза (ресинтеза). Эту реакцию катализирует ДНК- полимераза I, которая для синтеза необходимого фрагмента ДНК использует в качестве матрицы неповрежденную комплементарную цепь. Новосинтезированный фрагмент и неповрежденный остаток цепи соединяются ДНК-лигазой. Целостность молекулы ДНК восстанавливается.
Репарирующая способность клетки в значительной степени определяет исход первичных повреждений и, таким образом, резистентность клетки к облучению.
Мутанты, утратившие способность к темновой репарации, обладают повышенной чувствительностью к летальному действию ультрафиолета.
Изучение механизмов репарации генетического аппарата имеет общебиологическое значение. Не только микроорганизмы, но и клетки высших организмов - человека и животных - обладают репарирующими системами, которые способны восстанавливать повреждения, возникающие в результате действия радиации и других мутагенных факторов.
