5.3.2. Возможность регрессии атеросклеротической бляшки под влиянием лечения
Все условия, которые необходимы для регрессии бляшки, основаны на предположении, что мобилизация холестерина атером требует создания обратного градиента концентрации между артериальной стенкой и
плазмой. Принимая во внимание, что атероматозная бляшка, по крайней мере, на 25% состоит из холестерина, значительное уменьшение этого компонента бляшки может приводить к функционально значимому улучшению кровотока в стенозированной артерии.
Идеальным вариантом обратного развития атеросклеротических изменений было бы возвращение артериальной стенки к исходному, здоровому состоянию. Очевидно, что обратного развития в такой мере не происходит даже при самых благоприятных условиях.
Для регрессии атеросклеротических бляшек, вызванных 18-месячной гиперхолестеринемией у обезьян, холестерин в плазме крови нужно снизить до 150 мг/дл (3,9 ммоль/л) и ниже на срок 12-18 месяцев. При этом патологоанатомические признаки регрессии включают сокращение размера бляшки, содержания в ней липидов, уменьшение числа пенистых клеток и сокращение некротической зоны в центре бляшки, а также повышение плотности клеток и содержания коллагена в фиброзной капсуле. Причем повышение коллагена идет очень медленно и никогда не возвращается к исходному уровню [78].
Таким образом, хотя регрессия и увеличивает просвет артерии, стенки сосуда остаются склерозированными.
 Как стало известно, артерии человека при атеросклерозе подвергаются однотипной реорганизации: возрастает морфологическая, биохимическая и функциональная гетерогенность эндотелиальных и гладкомышечных клеток, заселяющих интиму и медию. Одновременно в циркулирующей крови увеличивается молекулярная гетерогенность ЛПНП и ЛПОНП. Региональная гетерогенность клеток сосудистой стенки в сочетании с гетерогенностью липопротеинов приводит к возникновению качественно новых метаболических ситуаций, которые никогда не встречаются в здоровом организме. С использованием культуры клеток сосудистой стенки человека удалось найти новые
Как стало известно, артерии человека при атеросклерозе подвергаются однотипной реорганизации: возрастает морфологическая, биохимическая и функциональная гетерогенность эндотелиальных и гладкомышечных клеток, заселяющих интиму и медию. Одновременно в циркулирующей крови увеличивается молекулярная гетерогенность ЛПНП и ЛПОНП. Региональная гетерогенность клеток сосудистой стенки в сочетании с гетерогенностью липопротеинов приводит к возникновению качественно новых метаболических ситуаций, которые никогда не встречаются в здоровом организме. С использованием культуры клеток сосудистой стенки человека удалось найти новые
сонных артериях
подходы к оценке атерогенности подфракций липопротеинов, а это, в свою очередь, привело к разработке новых методов оценки гиполипи- демических препаратов и процедуры экстракорпорального удаления избытка липопротеинов [102].
Широкое клиническое применение экстракорпоральных методов лечения гиперхолестеринемии вселяет надежду на то, что массивное удаление холестерина и, особенно ХС-ЛПНП, восстанавливая микроциркуляцию, будет способствовать ускорению липопротеидлиполиза и позволит добиться регрессии атеросклеротических бляшек [103].
Из работ, в которых использовался метод ЛПНП-афереза и повторная коронарная ангиография, следует отметить исследование группы LARS, в котором проводилось лечение 37 пациентов [104]. До начала экстракорпоральной терапии средний уровень ХС-ЛПНП составил 8,05 ммоль/л, после афереза он снизился до 1,87 ммоль/л. При анализе повторных ангиограмм регрессия коронарных стенозов наблюдалась у 14 больных, в том числе у 4 с гомозиготной формой заболевания.
Однако в другом исследовании, выполненном позднее, было показано, что, хотя ЛПНП-аферез в комбинации с симвастатином был более эффективным в отношении снижения уровня ХС-ОПНП, чем терапия симвастатином и колестаполом, это не привело к большему влиянию на коронарный атеросклероз по данным количественного ангиог- рафического анализа [105].
Целью одного из наших исследований было изучение влияния плаз- мафереза на уровень липидов крови и эхоморфоструктуру атеросклеротических бляшек в сонных артериях [106,107].
Обследовано 19 больных атеросклерозом (все мужчины) с клиническим признаками хронической недостаточности мозгового кровообращения I-IV степени, у которых по данным УЗИ обнаруживался экст- ракраниальный стеноз хотя бы одной сонной артерии, при исходном уровне ОХС 6,5 ммоль/л и выше.
Всем больным проведена ультразвуковая ангиография сонных артерий в продольной и поперечной проекциях (методика исследования описана в предыдущих разделах). Определяли степень стенозирования внутренних сонных артерий (ВСА) и денситометрически измеряли интенсивность отраженного сигнала, по которой судили о плотности структур в зоне интереса.
Несмотря на различия в клинических проявлениях заболевания, степень стеноза не превышала 50% внутреннего диаметра ВСА, при этом у 14 больных поражение было односторонним, у 5 — двусторонним. Атеросклеротические бляшки 1-го типа (рыхлые, “мягкие”) с интенсивностью эхо-сигнала менее 18 Дб обнаружены у 12 больных, в остальных
- случаях бляшки были 2-3-го типа (гетерогенные и/или плотные) с широким диапазоном гистограммы от 19 до 33 децибелл.
Каждому больному проведено 4 сеанса плазмафереза (В.М.Шипулин, С.Д.Панфилов) с интервалом 1-2 дня на отечественном плазмасепарато- ре ПФ-05 с использованием вено-венозного контура путем катетеризации подключичных или кубитальных вен. За одну процедуру удаляли 400-600 мл плазмы с адекватной заменой желатиноль-реоглюма- новой смесью с добавлением гепарина в дозе 250-300 ЕД/кг. Ультразвуковое исследование повторяли по стандартному протоколу через 3-5 дней после последнего сеанса плазмафереза. В эти же сроки повторно определяли содержание в крови ОХС, ХС-ЛПНП, триглицеридов и фибриногена.
Как и следовало ожидать, проведенное экстракорпоральное лечение привело к выраженному снижению уровня ОХС, ХС-ЛПНП, триглицеридов и фибриногена соответственно на 24, 25, 25,6 и 30,5%. (все различия достоверны).
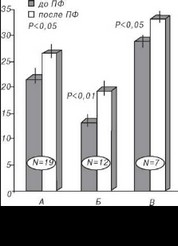
При исследовании каротидных бляшек до лечения интенсивность эхо-сигнала в целом по группе составляла 21,6+1,8 Дб, а после 4-кратного плазмафереза она увеличилась на 18,8% (рис. 5.2). У больных с низкой исходной величиной этого показателя (13,2+0,7 Дб) уплотнение бляшек было более значительным (на 31%). Не лишен интереса тот факт, что и у больных с относительно высокой плотностью эхо-сигнала до лечения (28,9+1,9 Дб) после плазмафереза наблюдались аналогичные, хотя и менее выраженные, изменения бляшек в сонных артериях: интенсивность эхо-сигнала увеличилась на 12,5% (рlt;0,05).
При внутригрупповом анализе установлено, что у 5 больных с исходным широким диапазоном интенсивности ультразвукового сигнала (бляшки 2-го типа) лечение плазмаферезом привело к значительному, на 5-10 Дб, а у одного больного — на 20 Дб, приросту акустической плотности, что могло быть обусловлено только структурными изменениями атеросклеротических бляшек. Вместе с тем нельзя не указать, что какой-либо динамики степени стенозирования ВСА мы не обнаружили.
Не касаясь причин отчетливого уменьшения неврологического дефицита по данным клинического обследования этих пациентов, что могло быть связано с корригирующим влиянием плазмафереза на гемореоло- гические расстройства и с восстановлением церебральной микроциркуляции, следует предположить, что сам по себе факт повышения интенсивности ультразвукового сигнала, характеризующего уплотнение структур в зоне интереса, является позитивным и может отражать процессы делипидации и организации рыхлых и фиброзных атеросклеротических бляшек.
Необходимо, однако, упомянуть, что липиды наиболее быстро удаляются из поверхностных слоев интимы (в том числе из области атеросклеротических бляшек), тогда как из атероматозного ядра бляшек, окруженного фиброзной тканью, резорбция липидов происходит медлен
но [78].
Поэтому интенсивная гиполипидемическая терапия, если и не ведет к увеличению проходимости артерий, то уж во всяком случае должна снижать риск тромбоэмболических осложнений.
Описанные в предыдущем разделе многоцентровые ангиографичес- кие исследования подтвердили возможность спонтанного уменьшения выраженности коронарного стеноза и показали, что гиполипидемичес- кие вмешательства увеличивают число таких случаев. Основным выводом этих исследований было то, что снижение уровня ОХС и ХС-ЛПНП только замедляет прогрессирование стенозирующего атеросклероза [108]. О выраженности такого эффекта и длительности лечения, которое для этого требуется, можно судить по красноречивым результатам исследования MAAS [92]. Под влиянием симвастатина уровень ХС- ЛПНП снизился на 31%, а ХС-ЛПВП - повысился на 9%. При этом достоверную динамику минимального диаметра коронарного стеноза и среднего диаметра просвета сосуда выявили только через 4 года непрерывной гиполипидемической терапии.
В исследовании ACAPS [24] изучалось действие ловастатина на течение атеросклеротических изменений в сонных артериях. Разница между группами по данным каротидной ультрасонографии стала выявляться только после 12 мес лечения. В результате 3-летнего наблюдения выяснилось, что в группе плацебо средняя максимальная толщина инти- мы-медии увеличивалась на 0,006 мм в год, тогда как в группе больных, получавших ловастатин, этот показатель уменьшался на 0,009 мм в год. Иными словами, по сравнению с получавшими плацебо у кого изменения сонных артерий прогрессировали, у лечившихся ловастатином произошла регрессия (уменьшение) суммарной толщины интимы-медии сонных артерий.
Таким образом, в многоцентровых, рандомизированных, плацебо- контролируемых и многолетних исследованиях эффектов гиполипи- демической терапии было установлено несколько очень важных фактов [108].
- Данные, полученные как в контрольных группах, так и в группах вмешательства, показали, что атеросклероз - непрерывно прогрессирующий процесс.
- Снижение в крови уровня холестерина под влиянием гиполипи- демической терапии приводило к явному замедлению прогрессирования атеросклероза как коронарного, так и других локализаций.
- Получено подтверждение положения о том, что атеросклероз - генерализованный процесс, - и его уменьшение в одном месте (например, в сонных артериях) сопровождается косвенными признаками уменьшения выраженности в другом сосудистом бассейне.
- Для проявления терапевтического влияния на стенозы коронарных
артерий требовалось значительное время, во всяком случае — не менее двух лет. - В некоторых исследованиях снижение уровня холестерина сопровождалось быстрым уменьшением числа сердечно-сосудистых клинических событий, — более быстрым и более выраженным, чем можно было бы ожидать, исходя из динамики стенозирующего коронарного атеросклероза.
Последний вывод, действительно, вызывает недоумение. Как подчеркнули G.Levine и соавт. [109], обращает на себя внимание несоответствие между обнаруженным во многих исследованиях незначительным уменьшением коронарного стеноза (в среднем на 1-2%) на фоне гиполипидемической терапии и существенными положительными сдвигами в клиническом течении ИБС. Чем можно объяснить этот парадокс?
К настоящему времени накоплено достаточное количество фактов, объясняющих причины и механизмы быстрого улучшения клинического состояния больных атеросклерозом в результате значительного снижения уровня ОХС и ХС-ЛПНП под влиянием гиполипидемической терапии.
Однако, прежде всего, необходимо напомнить, что при атеросклерозе развитие острого ишемического синдрома (нестабильной стенокардии, инфаркта миокарда) связывают с прогрессированием гемодинамически незначимых стенозов артерий. Образующие такие стенозы “молодые” атеросклеротические бляшки содержат много липидов, имеют тонкую фиброзную капсулу, богатую пенистыми клетками и потому больше предрасположены к разрыву оболочки с последующим контактом липидного содержимого атеромы с кровью, кровоизлиянием в бляшку и тромбозом [1,2,108]. Кроме тонкой фиброзной оболочки, “молодые”, или уязвимые, бляшки имеют выраженную воспалительную реакцию, а именно, повышенная активность макрофагов, выделяющих металлопротеазы, способные разрушать коллаген, является, как считают, причиной разрывов капсулы атеросклеротической бляшки [113].
Гиполипидемические средства, удаляя эфиры холестерина именно из этих бляшек, способствуют уменьшению липидного ядра, выраженности воспалительной реакции и укреплению их фиброзной капсулы. Процесс уменьшения вероятности нарушений целостности оболочки бляшки обозначают как стабилизацию.
Таким образом, согласно концепции B.Brown и соавт. [3], первой и основной причиной улучшения клинического течения ИБС при проведении гиполипидемической терапии является стабилизация наиболее предрасположенных к разрывам атеросклеротических бляшек.
Как нами неоднократно указывалось выше, в патогенезе атеросклероза и тромбоза большая роль (медиатора) отводится функции эндоте
лия. Уже на ранних стадиях развития атеросклероза, когда структурные изменения в интиме еще отсутствуют, страдает функциональное состояние эндотелия, о чем свидетельствует нарушение эндотелийзависимой артериодилатации. Это связано с нарушением синтеза оксида азота (NO)
- эндотелий релаксирующего фактора, что способствует вазоконстрик- ции, а также адгезии тромбоцитов и лейкоцитов к поверхности эндотелия. Полагают, что в основе патологических ангиоспастических реакций лежат ги-перактивность гладкомышечных элементов сосудистой стенки и снижение синтеза местного вазодилататора простациклина в связи с повреждением эндотелия сосуда [108]. Ангиоспастические реакции патогенетически тесно связаны с процессами тромбообразования через механизм нарушения простациклин-тромбоксанового баланса. Уменьшение продукции простациклина эндотелием ведет к падению ан- тиагрегационной активности сосудистой стенки, а снижение синтеза тканевого активатора плазминогена приводит к снижению антитромбо- тических свойств эндотелия [110].
Механизмы положительного влияния гиполипидемической терапии на функцию эндотелия и перфузию миокарда до конца не изучены. Однако уже сейчас доказано, что интенсивная терапия ловастатином уже через 5,5 мес от начала лечения улучшает вазомоторную функцию эндотелия при атеросклерозе и восстанавливает способность коронарных артерий к дилатации [34,108]. Кроме того, сравнительно недавние исследования показали наличие достаточно выраженного антитромбоци- тарного и антитромботического действия некоторых гиполипидемичес- ких препаратов (в част-ности, статинов). Причем по сравнению с сим- вастатином правастатин в значительно большей степени уменьшал размеры тромбоцитарного тромба [11].
Суммируя изложенное, клиническое улучшение течения атеросклероза и ИБС под влиянием гиполипидемического лечения объясняют в настоящее время следующими причинами [3,34,108,111]:
- стабилизацией атеросклеротических бляшек;
- улучшением, а возможно, и восстановлением функционального состояния эндотелия артерий;
- улучшением текучести крови, ее вязкостных свойств;
- нормализацией функции тромбоцитов, уменьшением “тромботического потенциала”.
Среди возможных механизмов стабилизации атеросклеротической бляшки при снижении уровня ХС-ЛПНП наиболее реальными считают следующие [108,112]: 1) замедление образования пенистых клеток;
- снижение активности макрофагов и уменьшение воспалительной реакции; 3) увеличение удаления липидов из бляшки и повышение уровня ХС-ЛПВП; 4) снижение уровня цитотоксических антигенов, в част
ности, окисленных ЛПНП.
Исходя из приведенных выше данных, есть все основания для вполне определенного вывода: гиполипидемические вмешательства приводят к стабилизации стенозирующего процесса в артериях или даже к регрессии атеросклеротических бляшек, то есть обладают не только анти- атерогенным (первичным профилактическим), но и антиатеросклеро- тическим (терапевтическим) действием. Поэтому больные атеросклерозом и ИБС должны получать гиполипидемическое лечение, независимо от уровня общего холестерина в плазме крови, критерием эффективности проводимой терапии, наряду с улучшением клинических показателей, может служить уровень холестерина - ЛПНП 100 мг/дл и ниже.
А так же в разделе «5.3.2. Возможность регрессии атеросклеротической бляшки под влиянием лечения »
- ДИАГНОСТИКА НАРУШЕНИЙ ЛИПИДНОГО ОБМЕНА
- МЕТОДЫ ВИЗУАЛИЗАЦИИ АТЕРОСКЛЕРОТИЧЕСКОГО ПОРАЖЕНИЯ АРТЕРИЙ
- Рентгенологическое исследование сосудов
- Ультразвуковое исследование (УЗИ) сосудов
- Магнитно-резонансная (МР) томография сосудов
- ГЛАВА 3. СПИСОК ЛИТЕРАТУРЫ
- ГЛАВА 4 МЕТОДЫ ФУНКЦИОНАЛЬНОЙ ОЦЕНКИ КОРОНАРНОГО, МОЗГОВОГО И ПЕРИФЕРИЧЕСКОГО КРОВООБРАЩЕНИЯ ПРИ АТЕРОСКЛЕРОЗЕ
- ФУНКЦИОНАЛЬНЫЕ НАГРУЗОЧНЫЕ ПРОБЫ: КЛАССИФИКАЦИЯ, ПАТОФИЗИОЛОГИЧЕСКИЕ МЕХАНИЗМЫ, МЕТОДИЧЕСКИЕ АСПЕКТЫ
- Пробы с дозированными физическими нагрузками
- Электрическая стимуляция сердца
- Пробы, связанные с изменением объема притока крови
- Пробы с психоэмоциональным напряжением
- Дыхательные пробы
- Парциальные периферические нагрузочные пробы
- КЛИНИКО-ИНСТРУМЕНТАЛЬНЫЕ МЕТОДЫ ОЦЕНКИ РЕЗУЛЬТАТОВ ФУНКЦИОНАЛЬНЫХ НАГРУЗОЧНЫХ ПРОБ
- Клинические данные при проведении функциональных проб
- Электрокардиографический контроль при проведении функциональных проб
- Изменения системной и регионарной гемодинамики при функциональных нагрузочных пробах
- Ультразвуковые исследования во время проведения стресс-тестов
- 4.2.5. Радионуклидные исследования при функциональных пробах
- ОСОБЕННОСТИ ФУНКЦИОНАЛЬНОГО ОБСЛЕДОВАНИЯ БОЛЬНЫХ С СОЧЕТАННЫМ АТЕРОСКЛЕРОЗОМ КОРОНАРНЫХ, МОЗГОВЫХ И ПЕРИФЕРИЧЕСКИХ АРТЕРИЙ
- КОНЦЕПЦИЯ КОРОНАРНОГО, МИОКАРДИАЛЬНОГО, ЦЕРЕБРОВАСКУЛЯРНОГО И ПЕРИФЕРИЧЕСКОГО СОСУДИСТОГО РЕЗЕРВОВ
- ГЛАВА 4. СПИСОК ЛИТЕРАТУРЫ
- ГЛАВА 5 СОВРЕМЕННЫЕ МЕТОДЫ ЛЕЧЕНИЯ АТЕРОСКЛЕРОЗА
- МЕРОПРИЯТИЯ, НАПРАВЛЕННЫЕ НА ПРОФИЛАКТИКУ АТЕРОСКЛЕРОЗА И ИБС
- 5.2. КОРРЕКЦИЯ НАРУШЕНИЙ ЛИПИДНОГО ОБМЕНА У БОЛЬНЫХ АТЕРОСКЛЕРОЗОМ
- Общие диетические рекомендации
- Гиполипидемические лекарственные средства
- Экстракорпоральные и хирургические методы лечения тяжелых нарушений липидного обмена
- ОЦЕНКА ЭФФЕКТИВНОСТИ ГИПОЛИПИДЕМИЧЕСКОГО ЛЕЧЕНИЯ
- ПЕРСПЕКТИВЫ АНТИАТЕРОГЕННОЙ И АНТИАТЕРОСКЛЕРОТИЧЕСКОЙ ТЕРАПИИ
- ГЛАВА 5. СПИСОК ЛИТЕРАТУРЫ