КОНЦЕПЦИЯ КОРОНАРНОГО, МИОКАРДИАЛЬНОГО, ЦЕРЕБРОВАСКУЛЯРНОГО И ПЕРИФЕРИЧЕСКОГО СОСУДИСТОГО РЕЗЕРВОВ
В выявлении и изучении локализации и степени выраженности ате- ро-склеротического поражения сосудов любой области организма эталонным методом считается контрастная ангиография. Ультразвуковое исследование брахиоцефальных артерий и сосудов конечностей позволяет оценивать морфологический субстрат поражения и измерять скорость кровотока. Это, бесспорно, крайне важные диагностические показатели, однако, будучи зарегистрированы в покое, они не обеспечивают возможности определения компенсаторных сосудистых резервов, а именно, способности сосудов к расширению и увеличению объемной скорости потока оксигенированной крови для покрытия кислородных запросов органов и тканей при увеличении их функциональной активности.
В обобщенном виде (рис. 4.53) кровеносный сосуд испытывает несколько влияний различной природы, одни из которых определяют его базальный тонус, а другие — направленность его изменений разного рода регуляторными воздействиями, к которым можно отнести следующие [192]:
Перечисленные виды регуляции, одни из которых являются дистанционными, а другие — местными, в сумме формируют изменения гидродинамического сопротивления того или иного отдела сосудистой системы, определяющие скорость и объем кровотока через данный сосудистый бассейн.
Нейрогенный контур регуляции, обладая максимальными скоростными возможностями, способен осуществлять общий циркуляторный гомеостаз организма, обеспечивать независимость органного кровотока при резких системных сдвигах гемодинамики и, наконец, осуществлять перестройку распределения кровотока в экстремальных ситуациях, отдавая приоритет наиболее жизненно важным органам — головному мозгу и сердцу [193].
Отличительной чертой химической (гормонально-метаболической) регуляции является транспортировка вазоактивных веществ кровью, в принципе, одинаково во все отделы сосудистой системы, однако нейромедиаторы действуют лишь в тех сосудах, где имеются соответствующие эфферентные нервные окончания, которые расположены весьма неравномерно даже по ходу артерий одного и того же калибра [192].
Особенностями миогенного контура регуляции являются, во-первых, сравнительно медленное срабатывание гладкомышечной клетки на растягивающее усилие, и, во-вторых, зависимость силы реакции от скорости растяжения мышцы [194]. Миогенный контур может принимать участие в регуляции кровообращения как на системном и органном, так и на тканевом уровнях.
Все виды и контуры регуляции, перестраиваясь по принципам соподчинения и взаимозаменяемости, функционируют для каждого органа, региона и для кровообращения в целом. Причем каждый из перечисленных контуров может выступать на первый план или “оставаться в тени” в зависимости от конкретной естественной или искусственно созданной ситуации.
В нормальных условиях сопротивление коронарных артерий регулируется преимущественно интрамуральными резистивными сосудами. При атеросклерозе, вследствие снижения эластичности, коронарные артерии утрачивают способность к адекватному расширению в ответ на увеличение потребности миокарда в кислороде. Кроме того, пропорционально протяженности стеноза, увеличивается площадь поврежденного эндотелия, синтезирующего эндотелийзависимый релаксирующий фактор. Деэндотелизация, во-первых, снижает дилатационный потенциал коронарных сосудов и делает гладкомышечные клетки более доступными для циркулирующих в крови веществ, оказывающих констриктор- ное действие, во-вторых, служит дополнительным препятствием кро-
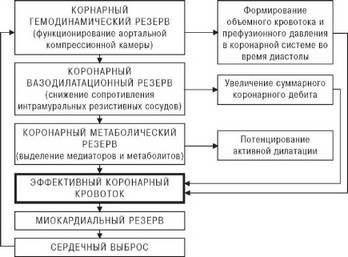
Рис. 4.56. Схема взаимосвязей механизмов компенсации коронарного кровообращения.
вотоку и, в-третьих, создает условия для агрегации тромбоцитов и тром- бообразования [195].
По мере прогрессирования стенозирующего атеросклероза, в крупных эпикардиальных артериях возникают дополнительные участки повышенного сопротивления, что приводит к неравномерному распределению кровотока в миокарде с изменением роли резистивных сосудов. При этом симпатическая стимуляция альфа-2-адренорецепторов в по- стстенотической зоне в процессе нагрузки может привести к вазокон- стрикции и вызвать ишемию миокарда [196].
Все изложенное свидетельствует об особом значении точной оценки действительной степени стенозирования коронарных артерий для определения стратегии и тактики лечения больного ИБС.
Согласно закону J.Poiseuille (цит. по [197]), сосудистое сопротивление определяется по формуле:
R = (8 х п х l) : п r 4, где R — сопротивление; r — радиус сечения сосуда; l — длина суженного участка; п — вязкость крови, являющаяся практически постоянной ве
личиной.
Отсюда следует зависимость сопротивления от величины просвета сосуда, которая обратно пропорциональна четвертой степени его радиуса. При сужении сосуда до половины его диаметра сопротивление увеличивается в 16 раз, и поэтому незначительная ошибка в оценке степени сужения означает большую ошибку в оценке кровотока на суженном участке артерии. Примерная разница сосудистого сопротивления между фрагментами суженными на 50 и 70%, является почти 8-кратной, между сужениями на 70 и 80% — 5-кратной, между сужениями на 70 и 90% - 80-крат-ной [198].
Коронарный резерв.
В связи с изложенными данными среди вопросов патофизиологии ИБС значительное место занимает концепция “коронарного резерва” как физиологического показателя тяжести стеноза. Несмотря на частое упоминание в литературе, среди исследователей нет единодушия относительно патофизиологического смысла этого термина.
Под коронарным резервом понимают:
 Кроме того, выделяют абсолютный коронарный резерв — отношение максимально достижимого коронарного кровотока (обычно под действием вазодилататоров) к исходному кровотоку, и относительный коронарный резерв — отношение максимально достижимого коронарного кровотока при наличии стеноза к максимальному кровотоку в отсутствие стеноза [203].
Кроме того, выделяют абсолютный коронарный резерв — отношение максимально достижимого коронарного кровотока (обычно под действием вазодилататоров) к исходному кровотоку, и относительный коронарный резерв — отношение максимально достижимого коронарного кровотока при наличии стеноза к максимальному кровотоку в отсутствие стеноза [203].
Меняющееся сопротивление венечных артерий позволяет в физиологических условиях в любое время согласовать объемный кровоток с кислородными потребностями миокарда. Эта биологическая адаптация допускает увеличение коронарного кровотока на 300-500% от величины покоя [202]. Но так как у здоровых людей даже усиленная физическая работа вызывает увеличение потребности
элемент.
миокарда в кровоснабжении лишь на 200-300%, то остается абсолютный коронарный резерв, который предохраняет сердце от недостатка кислорода и питательных веществ [199].
Точное измерение коронарного резерва в клинической практике представляет собой сложную задачу (рис. 4.54). Количественная коронарная ангиография, давая представление о геометрии сосудов, не позволяет оценить их функциональные характеристики. Сочетание ангиографии с высокочастотной допплеровской эхографией значительно расширяет диагностические возможности и обеспечивает более точную оценку значения коронарного стеноза. Измерения коронарного резерва расширяют исследовательские возможности при коронарной патологии (изучение вопросов нейрогуморальной регуляции, механизма действия лекарственных средств, роли факторов риска и пр.) [204].
При использовании цифровой вычитательной коронарной ангиографии и геометрических уравнений было установлено, что в интактных артериях после интракоронарного введения раствора папаверина коронарный резерв составлял 5,0+0,8 мл/с, тогда как при сужении сосуда он был снижен до 3,9-0,5 мл/с в зависимости от степени стенозирования артерии [205].
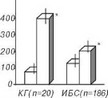
В другом исследовании [201] с помощью аргонового газохромато-гра- фического метода был изучен коронарный резерв у больных ИБС и 20 лиц с интактными артериями (контрольная группа) во время пробы с дипиридамолом. Было показано (рис. 4.55), что использованный метод оказался вполне адекватным в оценке коронарного резерва, который у больных был резко снижен, что проявлялось в недостаточном приросте коронарного кровотока при вазодилатации, вызванной внутривенным введением дипиридамола.
Анализируя зарубежную литературу, можно заметить, что для оценки абсолютного и относительного коронарного резерва в условиях клиники используются инвазивные методы исследования. Они позволяют с высокой точностью определять скорость кровотока в отдельно взятой коронарной артерии [206] или коронарном синусе, в том числе при эн- докардиальной электрокардио-стимуляции [207] и введении сосудорасширяющих препаратов интракоронарно, либо в периферическую вену.
Однако эти методы вызывают обоснованную критику в связи с тем, что при оценке коронарного резерва, во-первых, трудно поддерживать постоянное перфузионное давление; во-вторых, невозможно оценить исходную величину коронарного кровотока; в-третьих, трудно определить, достигнуто ли максимальное расширение коронарных артерий [202].
В связи с этим вызывает большой интерес возможность изучения резерва миокардиальной перфузии по данным сцинтиграфии миокарда с 201Tl последовательно в покое и во время пробы с дипиридамолом. Со
гласно этим исследованиям, прирост индекса захвата таллия миокардом, отражающего миокардиальную фракцию сердечного выброса и резерв перфузии в ответ на вазодилатацию, был наибольшим при стенозе одной коронарной артерии и менее выраженным — при стенозах двух артерий. У больных с поражением трех магистральных коронарных артерий и ствола левой коронарной артерии отмечалось парадоксальное снижение таллия в ответ на введение дипиридамола, что отражало своеобразный “феномен обкрадывания” миокарда в целом. Оценка локальных и глобальных показателей перфузии, по мнению авторов, повышает чувствительность и специфичность сцинтиграфии в выявлении нарушений коронарного кровообращения и позволяет количественно оценивать его функциональные резервы [208].
В повседневной клинической практике для косвенной оценки коронарного резерва наиболее адекватными считаются тесты с дозированной физической нагрузкой, предсердная стимуляция, фармакологические пробы с введением лекарственных средств, повышающих потребность миокарда в кислороде либо обладающих способностью вызывать дилатацию коронарных артерий [199].
Не лишен интереса способ полуколичественной оценки коронарного резерва с помощью ЧПЭС, предложенный А.В.Покровским с соавт. [209]. При этом критерием определения коронарного резерва служила пороговая ЧСС: появление электрокардиографических признаков ишемии миокарда при частоте стимуляции 100 имп/мин резерв расценивали как крайне низкий, 120 имп/мин — как низкий, 140 имп/мин — как средний и
170 имп/мин — как высокий резерв коронарного кровообращения.
Вместе с тем с сожалением приходится констатировать факт отсутствия в настоящее время доступных методов точной количественной идентификации коронарного резерва у больных ИБС. Надо особенно подчеркнуть, что существующие методы, основанные на анализе изменений ЭКГ или динамике распределения продуктов метаболизма молочной кислоты в мио-карде при различных нагрузках, дают возможность определить лишь момент, когда емкость резерва коронарного кровообращения истощается [200].
Однако сложность проблемы изучения венечного кровотока определяется решением не только методических и технических вопросов. Адекватное коронарное кровообращение в каждой конкретной ситуации обеспечивается функциональной системой тесно взаимосвязанных и друг друга дополняющих компенсаторных механизмов. Предлагаемая нами схема (рис. 4.56) является попыткой отразить концепцию взаимодействия резервов коронарного кровотока: гемодинамического, сосудистого и метаболического, мобилизация которых направлена на поддержание эффективной коронарной гемодинамики и полную реализа
цию сократительной функ-ции миокарда. Из схемы видно, что активация инотропного состояния сердца и увеличение сердечного выброса существенно дополняют резерв-ные возможности коронарной сосудистой сети в увеличении объемного кровотока в условиях срочной гемо- динамической перестройки.
Говоря о коронарном кровообращении и функции сердца, надо заметить, что, с точки зрения прогноза ИБС, нарушения сократимости миокарда левого желудочка имеют гораздо большее значение, чем рас- прост-раненность и локализация коронарного атеросклероза [202]. В ряде исследований показано, что выраженность стенозирующих поражений коронарных артерий ухудшает прогноз заболевания только в случае комбинации с признаками левожелудочковой недостаточности [210,211].
Здесь возникает другая, не менее сложная для изучения, проблема функ-циональной связи коронарного и миокардиального резервов.
Миокардиальный резерв.
Под миокардиальным резервом понимают возможность сердечной мышцы усиливать свою работу в ответ на повышение требований к аппарату кровообращения. Такая ситуация может возникать, например, при физических и эмоциональных нагрузках, при введении в организм лекарственных веществ, увеличивающих ЧСС и потребность миокарда в кислороде или обладающих отрицательным инотропным действием [199,200]. У человека миокардиальный резерв уменьшается по мере ослабления сократительной функции сердца.
Современное понимание механики сократительной активности сердечной мышцы, в первую очередь, основано на работах А.Хилла [212], по данным которого, наиболее важным свойством мышцы является обратное соотношение между нагрузкой на мышцу и скоростью ее сокращения. Механическая модель сердечной мышцы для описания физиологии сокращения, предложенная А.Хиллом, включает три элемента (рис. 4.57):
Первоначальная длина мышцы в покое или в неактивизированных условиях определяется небольшой нагрузкой — так называемой пред- нагрузкой (preload). В здоровом сердце преднагрузка находится в прямой зависимости от конечного диастолического давления в левом (или правом) желудочке; длина мышцы остается постоянной. При активации мышцы ее длина уменьшается, преодолевая увеличивающуюся на
грузку (постнагрузку, afterload), в неповрежденном сердце постнагрузка соответствует аортальному давлению. В изолированной сердечной мышце мощность сокращения увеличивается до тех пор, пока она не будет соответствовать постнагрузке, затем происходит изотоническое сокращение со скоростью, зависящей от вели-чины нагрузки и состояния контрактиль- ности (инотропизма) миокарда [213].
Гемодинамические изменения при физической нагрузке по своему конечному значению представляют собой системную функциональную гиперемию с преимущественной ориентацией на скелетные мышцы и миокард. Именно на это направлены компенсирующие и координирующие механизмы перераспределения регионарного сосудистого тонуса и изменений сердечной деятельности [8-11].
При интенсивной физической нагрузке происходят одновременно массивная вазодилатация в работающих мышцах и повышение среднего АД для поддержания уровня перфузии и кровотока через работающие мышцы, адекватно их возросшему метаболизму.
Увеличение утилизации кислорода при этом достигается, в основном, тремя путями: 1) увеличением МОК за счет учащения пульса и более динамического опорожнения желудочков; 2) перераспределением объема циркулирующей крови; 3) увеличением экстракции кислорода тканями [214].
При любых сдвигах системной гемодинамики и стрессовых ситуациях зависимость кислородного снабжения клеток от местного кровотока выступает на первый план, и срочная вазодилатация является здесь основным адекватным механизмом компенсации дефицита кислорода в работающих мышцах.
Как известно, кровоснабжение миокарда, кроме прочих факторов, зависит от уровня давления в восходящем отделе аорты (см. раздел 2.1). Однако при нагрузке увеличение аортального давления ведет не только к повышению коронарного перфузионного давления, но и увеличивает пост-нагрузку на левый желудочек. Это существенно поднимает энергетическую стоимость кровоснабжения миокарда, так как параллельно усиливается метаболизм и потребление кислорода [25].
Большого внимания заслуживает феномен усиления сократительной активности миокарда при увеличении коронарного кровотока. Правда, это увеличение не пропорционально приросту последнего: при повышении коронарного перфузионного давления вдвое сократимость возрастает лишь на 15% [215].
Предложено два объяснения положительного инотропного эффекта при увеличении коронарного перфузионного давления. Первое из них основано на так называемом феномене Грегга [216], состоящем в том, что увеличение коронарной перфузии ведет к увеличению поглощения кислорода миокардом и соответствующему усилению сердечных сокра
щений. Второе объяснение состоит в том, что с увеличением перфузи- онного давления в коронарной системе растет трансмуральное давление в артериях, которые, растягиваясь сами, растягивают близлежащие миокардиальные волокна, а растяжение миокардиальных волокон (в соответствии с законом Франка-Старлинга [197,200,213]) ведет к усилению сокращения. Этот механизм получил образное название “эффекта садового шланга” [217].
В реальных условиях оба описанных механизма повышения инот- ропной функции сердца, по-видимому, имеют место. Они же способствуют увеличенной доставке кислорода и могут лежать в основе так называемого феномена Анрепа (Г.В.Анреп,1912), который обнаружил, что быстрое повышение аортального давления ведет к положительному инотропному действию, проявлявшемуся в уменьшении диастолического объема сердца (цит. по [214]).
Конечно, не следует полагать, что изменения коронарного кровотока являются единственным или основным способом регуляции сокра- тимо-сти миокарда и внешней производительности сердца. Вместе с тем этот механизм, координирующий коронарный и миокардиальный резервы, несомненно, должен учитываться в комплексе срочных гемоди- намических перестроек у больных ИБС, в частности, при физической нагрузке [12].
Ограничение коронарного кровотока, ведущее к ишемии и гипоксии соответствующего участка миокарда, несомненно, сопровождается снижением сократимости ишемизированной зоны. При этом постепенное понижение коронарного перфузионного давления вызывает пропорциональное снижение силы сердечных сокращений [218].
При транзиторной ишемии миокарда и нарушении его сократимости включаются компенсаторные механизмы, препятствующие развитию сердечной недостаточности. К ним относятся: 1) активация симпати- ко-адреналовой системы; 2) гипертрофия миокарда; 3) механизм Франка-Старлинга. Симпатическая активация обеспечивает достаточные метаболические и гемодинамические условия путем акселерации; гипертрофия приводит к уменьшению удельного веса нагрузки на единицу массы сердечной мышцы; благодаря механизму Франка-Старлинга происходит адаптация сокращений к имеющемуся в данный момент состоянию контрактильности сердечной мышцы [2,25,213,219].
Для клиники крайне важно то, что у больных ИБС измерение параметров гемодинамики в покое малоинформативно для количественной оценки функционального состояния даже при хронической сердечной недостаточности [2,219,220]. В то же время в эксперименте установлено, что миокардиальная дисфункция по типу систолического удлинения и постсистолического укорочения отражает универсальный механизм нарушения функции миокарда при несоответствии потребления
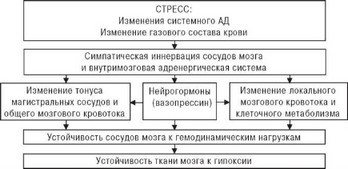
Рис. 4.58. Схема нейрогормонального механизма координации кровоснабжения и метаболизма головного мозга.
кислорода нагрузкам любого генеза, предъявляемым миокарду [93].
В связи с этим диагностический поиск направлен на определение динамики функционального состояния миокарда левого желудочка, так как именно он страдает в первую очередь во время эпизодов ишемии.
Говоря о функции миокарда левого желудочка, следует помнить, что низкая фракция выброса при значительной дилатации полости желудочка подразумевает больший ударный объем, чем в случае низкой фракции выброса и полости желудочка обычных размеров. Поэтому использование показателя фракции выброса для оценки функционального состояния левого желудочка не всегда корректно [202].
Именно по этой причине для оценки систолической функции левого желудочка рекомендуют использовать и другие показатели: сегментарную сократимость, конечный систолический объем. В частности, показано, что именно КСО левого желудочка является основным предиктором выживаемости больных после инфаркта миокарда [221].
При несоответствии между потребностью миокарда в кислороде и его доставкой могут возникать зоны асинергии сегментов левого желудочка, что, на фоне искусственно вызванной ишемии, позволяет определить величину зоны ишемизированного миокарда [95,98,102].
Ишемия может также вызвать ухудшение диастолической функции левого желудочка. При этом нарушается расслабление миокардиального волокна, увеличивается диастолическая жесткость камеры, что приводит к увеличению конечного диастолического давления, а повышение пос-леднего усугубляет ишемию за счет существенного снижения
субэндокардиальной перфузии. Так замыкается порочный круг.
Разные исследователи предлагают различные методы провоцирования ишемии миокарда, однако до настоящего времени нет единой точки зрения на то, какой из этих методов является оптимальным. Наиболее приближена к реальной клинической ситуации, несомненно, ишемия миокарда, спровоцированная пробой с дозированной физической нагрузкой. Единственное ограничение этого метода — технические трудности при динамическом инструментальном исследовании функции сердца. Для более детальных исследований состояния сократительной активности миокарда при ишемии применяют ЧПЭС и фармакологические пробы. Среди последних в настоящее время большое значение придается стресс-эхокардиографии с добутамином, которая в разных модификациях позволяет оценивать как коронарный, так и миокардиальный резервы, и по своим гемодинамическим эффектам более точно воспроизводит физическую нагрузку, чем иные стресс-тесты [95,110,222].
И все же следует иметь в виду, что все нагрузочные пробы не всегда физиологичны, и провоцируемая ишемия может иметь не совсем такой же характер, как при спонтанном приступе.
Во время физической нагрузки возрастание интенсивности обменных процессов требует значительного увеличения потребления кислорода, что, в свою очередь, предъявляет повышенные требования к функциям сердца и дыхательной системы. В связи с этим величина потребления кислорода при физической нагрузке (по данным спироэргомет- рии) представляет собой интегральный показатель аэробной произво- димости и является одним из основных критериев резервных возможностей кардиореспираторной системы. У здоровых людей потребление кислорода при нагрузке увеличивается пропорционально ее мощности и повышению МОК, причем последний является основным фактором, лимитирующим максимальное потребление кислорода [197].
У больных ИБС уровень потребления кислорода при физической нагрузке, как правило, не достигает своего максимального значения в результате снижения коронарного резерва [219].
В зависимости от характера изменений потребления кислорода во время работы выделяют два вида адаптации к физической нагрузке у больных ИБС: 1) повышение потребления кислорода при выполнении работы в устойчивом состоянии (steady state) и, в меньшей степени, в восстановительном периоде; 2) снижение потребления кислорода, по- видимому, за счет использования преимущественно анаэробного пути энергообразования, что приводит к появлению значительного кислородного долга. Первый вид адаптации, хотя и не экономичен с точки зрения энергетических затрат, позволяет больным удовлетворительно переносить большие и средние нагрузки, поэтому характерен для лиц, относящихся к наиболее благоприятным по прогнозу функционально
го состояния сердечно-сосудистой системы [3].
Очень важным показателем, отражающим способность сердечно-сосудистой системы снабжать организм кислородом и уровень протекающих метаболических процессов во время физической нагрузки, является анаэробный порог работы [223]. В физиологическом смысле под этим понимают такой уровень потребления кислорода при возрастающей нагрузке, сверх которого аэробное продуцирование энергии дополняется анаэробным механизмом [3,11,15,30,223]. В ряде исследований [220, 223,224] показано, что анаэробный порог работы является количественным, хорошо воспроизводимым показателем, позволяющим объективно оценить функциональное состояние больных ИБС.
Количественные диагностические критерии коронарного и миокардиального резервов, показатели, характеризующие гемодинамическое и кислородное обеспечение дозированной физической нагрузки у больных ИБС, описаны в предыдущих разделах этой главы.
Цереброваскулярный резерв.
Основные вопросы физиологии и патофизиологии мозгового кровообращения достаточно подробно, как нам кажется, описаны в разделе
Через сосудистую систему мозга для его нормального функционирования должно постоянно протекать около 20% всей циркулирующей в организме крови. Наряду с постоянно высокой метаболической активностью мозг практически не располагает запасами кислорода. Это делает его не только чрезвычайно чувствительным к гипоксии, но и ставит функ-ционирование его структур в прямую зависимость от оптимального режима кровоснабжения.
Согласно современным взглядам, регуляция мозгового кровообращения осуществляется преимущественной констрикцией магистральных сосудов головы и преобладающей дилатацией пиальных артерий [225]. Комбинацией этих реакций обеспечивается стабильность мозгового кровотока при колебаниях системного АД, изменениях газового состава крови и иных возмущающих воздействиях. Так, например, при напряженной умственной работе в стрессорных условиях не только возрастает скорость кровотока в сонных артериях, происходит перераспределение кровотока между различными областями серого вещества головного мозга, но изменяется реактивность сосудов всего бассейна сонных артерий. При этом скорость кровотока во внутренних сонных артериях увеличивается, в глазничных ветвях ВСА уменьшается, реак
тивность анастомозов между ветвями внутренних и наружных сонных артерий резко снижается [225].
Многочисленные экспериментальные исследования с использованием различных возмущающих воздействий (нарушение кровоснабжения мозга, повышение системного АД, избыточный объем крови в сосудах мозга, изменение газового состава крови) показали, что различные части артериальной системы мозга выполняют при этом лишь присущую им функцию. При этом пиальные, расположенные поверхностно, артерии расширяются, регулируя адекватный приток крови в ткань мозга; магист-ральные, сонные и вертебральные суживаются, компенсируя (демпфируя) повышение системного АД или избыточное кровенаполнение сосудов мозга [226].
Из этого становится ясно, что цереброваскулярный резерв, направленный на сохранение адекватного кровоснабжения мозговой ткани в условиях патологии или стресса, включает вазодилататорные и вазокон- стрикторные реакции.
Регуляция тонуса мозговых сосудов осуществляется теми же, описанными выше, нейрогенным, гуморальным и миогенным механизмами. Причем в церебральных гемодинамических реакциях преобладающую роль играет нейрогенный контур регуляции (рис. 4.58), который обладает максимальными скоростными возможностями [193] и координирует все остальные виды регулирования мозгового кровообращения [214]. По теории D.Heistad [227], симпатическое раздражение вызывает сужение мозговых магистральных артерий; это приводит к ауторегуляторному (рефлекторному) расширению дистальнее расположенных артерий меньшего калибра, вследствие чего суммарный кровоток меняется незначительно.
Наряду с этим миогенный контур регуляции обеспечивает: а) постоянство мозгового кровотока при изменениях системного АД; б) устранение избыточного объема крови в сосудах мозга. Гуморальный контур контролирует: а) адекватность кровоснабжения мозга; б) нормальное содержание в ткани мозга кислорода и углекислого газа [226].
Под патологической реакцией мозговых артерий подразумевается такое функциональное поведение этих сосудов в виде патологической кон- стрикции (ангиоспазма) или патологической дилатации, которое не обеспечивает регулирования кровотока, а ведет к его нарушениям.
Патологическая вазоконстрикция может приводить (в случае недостаточного коллатерального кровотока) к дефициту кровоснабжения соответствующих областей мозга, а патологическая вазодилатация приводит к избыточной перфузии мозговой ткани.
К патологическим реакциям мозговых артерий можно отнести также их извращенные (инвертированные) реакции, которые означают патологическую констрикцию вместо дилатации, или наоборот, что зна
чительно нарушает регулирование мозгового кровообращения и всегда способст-вует его расстройствам [214,226].
Нарушение цереброваскулярного резерва означает срыв механизмов регуляции мозгового сосудистого тонуса, который может наступать при острой системной гипертензии, гиперкапнии, ишемии, мозговой травме и при других патологических состояниях.
Внешним проявлением паралича регуляторных механизмов является пассивность мозгового кровотока на фоне колебаний перфузионно- го давления. В основе срыва регуляции лежит метаболически измененная (иногда даже извращенная) реактивность гладких мышц сосудов. Вследствие этого в ишемизированных зонах мозга при действии сосудорасширяющих агентов (особенно СО2) наблюдается патологический “синдром обкрадывания”, при котором из ишемического очага проис-
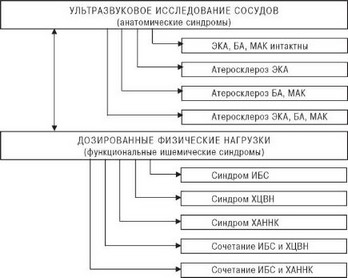
Рис. 4.59. Наиболее часто встречающиеся синдромы в клинике атеросклероза: БА - брюшная аорта; МАК - магистральные артерии конечностей; ХАННК - хроническая артериальная недостаточность нижних конечностей; ЭКА - экстракраниальные артерии. Пояснения в тексте.
ходит еще больший отток крови в неповрежденные участки мозга, где наступила вазодилатация.
Извращенная реакция сосудов ишемизированной зоны на гипокап- нию, наоборот, ведет к появлению феномена “обратного обкрадывания” (синдром Робина Гуда), когда кровь из непораженных участков, где наступила вазоконстрикция, оттекает в сосуды патологического очага [214].
В последнее время получены данные о том, что патологический вазоспазм — это скорее патология эндотелия, выражающаяся в его длительном набухании, а не состояние длительного сокращения гладкомышечных волокон медии. Сосуды с поврежденным эндотелием, в частности, атеросклеротически измененные сонные артерии, обладают склонностью к спазмам и меняют (извращают) свою реактивность к ряду агентов, в том числе, в нормальных условиях обладающих сосудорасширяющим действием [228].
Возникающее при спазме повреждение эндотелия ведет к нарушению синтеза из арахидоновой кислоты простациклина, расширяющего сосуды ( в том числе мозговые артерии). К другим гуморальным посредникам ангиоспазма относят синтезируемый также из арахидоновой кислоты в тромбоцитах тромбоксан, и ангиотензин II, серотонин [229,230].
Развитие ангиохирургии и широкое распространение операций по поводу стенозов и тромбозов внутренних сонных артерий остро поставили вопрос о необходимости разработки научно обоснованных показаний к проведению подобных оперативных вмешательств. До после-
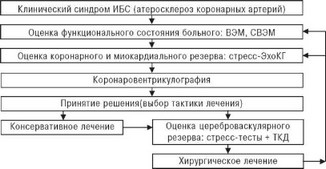
Рис. 4.60. Алгоритм обследования больных ИБС без сопутствующих ХЦВН и ОААНК. Пояснения в тексте.
днего времени показания к ангиохирургическому лечению базируются преимущественно на клинико-ангиографических данных без учета индивидуальных функциональных особенностей мозгового кровообращения.
Внедрение в клиническую практику транскраниальной допплерографии (ТКД) позволило глубоко изучить особенности гемодинамики на интракраниальном уровне и с качественно новых позиций оценить влияние окклюзирующих поражений сонных артерий на состояние кровотока в интракраниальных артериях.
Поскольку хирургическая коррекция мозгового кровотока направлена прежде всего на профилактику ишемических нарушений мозгового кровообращения, при решении вопроса об операции необходимо оценить риск развития ишемии мозга у каждого конкретного больного. Необходимо выявление больных со сниженной способностью к увеличению мозгового кровотока, то есть больных, у которых нарушен цереброваскулярный резерв [231].
Для оценки индивидуального функционального состояния цереброваскулярного резерва, то есть сохранности адекватных вазоконстрик- торных и вазодилататорных реакций мозговых сосудов, применяют ряд функционально-физиологических нагрузок, которые воздействуют на различные механизмы регуляции тонуса артерий мозга [232]. С этой целью используются ортостатическая, антиортостатическая, нитроглицериновая, гипоксическая, гиперкапническая, гипервентиляционная и
Клинический синдром ХЦВН (атеросклероз ЭКА)
В обобщенном виде (рис. 4.53) кровеносный сосуд испытывает несколько влияний различной природы, одни из которых определяют его базальный тонус, а другие — направленность его изменений разного рода регуляторными воздействиями, к которым можно отнести следующие [192]:
-
 Нейрогенные влияния, способные как повышать, так и понижать сосудистый тонус.
Нейрогенные влияния, способные как повышать, так и понижать сосудистый тонус. - Химические влияния: а) факторы, действующие снаружи на сосуд и представляющие собой, в основном, тканевые метаболиты (метаболическая регуляция); б) факторы, находящиеся в циркулирующей крови (гормональная регуляция).
- Механические влияния, например, растяжение сосуда под действием изменений трансмурального давления. Активные ответы являются при этом свойством расположенных в сосудистой стенке гладкомышечных элементов (мио- генная регуляция), которые со
кращаются при повышении давления в сосуде и расслабляются при понижении трансмурального давления (феномен Остроумова-Бейлисса).
Перечисленные виды регуляции, одни из которых являются дистанционными, а другие — местными, в сумме формируют изменения гидродинамического сопротивления того или иного отдела сосудистой системы, определяющие скорость и объем кровотока через данный сосудистый бассейн.
Нейрогенный контур регуляции, обладая максимальными скоростными возможностями, способен осуществлять общий циркуляторный гомеостаз организма, обеспечивать независимость органного кровотока при резких системных сдвигах гемодинамики и, наконец, осуществлять перестройку распределения кровотока в экстремальных ситуациях, отдавая приоритет наиболее жизненно важным органам — головному мозгу и сердцу [193].
Отличительной чертой химической (гормонально-метаболической) регуляции является транспортировка вазоактивных веществ кровью, в принципе, одинаково во все отделы сосудистой системы, однако нейромедиаторы действуют лишь в тех сосудах, где имеются соответствующие эфферентные нервные окончания, которые расположены весьма неравномерно даже по ходу артерий одного и того же калибра [192].
Особенностями миогенного контура регуляции являются, во-первых, сравнительно медленное срабатывание гладкомышечной клетки на растягивающее усилие, и, во-вторых, зависимость силы реакции от скорости растяжения мышцы [194]. Миогенный контур может принимать участие в регуляции кровообращения как на системном и органном, так и на тканевом уровнях.
Все виды и контуры регуляции, перестраиваясь по принципам соподчинения и взаимозаменяемости, функционируют для каждого органа, региона и для кровообращения в целом. Причем каждый из перечисленных контуров может выступать на первый план или “оставаться в тени” в зависимости от конкретной естественной или искусственно созданной ситуации.
В нормальных условиях сопротивление коронарных артерий регулируется преимущественно интрамуральными резистивными сосудами. При атеросклерозе, вследствие снижения эластичности, коронарные артерии утрачивают способность к адекватному расширению в ответ на увеличение потребности миокарда в кислороде. Кроме того, пропорционально протяженности стеноза, увеличивается площадь поврежденного эндотелия, синтезирующего эндотелийзависимый релаксирующий фактор. Деэндотелизация, во-первых, снижает дилатационный потенциал коронарных сосудов и делает гладкомышечные клетки более доступными для циркулирующих в крови веществ, оказывающих констриктор- ное действие, во-вторых, служит дополнительным препятствием кро-

Рис. 4.56. Схема взаимосвязей механизмов компенсации коронарного кровообращения.
вотоку и, в-третьих, создает условия для агрегации тромбоцитов и тром- бообразования [195].
По мере прогрессирования стенозирующего атеросклероза, в крупных эпикардиальных артериях возникают дополнительные участки повышенного сопротивления, что приводит к неравномерному распределению кровотока в миокарде с изменением роли резистивных сосудов. При этом симпатическая стимуляция альфа-2-адренорецепторов в по- стстенотической зоне в процессе нагрузки может привести к вазокон- стрикции и вызвать ишемию миокарда [196].
Все изложенное свидетельствует об особом значении точной оценки действительной степени стенозирования коронарных артерий для определения стратегии и тактики лечения больного ИБС.
Согласно закону J.Poiseuille (цит. по [197]), сосудистое сопротивление определяется по формуле:
R = (8 х п х l) : п r 4, где R — сопротивление; r — радиус сечения сосуда; l — длина суженного участка; п — вязкость крови, являющаяся практически постоянной ве
личиной.
Отсюда следует зависимость сопротивления от величины просвета сосуда, которая обратно пропорциональна четвертой степени его радиуса. При сужении сосуда до половины его диаметра сопротивление увеличивается в 16 раз, и поэтому незначительная ошибка в оценке степени сужения означает большую ошибку в оценке кровотока на суженном участке артерии. Примерная разница сосудистого сопротивления между фрагментами суженными на 50 и 70%, является почти 8-кратной, между сужениями на 70 и 80% — 5-кратной, между сужениями на 70 и 90% - 80-крат-ной [198].
Коронарный резерв.
В связи с изложенными данными среди вопросов патофизиологии ИБС значительное место занимает концепция “коронарного резерва” как физиологического показателя тяжести стеноза. Несмотря на частое упоминание в литературе, среди исследователей нет единодушия относительно патофизиологического смысла этого термина.
Под коронарным резервом понимают:
- способность коронарной сосудистой сети увеличивать кровоток адекватно потребности миокарда в данном конкретном случае [199,200];
- отношение коронарного сопротивления в условиях покоя к уровню сопротивления при максимально возможной вазодилатации [201];
- степень увеличения объемной скорости коронарного кровотока при неизменном перфузионном давлении и максимальном расширении коронарных сосудов [202].
 Кроме того, выделяют абсолютный коронарный резерв — отношение максимально достижимого коронарного кровотока (обычно под действием вазодилататоров) к исходному кровотоку, и относительный коронарный резерв — отношение максимально достижимого коронарного кровотока при наличии стеноза к максимальному кровотоку в отсутствие стеноза [203].
Кроме того, выделяют абсолютный коронарный резерв — отношение максимально достижимого коронарного кровотока (обычно под действием вазодилататоров) к исходному кровотоку, и относительный коронарный резерв — отношение максимально достижимого коронарного кровотока при наличии стеноза к максимальному кровотоку в отсутствие стеноза [203].
Меняющееся сопротивление венечных артерий позволяет в физиологических условиях в любое время согласовать объемный кровоток с кислородными потребностями миокарда. Эта биологическая адаптация допускает увеличение коронарного кровотока на 300-500% от величины покоя [202]. Но так как у здоровых людей даже усиленная физическая работа вызывает увеличение потребности
элемент.
миокарда в кровоснабжении лишь на 200-300%, то остается абсолютный коронарный резерв, который предохраняет сердце от недостатка кислорода и питательных веществ [199].
Точное измерение коронарного резерва в клинической практике представляет собой сложную задачу (рис. 4.54). Количественная коронарная ангиография, давая представление о геометрии сосудов, не позволяет оценить их функциональные характеристики. Сочетание ангиографии с высокочастотной допплеровской эхографией значительно расширяет диагностические возможности и обеспечивает более точную оценку значения коронарного стеноза. Измерения коронарного резерва расширяют исследовательские возможности при коронарной патологии (изучение вопросов нейрогуморальной регуляции, механизма действия лекарственных средств, роли факторов риска и пр.) [204].
При использовании цифровой вычитательной коронарной ангиографии и геометрических уравнений было установлено, что в интактных артериях после интракоронарного введения раствора папаверина коронарный резерв составлял 5,0+0,8 мл/с, тогда как при сужении сосуда он был снижен до 3,9-0,5 мл/с в зависимости от степени стенозирования артерии [205].
В другом исследовании [201] с помощью аргонового газохромато-гра- фического метода был изучен коронарный резерв у больных ИБС и 20 лиц с интактными артериями (контрольная группа) во время пробы с дипиридамолом. Было показано (рис. 4.55), что использованный метод оказался вполне адекватным в оценке коронарного резерва, который у больных был резко снижен, что проявлялось в недостаточном приросте коронарного кровотока при вазодилатации, вызванной внутривенным введением дипиридамола.
Анализируя зарубежную литературу, можно заметить, что для оценки абсолютного и относительного коронарного резерва в условиях клиники используются инвазивные методы исследования. Они позволяют с высокой точностью определять скорость кровотока в отдельно взятой коронарной артерии [206] или коронарном синусе, в том числе при эн- докардиальной электрокардио-стимуляции [207] и введении сосудорасширяющих препаратов интракоронарно, либо в периферическую вену.
Однако эти методы вызывают обоснованную критику в связи с тем, что при оценке коронарного резерва, во-первых, трудно поддерживать постоянное перфузионное давление; во-вторых, невозможно оценить исходную величину коронарного кровотока; в-третьих, трудно определить, достигнуто ли максимальное расширение коронарных артерий [202].
В связи с этим вызывает большой интерес возможность изучения резерва миокардиальной перфузии по данным сцинтиграфии миокарда с 201Tl последовательно в покое и во время пробы с дипиридамолом. Со
гласно этим исследованиям, прирост индекса захвата таллия миокардом, отражающего миокардиальную фракцию сердечного выброса и резерв перфузии в ответ на вазодилатацию, был наибольшим при стенозе одной коронарной артерии и менее выраженным — при стенозах двух артерий. У больных с поражением трех магистральных коронарных артерий и ствола левой коронарной артерии отмечалось парадоксальное снижение таллия в ответ на введение дипиридамола, что отражало своеобразный “феномен обкрадывания” миокарда в целом. Оценка локальных и глобальных показателей перфузии, по мнению авторов, повышает чувствительность и специфичность сцинтиграфии в выявлении нарушений коронарного кровообращения и позволяет количественно оценивать его функциональные резервы [208].
В повседневной клинической практике для косвенной оценки коронарного резерва наиболее адекватными считаются тесты с дозированной физической нагрузкой, предсердная стимуляция, фармакологические пробы с введением лекарственных средств, повышающих потребность миокарда в кислороде либо обладающих способностью вызывать дилатацию коронарных артерий [199].
Не лишен интереса способ полуколичественной оценки коронарного резерва с помощью ЧПЭС, предложенный А.В.Покровским с соавт. [209]. При этом критерием определения коронарного резерва служила пороговая ЧСС: появление электрокардиографических признаков ишемии миокарда при частоте стимуляции 100 имп/мин резерв расценивали как крайне низкий, 120 имп/мин — как низкий, 140 имп/мин — как средний и
170 имп/мин — как высокий резерв коронарного кровообращения.
Вместе с тем с сожалением приходится констатировать факт отсутствия в настоящее время доступных методов точной количественной идентификации коронарного резерва у больных ИБС. Надо особенно подчеркнуть, что существующие методы, основанные на анализе изменений ЭКГ или динамике распределения продуктов метаболизма молочной кислоты в мио-карде при различных нагрузках, дают возможность определить лишь момент, когда емкость резерва коронарного кровообращения истощается [200].
Однако сложность проблемы изучения венечного кровотока определяется решением не только методических и технических вопросов. Адекватное коронарное кровообращение в каждой конкретной ситуации обеспечивается функциональной системой тесно взаимосвязанных и друг друга дополняющих компенсаторных механизмов. Предлагаемая нами схема (рис. 4.56) является попыткой отразить концепцию взаимодействия резервов коронарного кровотока: гемодинамического, сосудистого и метаболического, мобилизация которых направлена на поддержание эффективной коронарной гемодинамики и полную реализа
цию сократительной функ-ции миокарда. Из схемы видно, что активация инотропного состояния сердца и увеличение сердечного выброса существенно дополняют резерв-ные возможности коронарной сосудистой сети в увеличении объемного кровотока в условиях срочной гемо- динамической перестройки.
Говоря о коронарном кровообращении и функции сердца, надо заметить, что, с точки зрения прогноза ИБС, нарушения сократимости миокарда левого желудочка имеют гораздо большее значение, чем рас- прост-раненность и локализация коронарного атеросклероза [202]. В ряде исследований показано, что выраженность стенозирующих поражений коронарных артерий ухудшает прогноз заболевания только в случае комбинации с признаками левожелудочковой недостаточности [210,211].
Здесь возникает другая, не менее сложная для изучения, проблема функ-циональной связи коронарного и миокардиального резервов.
Миокардиальный резерв.
Под миокардиальным резервом понимают возможность сердечной мышцы усиливать свою работу в ответ на повышение требований к аппарату кровообращения. Такая ситуация может возникать, например, при физических и эмоциональных нагрузках, при введении в организм лекарственных веществ, увеличивающих ЧСС и потребность миокарда в кислороде или обладающих отрицательным инотропным действием [199,200]. У человека миокардиальный резерв уменьшается по мере ослабления сократительной функции сердца.
Современное понимание механики сократительной активности сердечной мышцы, в первую очередь, основано на работах А.Хилла [212], по данным которого, наиболее важным свойством мышцы является обратное соотношение между нагрузкой на мышцу и скоростью ее сокращения. Механическая модель сердечной мышцы для описания физиологии сокращения, предложенная А.Хиллом, включает три элемента (рис. 4.57):
- контрактильный элемент, который легко растяжим в покое, может развивать силу и укорачиваться при нагрузке;
- пассивный эластичный элемент, расположенный последовательно с контрактильным элементом;
- параллельный эластичный элемент, который сохраняет в состоянии покоя ту же длину, что и контрактильный элемент.
Первоначальная длина мышцы в покое или в неактивизированных условиях определяется небольшой нагрузкой — так называемой пред- нагрузкой (preload). В здоровом сердце преднагрузка находится в прямой зависимости от конечного диастолического давления в левом (или правом) желудочке; длина мышцы остается постоянной. При активации мышцы ее длина уменьшается, преодолевая увеличивающуюся на
грузку (постнагрузку, afterload), в неповрежденном сердце постнагрузка соответствует аортальному давлению. В изолированной сердечной мышце мощность сокращения увеличивается до тех пор, пока она не будет соответствовать постнагрузке, затем происходит изотоническое сокращение со скоростью, зависящей от вели-чины нагрузки и состояния контрактиль- ности (инотропизма) миокарда [213].
Гемодинамические изменения при физической нагрузке по своему конечному значению представляют собой системную функциональную гиперемию с преимущественной ориентацией на скелетные мышцы и миокард. Именно на это направлены компенсирующие и координирующие механизмы перераспределения регионарного сосудистого тонуса и изменений сердечной деятельности [8-11].
При интенсивной физической нагрузке происходят одновременно массивная вазодилатация в работающих мышцах и повышение среднего АД для поддержания уровня перфузии и кровотока через работающие мышцы, адекватно их возросшему метаболизму.
Увеличение утилизации кислорода при этом достигается, в основном, тремя путями: 1) увеличением МОК за счет учащения пульса и более динамического опорожнения желудочков; 2) перераспределением объема циркулирующей крови; 3) увеличением экстракции кислорода тканями [214].
При любых сдвигах системной гемодинамики и стрессовых ситуациях зависимость кислородного снабжения клеток от местного кровотока выступает на первый план, и срочная вазодилатация является здесь основным адекватным механизмом компенсации дефицита кислорода в работающих мышцах.
Как известно, кровоснабжение миокарда, кроме прочих факторов, зависит от уровня давления в восходящем отделе аорты (см. раздел 2.1). Однако при нагрузке увеличение аортального давления ведет не только к повышению коронарного перфузионного давления, но и увеличивает пост-нагрузку на левый желудочек. Это существенно поднимает энергетическую стоимость кровоснабжения миокарда, так как параллельно усиливается метаболизм и потребление кислорода [25].
Большого внимания заслуживает феномен усиления сократительной активности миокарда при увеличении коронарного кровотока. Правда, это увеличение не пропорционально приросту последнего: при повышении коронарного перфузионного давления вдвое сократимость возрастает лишь на 15% [215].
Предложено два объяснения положительного инотропного эффекта при увеличении коронарного перфузионного давления. Первое из них основано на так называемом феномене Грегга [216], состоящем в том, что увеличение коронарной перфузии ведет к увеличению поглощения кислорода миокардом и соответствующему усилению сердечных сокра
щений. Второе объяснение состоит в том, что с увеличением перфузи- онного давления в коронарной системе растет трансмуральное давление в артериях, которые, растягиваясь сами, растягивают близлежащие миокардиальные волокна, а растяжение миокардиальных волокон (в соответствии с законом Франка-Старлинга [197,200,213]) ведет к усилению сокращения. Этот механизм получил образное название “эффекта садового шланга” [217].
В реальных условиях оба описанных механизма повышения инот- ропной функции сердца, по-видимому, имеют место. Они же способствуют увеличенной доставке кислорода и могут лежать в основе так называемого феномена Анрепа (Г.В.Анреп,1912), который обнаружил, что быстрое повышение аортального давления ведет к положительному инотропному действию, проявлявшемуся в уменьшении диастолического объема сердца (цит. по [214]).
Конечно, не следует полагать, что изменения коронарного кровотока являются единственным или основным способом регуляции сокра- тимо-сти миокарда и внешней производительности сердца. Вместе с тем этот механизм, координирующий коронарный и миокардиальный резервы, несомненно, должен учитываться в комплексе срочных гемоди- намических перестроек у больных ИБС, в частности, при физической нагрузке [12].
Ограничение коронарного кровотока, ведущее к ишемии и гипоксии соответствующего участка миокарда, несомненно, сопровождается снижением сократимости ишемизированной зоны. При этом постепенное понижение коронарного перфузионного давления вызывает пропорциональное снижение силы сердечных сокращений [218].
При транзиторной ишемии миокарда и нарушении его сократимости включаются компенсаторные механизмы, препятствующие развитию сердечной недостаточности. К ним относятся: 1) активация симпати- ко-адреналовой системы; 2) гипертрофия миокарда; 3) механизм Франка-Старлинга. Симпатическая активация обеспечивает достаточные метаболические и гемодинамические условия путем акселерации; гипертрофия приводит к уменьшению удельного веса нагрузки на единицу массы сердечной мышцы; благодаря механизму Франка-Старлинга происходит адаптация сокращений к имеющемуся в данный момент состоянию контрактильности сердечной мышцы [2,25,213,219].
Для клиники крайне важно то, что у больных ИБС измерение параметров гемодинамики в покое малоинформативно для количественной оценки функционального состояния даже при хронической сердечной недостаточности [2,219,220]. В то же время в эксперименте установлено, что миокардиальная дисфункция по типу систолического удлинения и постсистолического укорочения отражает универсальный механизм нарушения функции миокарда при несоответствии потребления

Рис. 4.58. Схема нейрогормонального механизма координации кровоснабжения и метаболизма головного мозга.
кислорода нагрузкам любого генеза, предъявляемым миокарду [93].
В связи с этим диагностический поиск направлен на определение динамики функционального состояния миокарда левого желудочка, так как именно он страдает в первую очередь во время эпизодов ишемии.
Говоря о функции миокарда левого желудочка, следует помнить, что низкая фракция выброса при значительной дилатации полости желудочка подразумевает больший ударный объем, чем в случае низкой фракции выброса и полости желудочка обычных размеров. Поэтому использование показателя фракции выброса для оценки функционального состояния левого желудочка не всегда корректно [202].
Именно по этой причине для оценки систолической функции левого желудочка рекомендуют использовать и другие показатели: сегментарную сократимость, конечный систолический объем. В частности, показано, что именно КСО левого желудочка является основным предиктором выживаемости больных после инфаркта миокарда [221].
При несоответствии между потребностью миокарда в кислороде и его доставкой могут возникать зоны асинергии сегментов левого желудочка, что, на фоне искусственно вызванной ишемии, позволяет определить величину зоны ишемизированного миокарда [95,98,102].
Ишемия может также вызвать ухудшение диастолической функции левого желудочка. При этом нарушается расслабление миокардиального волокна, увеличивается диастолическая жесткость камеры, что приводит к увеличению конечного диастолического давления, а повышение пос-леднего усугубляет ишемию за счет существенного снижения
субэндокардиальной перфузии. Так замыкается порочный круг.
Разные исследователи предлагают различные методы провоцирования ишемии миокарда, однако до настоящего времени нет единой точки зрения на то, какой из этих методов является оптимальным. Наиболее приближена к реальной клинической ситуации, несомненно, ишемия миокарда, спровоцированная пробой с дозированной физической нагрузкой. Единственное ограничение этого метода — технические трудности при динамическом инструментальном исследовании функции сердца. Для более детальных исследований состояния сократительной активности миокарда при ишемии применяют ЧПЭС и фармакологические пробы. Среди последних в настоящее время большое значение придается стресс-эхокардиографии с добутамином, которая в разных модификациях позволяет оценивать как коронарный, так и миокардиальный резервы, и по своим гемодинамическим эффектам более точно воспроизводит физическую нагрузку, чем иные стресс-тесты [95,110,222].
И все же следует иметь в виду, что все нагрузочные пробы не всегда физиологичны, и провоцируемая ишемия может иметь не совсем такой же характер, как при спонтанном приступе.
Во время физической нагрузки возрастание интенсивности обменных процессов требует значительного увеличения потребления кислорода, что, в свою очередь, предъявляет повышенные требования к функциям сердца и дыхательной системы. В связи с этим величина потребления кислорода при физической нагрузке (по данным спироэргомет- рии) представляет собой интегральный показатель аэробной произво- димости и является одним из основных критериев резервных возможностей кардиореспираторной системы. У здоровых людей потребление кислорода при нагрузке увеличивается пропорционально ее мощности и повышению МОК, причем последний является основным фактором, лимитирующим максимальное потребление кислорода [197].
У больных ИБС уровень потребления кислорода при физической нагрузке, как правило, не достигает своего максимального значения в результате снижения коронарного резерва [219].
В зависимости от характера изменений потребления кислорода во время работы выделяют два вида адаптации к физической нагрузке у больных ИБС: 1) повышение потребления кислорода при выполнении работы в устойчивом состоянии (steady state) и, в меньшей степени, в восстановительном периоде; 2) снижение потребления кислорода, по- видимому, за счет использования преимущественно анаэробного пути энергообразования, что приводит к появлению значительного кислородного долга. Первый вид адаптации, хотя и не экономичен с точки зрения энергетических затрат, позволяет больным удовлетворительно переносить большие и средние нагрузки, поэтому характерен для лиц, относящихся к наиболее благоприятным по прогнозу функционально
го состояния сердечно-сосудистой системы [3].
Очень важным показателем, отражающим способность сердечно-сосудистой системы снабжать организм кислородом и уровень протекающих метаболических процессов во время физической нагрузки, является анаэробный порог работы [223]. В физиологическом смысле под этим понимают такой уровень потребления кислорода при возрастающей нагрузке, сверх которого аэробное продуцирование энергии дополняется анаэробным механизмом [3,11,15,30,223]. В ряде исследований [220, 223,224] показано, что анаэробный порог работы является количественным, хорошо воспроизводимым показателем, позволяющим объективно оценить функциональное состояние больных ИБС.
Количественные диагностические критерии коронарного и миокардиального резервов, показатели, характеризующие гемодинамическое и кислородное обеспечение дозированной физической нагрузки у больных ИБС, описаны в предыдущих разделах этой главы.
Цереброваскулярный резерв.
Основные вопросы физиологии и патофизиологии мозгового кровообращения достаточно подробно, как нам кажется, описаны в разделе
- Тем не менее следует напомнить, что вся сложнейшая система регуляции церебральной гемодинамики ориентирована на обеспечение и сохранение независимости и постоянства мозгового кровотока, который обеспечивает присущую мозгу исключительно высокую интенсивность метаболизма.
Через сосудистую систему мозга для его нормального функционирования должно постоянно протекать около 20% всей циркулирующей в организме крови. Наряду с постоянно высокой метаболической активностью мозг практически не располагает запасами кислорода. Это делает его не только чрезвычайно чувствительным к гипоксии, но и ставит функ-ционирование его структур в прямую зависимость от оптимального режима кровоснабжения.
Согласно современным взглядам, регуляция мозгового кровообращения осуществляется преимущественной констрикцией магистральных сосудов головы и преобладающей дилатацией пиальных артерий [225]. Комбинацией этих реакций обеспечивается стабильность мозгового кровотока при колебаниях системного АД, изменениях газового состава крови и иных возмущающих воздействиях. Так, например, при напряженной умственной работе в стрессорных условиях не только возрастает скорость кровотока в сонных артериях, происходит перераспределение кровотока между различными областями серого вещества головного мозга, но изменяется реактивность сосудов всего бассейна сонных артерий. При этом скорость кровотока во внутренних сонных артериях увеличивается, в глазничных ветвях ВСА уменьшается, реак
тивность анастомозов между ветвями внутренних и наружных сонных артерий резко снижается [225].
Многочисленные экспериментальные исследования с использованием различных возмущающих воздействий (нарушение кровоснабжения мозга, повышение системного АД, избыточный объем крови в сосудах мозга, изменение газового состава крови) показали, что различные части артериальной системы мозга выполняют при этом лишь присущую им функцию. При этом пиальные, расположенные поверхностно, артерии расширяются, регулируя адекватный приток крови в ткань мозга; магист-ральные, сонные и вертебральные суживаются, компенсируя (демпфируя) повышение системного АД или избыточное кровенаполнение сосудов мозга [226].
Из этого становится ясно, что цереброваскулярный резерв, направленный на сохранение адекватного кровоснабжения мозговой ткани в условиях патологии или стресса, включает вазодилататорные и вазокон- стрикторные реакции.
Регуляция тонуса мозговых сосудов осуществляется теми же, описанными выше, нейрогенным, гуморальным и миогенным механизмами. Причем в церебральных гемодинамических реакциях преобладающую роль играет нейрогенный контур регуляции (рис. 4.58), который обладает максимальными скоростными возможностями [193] и координирует все остальные виды регулирования мозгового кровообращения [214]. По теории D.Heistad [227], симпатическое раздражение вызывает сужение мозговых магистральных артерий; это приводит к ауторегуляторному (рефлекторному) расширению дистальнее расположенных артерий меньшего калибра, вследствие чего суммарный кровоток меняется незначительно.
Наряду с этим миогенный контур регуляции обеспечивает: а) постоянство мозгового кровотока при изменениях системного АД; б) устранение избыточного объема крови в сосудах мозга. Гуморальный контур контролирует: а) адекватность кровоснабжения мозга; б) нормальное содержание в ткани мозга кислорода и углекислого газа [226].
Под патологической реакцией мозговых артерий подразумевается такое функциональное поведение этих сосудов в виде патологической кон- стрикции (ангиоспазма) или патологической дилатации, которое не обеспечивает регулирования кровотока, а ведет к его нарушениям.
Патологическая вазоконстрикция может приводить (в случае недостаточного коллатерального кровотока) к дефициту кровоснабжения соответствующих областей мозга, а патологическая вазодилатация приводит к избыточной перфузии мозговой ткани.
К патологическим реакциям мозговых артерий можно отнести также их извращенные (инвертированные) реакции, которые означают патологическую констрикцию вместо дилатации, или наоборот, что зна
чительно нарушает регулирование мозгового кровообращения и всегда способст-вует его расстройствам [214,226].
Нарушение цереброваскулярного резерва означает срыв механизмов регуляции мозгового сосудистого тонуса, который может наступать при острой системной гипертензии, гиперкапнии, ишемии, мозговой травме и при других патологических состояниях.
Внешним проявлением паралича регуляторных механизмов является пассивность мозгового кровотока на фоне колебаний перфузионно- го давления. В основе срыва регуляции лежит метаболически измененная (иногда даже извращенная) реактивность гладких мышц сосудов. Вследствие этого в ишемизированных зонах мозга при действии сосудорасширяющих агентов (особенно СО2) наблюдается патологический “синдром обкрадывания”, при котором из ишемического очага проис-

Рис. 4.59. Наиболее часто встречающиеся синдромы в клинике атеросклероза: БА - брюшная аорта; МАК - магистральные артерии конечностей; ХАННК - хроническая артериальная недостаточность нижних конечностей; ЭКА - экстракраниальные артерии. Пояснения в тексте.
ходит еще больший отток крови в неповрежденные участки мозга, где наступила вазодилатация.
Извращенная реакция сосудов ишемизированной зоны на гипокап- нию, наоборот, ведет к появлению феномена “обратного обкрадывания” (синдром Робина Гуда), когда кровь из непораженных участков, где наступила вазоконстрикция, оттекает в сосуды патологического очага [214].
В последнее время получены данные о том, что патологический вазоспазм — это скорее патология эндотелия, выражающаяся в его длительном набухании, а не состояние длительного сокращения гладкомышечных волокон медии. Сосуды с поврежденным эндотелием, в частности, атеросклеротически измененные сонные артерии, обладают склонностью к спазмам и меняют (извращают) свою реактивность к ряду агентов, в том числе, в нормальных условиях обладающих сосудорасширяющим действием [228].
Возникающее при спазме повреждение эндотелия ведет к нарушению синтеза из арахидоновой кислоты простациклина, расширяющего сосуды ( в том числе мозговые артерии). К другим гуморальным посредникам ангиоспазма относят синтезируемый также из арахидоновой кислоты в тромбоцитах тромбоксан, и ангиотензин II, серотонин [229,230].
Развитие ангиохирургии и широкое распространение операций по поводу стенозов и тромбозов внутренних сонных артерий остро поставили вопрос о необходимости разработки научно обоснованных показаний к проведению подобных оперативных вмешательств. До после-

Рис. 4.60. Алгоритм обследования больных ИБС без сопутствующих ХЦВН и ОААНК. Пояснения в тексте.
днего времени показания к ангиохирургическому лечению базируются преимущественно на клинико-ангиографических данных без учета индивидуальных функциональных особенностей мозгового кровообращения.
Внедрение в клиническую практику транскраниальной допплерографии (ТКД) позволило глубоко изучить особенности гемодинамики на интракраниальном уровне и с качественно новых позиций оценить влияние окклюзирующих поражений сонных артерий на состояние кровотока в интракраниальных артериях.
Поскольку хирургическая коррекция мозгового кровотока направлена прежде всего на профилактику ишемических нарушений мозгового кровообращения, при решении вопроса об операции необходимо оценить риск развития ишемии мозга у каждого конкретного больного. Необходимо выявление больных со сниженной способностью к увеличению мозгового кровотока, то есть больных, у которых нарушен цереброваскулярный резерв [231].
Для оценки индивидуального функционального состояния цереброваскулярного резерва, то есть сохранности адекватных вазоконстрик- торных и вазодилататорных реакций мозговых сосудов, применяют ряд функционально-физиологических нагрузок, которые воздействуют на различные механизмы регуляции тонуса артерий мозга [232]. С этой целью используются ортостатическая, антиортостатическая, нитроглицериновая, гипоксическая, гиперкапническая, гипервентиляционная и
Клинический синдром ХЦВН (атеросклероз ЭКА)