Изменения системной и регионарной гемодинамики при функциональных нагрузочных пробах
В состоянии покоя уровень метаболизма скелетных мышц относительно невысок, но при нагрузках он может возрастать более чем в 50 раз [63]. Это обусловливает необходимость значительной функциональной активации различных механизмов для поддержания обменных процессов на требуемом уровне. При этом переносимость физических нагрузок отражает функциональное состояние организма и, в первую очередь, состояние сердечно-сосудистой и дыхательной систем.
Повышение функциональной активности скелетных мышц требует соответствующего увеличения притока оксигенированной крови. Поэтому при интенсивной нагрузке МОК может возрастать в 5-6 раз по сравнению с состоянием покоя, а коэффициент утилизации кислорода
- в 3 раза. В результате, доставка кислорода к тканям может увеличиваться примерно в 18 раз, что позволяет при интенсивных нагрузках у тренированных лиц достичь возрастания метаболизма в 15-20 раз по сравнению с уровнем основного обмена [30,63].
Физическая нагрузка приводит к увеличению ЧСС, необходимому для обеспечения возрастания МОК. Причем существует ряд закономерностей, позволяющих использовать этот показатель как один из важнейших контрольных параметров при проведении нагрузочных проб.
Отмечается линейная зависимость между ЧСС и интенсивностью мышечной работы, хотя, конечно, возможны индивидуальные вариации,
связанные с полом, возрастом, физической подготовкой. При уровне нагрузки 1000 кгм/мин (около 160 Вт) ЧСС достигает 160-170 в мин. Другими словами, прирост ЧСС составляет 1 уд/мин на каждые 10 кгм/ мин работы. По мере увеличения нагрузки более 1000 кгм/мин ЧСС нарастает более умеренно, достигая уровня 170-200 в мин. Дальнейшее повышение нагрузки уже не сопровождается ростом ЧСС [63].
Важно заметить, что работа сердца при очень высокой ЧСС становится менее эффективной, так как значительно укорачивается время наполнения желудочков, и вследствие этого уменьшается УО.
При переходе от состояния покоя к нагрузке УО быстро увеличивается и доходит до стабильного уровня во время интенсивной работы длительностью 5-10 мин. При этом сердечный выброс повышается, главным образом, за счет более полного опорожнения желудочков. Как известно, в состоянии покоя объем крови, содержащийся в желудочках сердца во время диастолы, условно можно разделить на три основные части: 1) систолический (ударный) объем; 2) резервный объем, увеличивающий УО при усилении сократимости миокарда; 3) остаточный объем крови, который не может быть выброшен из желудочка даже при максимальной сократимости миокарда. В условиях легкой нагрузки УО быстро возрастает за счет использования резервного объема крови. По мере усиления нагрузки возможности использования резервного объема крови уменьшаются, и прирост УО значительно замедляется. С дальнейшим возрастанием мощности работы, когда полностью исчерпан резервный объем крови, УО прекращает увеличиваться, а если нагрузка превышает максимальное потребление кислорода, он уменьшается за счет снижения эффективности наполнения желудочков при высокой ЧСС [63].
Напомним, что МОК определяется УО и ЧСС. Во время физической нагрузки средней интенсивности в положении сидя и стоя МОК примерно на 2 л/мин меньше, чем при выполнении той же нагрузки в положении лежа. Это обусловлено тенденцией к скоплению крови в сосудах нижних конечностей из-за действия сил гравитации.
В возрастании МОК при физической нагрузке важную роль играет так называемый механизм мышечного насоса. Сокращение скелетных мышц сопровождается сжатием находящихся в них вен, что приводит к увеличению оттока венозной крови из вен нижних конечностей. Пост- капиллярные сосуды системного сосудистого русла (печень, селезенка и др.) также действуют как часть общей резервной системы, и сокращение стенок этих сосудов увеличивает отток венозной крови. Все это способствует усиленному притоку крови к правому желудочку и быстрому заполнению сердца [8,30].
Очень важно и то, что прирост МОК обеспечивается УО лишь при умеренных физических нагрузках, но при интенсивной работе увеличе
ние МОК осуществляется, главным образом, за счет ЧСС.
Системное АД при физической нагрузке, как известно, повышается. Начальное увеличение систолического АД при ритмичной работе длится около 1-2 мин, после чего оно устанавливается на стабильном уровне, который зависит от мощности нагрузки. После быстрого прекращения работы систолическое АД в течение 5-10 с падает до более низкого уровня, а затем возрастает до величины, превышающей исходную. Диастолическое АД изменяется несущественно и немного повышается при большой нагрузке, в результате чего возрастает пульсовое давление [8,63].
Существенно меняется сосудистое сопротивление под влиянием физических нагрузок. Увеличение мышечной активности приводит к усилению кровотока в 15-20 раз по сравнению с состоянием покоя (табл. 4.1). Одним из факторов, способствующих увеличению кровотока в работающих мышцах, является резкое уменьшение сосудистого сопротивления в мышцах, что приводит к значительному снижению ОПСС. Это снижение начинается через 5-10 с от начала сокращения мышц и достигает максимума через 1-3 мин [30].
Кровоток в органах и тканях при нагрузках существенно изменяется. Усиление обменных процессов в работающих мышцах требует значительного увеличения доставки кислорода. Кроме того, увеличивается нагрузка на систему кровообращения в связи с повышением требований к терморегуляции, т.к. дополнительное тепло, вырабатываемое сокращающимися мышцами, должно быть отведено к поверхности тела. Увеличение МОК само по себе не может обеспечить адекватное кровоснабжение тканей при нагрузках. Поэтому обеспечение благоприятного режима для обменных процессов в условиях физических нагрузок требует не только увеличения МОК, но и перераспределения регионарного кровотока.
Как уже указывалось, кровоток в скелетной мышце в состоянии покоя составляет около 4 мл/мин/100 г ткани, а при мышечной работе увеличивается до 100-150 мл/мин/100 г ткани. Иными словами, в работающих мышцах кровоток может возрастать в 15-20 раз, а количество функционирующих капилляров может увеличиваться в 50 раз [63].
Коронарный кровоток в покое составляет 60-70 мл/мин/100 г миокарда и при нагрузке может увеличиваться более, чем в 5 раз, нарастая пропорционально повышению МОК при нагрузке. Это важно потому, что даже в покое поглощение кислорода миокардом составляет 70-80%, и любое повышение потребности сердца в кислороде, возникающее при физической нагрузке, может обеспечиваться только путем увеличения коронарного кровотока (раздел 2.1, табл.4.1).
Мозговой кровоток при нагрузках в абсолютных величинах практически не меняется, но его удельный вес в МОК по мере увеличе
ния нагрузки снижается с 13% в покое до 3% при максимальной нагрузке (табл. 4.1).
Во внутренних органах кровоток в покое составляет почти 50% МОК, по мере увеличения нагрузки величина кровотока в этих органах (печень, почки, селезенка, желудочно-кишечный тракт) постепенно уменьшается, и удельный вес его при максимальной нагрузке может вообще свестись к 3% от МОК [63].
Под влиянием большой мышечной работы закономерно уменьшается продолжительность всех фаз сердечного цикла, что В.Л.Карпман [64]
Таблица 4.8
Нормативы соотношения диастолы и систолы (Дн/Сн)
для определения АФКПД [66].
Возраст, лет 17-25 26-35 36-45 старше 45
Дн/Сн мужчины 108/ЧСС 104/ЧСС 100/ЧСС 96/ЧСС
женщины 96/ЧСС 93/ЧСС 90/ЧСС 87/ЧСС
назвал “фазовым синдромом гипердинамии”. Отмечено, что при физических нагрузках значительно укорачивается фаза изометрического сокращения, причем скорость повышения внутрижелудочкового давления (dP/dt) в этих случаях увеличивается в 20-30 раз по сравнению с состоянием покоя [63]. Интересно, что устойчивое состояние (steady state) для фазы изометрического сокращения устанавливается в 2 раза быстрее, чем для периода изгнания [64]. Длительность диастолы под влиянием мышечной работы по мере увеличения ЧСС значительно уменьшается, в первую очередь, за счет укорочения фазы медленного наполнения.
Следует признать, что фазовый анализ сердечного цикла, основанный на синхронной регистрации каротидной сфигмограммы, фонокардиограммы и ЭКГ, на сегодняшний день утратил свое диагностическое значение в связи с внедрением в практику более точных методов исследования серд-ца. В то же время, графическая регистрация пульсовых колебаний сонной артерии позволяет косвенно оценивать один из основных параметров коронарной гемодинамики — аортальный фактор коронарного перфузионного давления (АФКПД). Физиологическое обоснование роли аортальной компрессионной камеры в регуляции и компенсации коронарного кровообращения подробно описано в разделе 2.1.
Сущность неинвазивного метода определения АФКПД заключается в синхронной регистрации ЭКГ, объемной сфигмограммы сонной артерии (СФГ) и измерении АД по Н.С.Короткову [65].
- Исследование проведено совместно с канд. мед. наук А.Ю.Федоровым и врачом С.Д.Ефремовым.
В исследовании, проведенном в клинике нашего института, для регистрации СФГ использовали полифизиограф “Bioset-6000” (Германия), оснащенный пьезокристаллическим датчиком артериального пульса. Последовательность вычисления АФКПД состояла в следующем:
- Амплитудные элементы СФГ водили в масштаб АД, измеренного в плечевой артерии по методу Н.С.Короткова (рис. 4.17), маркируя для этого пик изгнания на СФГ как уровень систолического АД, а диастолическое плато — как уровень диастолического АД. В такой масштабности оценивали динамику СФГ, начиная с инцизуры (от момента закрытия аортальных клапанов) до начала периода изгнания, как динамику диастолического давления в аорте.
- Определяли расстояние между систолическим и диастолическим плато на СФГ, которое в масштабности АД соответствует пульсовому АД (ПД). Зная расстояние ПД в мм, оно может быть выражено в мм рт.ст., и, таким же путем, возможна оценка любой точки диастолической части СФГ в мм рт.ст.
- Для определения максимального диастолического пульсового дав
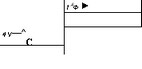 ления (МДПД) измеряли амплитуду дик- ротической волны СФГ и выражали это расстояние в мм рт.ст.
ления (МДПД) измеряли амплитуду дик- ротической волны СФГ и выражали это расстояние в мм рт.ст.
-
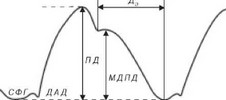 В связи с тем, что снижение диастолического давления в аорте близко к линейному, величина среднего диастолического пульсового давления равна 1/2 МДПД.
В связи с тем, что снижение диастолического давления в аорте близко к линейному, величина среднего диастолического пульсового давления равна 1/2 МДПД. - Продолжительность периода диастолы измеряли по интервалу Q-T на ЭКГ. Для характеристики адекватности диастолического периода определяли фактическое соотношение электрической диастолы и систолы:
Дф : С = (T-Q) :
Таблица 4.9
Динамика АФКПД у лиц контрольной группы и больных ИБС во время
велоэргометрической пробы (М±т).
|
Ступени нагрузки |
АФКПД, мм рт.ст.Р |
|
|
|
|
контрольная группа (n=26) |
больные ИБС (n=81) |
|
|
Исходное состояние |
13,19+0,76 |
13,87+0,29 |
|
|
Стандартная нагрузка (25 Вт) |
15,03+0,78* |
11,10+0,26** |
0,001 |
|
Пороговая нагрузка |
27,16+1,38** |
8,39+0,24*** |
0,001 |
|
Восстановительный период (5-я мин) |
13,23+1,36 |
13,57+0,43 |
|
Примечание: здесь и в таблицах 4.10, 4.11, 4.14, 4.15, 4.16, 4.18, 4.21-4.31 указаны только достоверные отличия. Звездочками отмечена достоверность различий показателей по сравнению с их значением в исходном состоянии: * - рlt;0,05, ** - plt;0,001. Р - достоверность межгрупповых отличий.
(Q-T).
Соотношение Дф/Сф сравнивали с нормативной величиной (Дн/Сн), которая зависит от пола, возраста и ЧСС (табл. 4.8). Адекватность продолжительности диастолы для данной ЧСС характеризовали по соотношению Дф/Сф : Дн/Сн.
- Эффективную часть диастолы (Дэ) по отношению к коронарной перфузии определяли по интервалу от инцизуры до диастолического плато СФГ и сравнивали с фактической продолжительностью электрической диастолы (Дф).
- В конечном итоге, формула для вычисления аортального фактора коронарного перфузионного давления приобретала следующий вид:
АФКПД, мм рт.ст. = МДПД х Д ф/ СФ Д э
2 Д н / Сн Д ф
По данным Э.Я.Лаане и соавт.[65,66], у практически здоровых лиц в условиях покоя АФКПД оставался в диапазоне 12-16 мм рт.ст. и составлял 40-50% от МДПД.
Для оценки корректности неинвазивного метода определения АФКПД нами было выполнено сравнительное исследование с данными прямых измерений аортального давления. С этой целью на базе лаборатории ан-гиографии у 56 больных ИБС производилась чрескожная трансфеморальная ретроградная катетеризация аорты с последующим выполнением коронаровентрикулографии*.
Когда катетер типа “pigtail” располагался в начальном отделе восходящей аорты, регистрировали аортальное давление и одновременно из
меряли АД на левом плече. Синхронную регистрацию кривой давления в аорте, объемной СФГ и ЭКГ производили на полиграфе “Mingograf- 804”, входящем в состав ангиографического комплекса “Cardoscop-U” (Германия).
Проведенный корреляционный анализ между показателями АД в плечевой артерии по данным аускультативного метода Н.С.Короткова и величиной давления в восходящей аорте, полученного при манометрии, показал тесную корреляцию значений как систолического АД (r=0,89; рlt;0,001), так и диастолического АД (r=0,87; рlt;0,001). Кроме того, были подвергнуты корреляционному анализу показатели АФКПД, рассчитанные по СФГ и по данным синхронной манометрии восходящей аорты. В первом случае для вычисления АФКПД использовали амплитудные и временные характеристики СФГ и АД по Н.С.Короткову (рис. 4.17), во втором — амплитудные и временные характеристики кривой давления в аорте и величины систолического и диастолического АД, полученные путем прямых измерений. Найдена тесная корреляция значений АФКПД, полученных этими методами (r=0,90; рlt;0,001; n=56). Ошибка неинвазивного метода определения АФКПД не превышала ± 6%.
Таким образом, во-первых, тесная корреляция показателей АД на плече и в восходящей аорте позволяет считать величину АД по Н.С.Короткову прямой функцией от давления в аорте. Во-вторых, почти полное сов-падение результатов определения АФКПД с помощью прямого и расчетного методов позволяет считать неинвазивный метод исследования АФКПД достаточно адекватным для динамической оценки коронарной гемодинамики.
В дальнейшем у 81 больного ИБС (все мужчины) со стенокардией напряжения I-III функционального класса и 26 мужчин с исключенной органической патологией сердечно-сосудистой системы (контрольная группа) были проведены измерения АФКПД во время велоэргометри- ческой пробы, чреспищеводной предсердной электрической стимуляции и при пробе с дипиридамолом*.
В ходе велоэргометрической пробы в группе контроля наблюдалось линейное увеличение АФКПД с максимумом на пороговом уровне нагрузки (табл. 4.9). При этом средняя дельта АФКПД, как разность между пороговым и исходным значением этого показателя, составила + 13,96+1,27 мм рт.ст.
Механизмы реализации гемодинамического резерва аортальной компрессионной камеры при физической нагрузке у здоровых лиц, по-видимому, заключается в том, что эластичные стенки восходящей аорты, аккумулируя энергию возрастающего сердечного выброса, обеспечивают достаточно высокий уровень конечного систолического давления в аорте, а следовательно, и градиент пульсового давления в период диастолы. В свою очередь, увеличение МДПД обеспечивало прирост вели-
Таблица 4.10
Динамика АФКПД у лиц контрольной группы и больных ИБС во время ЧПЭС (М±т).
|
Ступень нагрузки |
АФКПД, мм рт.ст. |
Р |
|
|
Контрольная группа (n=26) |
Больные ИБС (n=72) |
||
|
Исходное состояние |
13,48+0,53 |
13,07+0,37 |
|
|
100 имп/мин |
12,18+0,42 |
9,10+0,25** (n=72) |
0,01 |
|
120 имп/мин |
11,21+0,36* |
6,64+0,15*** (n=66) |
0,001 |
|
140 имп/мин |
9,72+0,19** |
4,99+0,19*** (n=43) |
0,001 |
|
160 имп/мин |
8,82+0,14*** |
4,23+0,38*** (n=9) |
0,001 |
|
Восстановительный период (5-я мин) |
13,11+0,39 |
12,03+0,54 |
|
чины перфузионного давления в устьях венечных артерий.
Подтверждением прямой зависимости коронарного перфузионного давления от уровня и динамики давления в восходящей аорте при вело- эргометрии является тесная корреляция между дельтами АФКПД и систолического АД (r=0,37; рlt;0,05; n=26), пульсового АД (r=0,37; рlt;0,01), МДПД (r=0,82; рlt;0,001) как разницы их пороговых и исходных значений.
У больных ИБС в исходном состоянии величина АФКПД составляла 13,87+0,29 мм рт.ст. и не отличалась от показателей контрольной группы (табл. 4.9). По нашему мнению, у больных ИБС в условиях покоя эффективное коронарное перфузионное давление поддерживается благодаря компенсаторным возможностям аортальной компрессионной камеры, адекватному сердечному выбросу и достаточно продолжительной диастоле.
В процессе выполнения физической нагрузки у всех больных ИБС наблюдалось выраженное снижение АФКПД с максимумом на пороговой нагрузке. Важно отметить, что редукция АФКПД опережала появление как клинико-электрокардиографических критериев ишемии миокарда, так и снижение показателей сократительной и насосной функции сердца. При этом средняя дельта АФКПД (-5,48+0,26) имела противоположную направленность по сравнению с показателем контрольной группы.
Основной причиной снижения перфузионного давления в устьях венечных артерий у больных ИБС является ригидность стенок восходящего отдела и дуги аорты. Кроме того, под действием пульсирующего кровотока стенки ригидной аорты пассивно расширяются, что приводит к уменьшению дополнительного объема аортальной компрессионной камеры. Так, в нашем исследовании у всех больных ИБС по данным рентгеноскопии отмечено уплотнение восходящей аорты, а при ультразвуковом сканировании в М-, В- режимах выявлено уплотнение, утол
щение, слоистость стенок и расширение просвета восходящего отдела аорты. В связи с атеро-склеротическими изменениями аортальная компрессионная камера перестает функционировать как гидроэластический резервуар [67], утрачивает свои демпфирующие свойства, а следовательно, способность аккумулировать в необходимом количестве кинетическую энергию сердечного выброса, следствием чего является снижение диастолического градиента давления в аорте и перфузионного давления в устьях коронарных артерий.
Следует добавить, что у больных ИБС при велоэргометрии отмечено укорочение механической диастолы (Дэ), неадекватное приросту ЧСС, что способствовало более быстрому снижению АФКПД и сокращению периода наиболее эффективной перфузии миокарда. Подтверждением связи между длительностью диастолы и уровнем перфузионного давле-
Таблица 4.11
Динамика АФКПД у лиц контрольной группы и больных ИБС при пробе с дипиридамолом (М±т).
|
Инфузия дипиридамола |
АФКПД, мм рт.ст. |
Р |
|
|
контрольная группа(n=26) |
больные ИБС (n=32) |
||
|
Исходное состояние |
12,64+0,63 |
15,07+0,73 |
|
|
3-я минута инфузии |
11,69+0,94 |
11,52+0,58 |
|
|
5-я минута инфузии |
12,00+0,91 |
8,73+0,56*** |
0,01 |
|
После введения эуфиллина (15-я мин) |
12,43+0,78 |
14,46+0,81 |
|
ния в венечных артериях служит найденная корреляция между дельтами АФКПД и коэффициента Д э/Д (r=0,32; рlt;0,05; n=81) как разницы их пороговых и исходных значении.
Учитывая изложенное, можно полагать, что у больных ИБС во время велоэргометрии в результате ригидности аорты в диастолу в устья венечных артерий попадает редуцированный объем крови при неадекватной для данной гемодинамической ситуации величине коронарного перфузионного давления.
При проведении ЧПЭС у лиц контрольной группы наблюдалось постепенное снижение АФКПД, становившееся статистически достоверным при частотах стимуляции 120, 140, 160 имп/мин (табл. 4.10). При этом средняя дельта АФКПД составила -4,66+0,58 мм рт.ст.
Механизм редукции АФКПД в контрольной группе при ЧПЭС представляется следующим. В ходе искусственного увеличения ЧСС в результате укорочения диастолы и снижения пульсового АД уменьшался градиент между конечным систолическим давлением в аорте и МДПД. Последний показатель отражает динамику диастолического давления в
Таблица 4.12
Выраженность изменений АФКПД (дельта АФКПД) у лиц контрольной группы и больных ИБС при проведении функциональных нагрузочных проб (М±т).
|
Нагрузочные пробы |
Дельта АФКПД, мм рт.ст. |
Р |
||
|
контрольная группа (n=26) |
больные ИБС |
n |
||
|
Велоэргометрическая проба |
+13,96±1,27 |
-5,48±0,26 |
81 |
0,001 |
|
ЧПЭС |
-4,66±0,58 |
-7,29±0,33 |
72 |
0,001 |
|
Проба с дипиридамолом |
-0,64±1,04 |
-6,33±0,53 |
32 |
0,001 |
аорте и определяет величину перфузионного давления в устьях венечных артерий. Подтверждением связи редукции АФКПД со степенью снижения служит наличие корреляции между дельтами АФКПД, пульсового АД (r=0,51; рlt;0,05; n=72) и МДПД (r=0,90; рlt;0,001).
Кроме того, во время ЧПЭС прогрессирующее снижение УО и отсутствие прироста систолического АД, очевидно, вызывало уменьшение аортальной компрессионной камеры, так как в этой гемодинами- ческой ситуации кинетической энергии и давления порции выброшенной крови оказывалось недостаточно для адекватного растяжения аортальных сегментов. Это, а также нарастающее укорочение диастолы приводило к уменьшению градиента диастолического пульсового давления и отсюда коронарного перфузионного давления.
Однако у здоровых лиц умеренное снижение АФКПД во время ЧПЭС
Таблица 4.13
Диагностическое значение АФКПД у больных ИБС с неспецифическими критериями прекращения велоэргометрической пробы.
|
N п.п. |
Больные |
Критерии прекращения нагрузки |
Дельта АФКПД, мм рт.ст. |
|
1. |
Ш-в |
одышка, боль в ногах |
-5,51 |
|
2. |
К-н |
одышка |
-4,89 |
|
3. |
Т-в |
головокружение, одышка |
-4,42 |
|
4. |
Д-к |
экстрасистолия, одышка |
-5,84 |
|
5. |
Г-в |
экстрасистолия |
-8,38 |
|
6. |
Д-н |
одышка |
-8,40 |
|
7. |
С-в |
одышка |
-7,50 |
|
8. |
К-т |
экстрасистолия |
-5,28 |
|
9. |
А-в |
одышка |
-5,48 |
|
10. |
Н-в |
головокружение, одышка |
-11,98 |
|
11. |
У-й |
экстрасистолия, одышка |
-5,54 |
|
12. |
Ш-н |
одышка |
-6,02 |
|
13. |
Б-в |
одышка |
-6,91 |
|
14. |
В-н |
экстрасистолия, одышка |
-5,23 |
|
15. |
М-й |
одышка |
-6,42 |
не приводило к развитию ишемии миокарда, так как интактные коронарные артерии, чутко реагируя на изменение перфузионного давления, моментально реализуют свой большой резерв дилатации, увеличивая объемную скорость коронарного кровотока и экстракцию кислорода из артериальной крови.
У больных ИБС во время предсердной стимуляции динамика АФКПД имела аналогичную направленность по сравнению с контрольной группой, что выражалось в прогрессирующем снижении АФКПД по мере увеличения частоты навязанного ритма (табл. 4.10). Однако у больных ИБС на всех ступенях пробы снижение АФКПД было достоверно более выраженным.
Снижение АФКПД у больных ИБС обусловлено теми же механизмами, что и в контрольной группе. Однако ригидная восходящая аорта, утрачивая свойства демпфера пульсовой волны, в данной гемодинами- ческой ситуации функционирует как гидродинамически инертная трубка, способная лишь ограниченно аккумулировать кинетическую энергию и давление кровотока в виде потенциальной энергии деформации. Кроме того, нарастающее укорочение диастолы при ЧПЭС способствовало более выраженной, чем в контрольной группе, редукции перфузи- онного давления в устьях венечных артерий. Так, средняя величина АФКПД на разных пороговых частотах стимуляции у больных ИБС составила 5,77+0,22 мм рт.ст., что было значительно меньше показателя при пороговой нагрузке (160 имп/мин) в группе контроля (8,82+0,14 мм рт.ст.; рlt;0,001).
 Во время пробы с дипиридамолом, несмотря на некоторые индивидуальные вариации, в целом по группе контроля статистически достоверной динамики АФКПД не обнаружено (табл.
Во время пробы с дипиридамолом, несмотря на некоторые индивидуальные вариации, в целом по группе контроля статистически достоверной динамики АФКПД не обнаружено (табл.
- . При этом средняя дельта АФКПД составила лишь 0,64+1,04 мм рт.ст.
У больных ИБС инфузия дипири- дамола сопровождалась снижением АФКПД с максимумом редукции на пике введения препарата. Очевидно, вызванная дипиридамолом вазодила- тация и перераспределение коронарного кровотока не обеспечивались адекватным уровнем перфузионного давления в коронарной системе вследствие ригидности атеросклеро- тически измененной аорты, что уси-
ливало выраженность синдрома “межкоро- нарного обкрадывания” и способствовало быстрому развитию ишемии миокарда.
 Сравнивая дельты АФКПД при функциональных нагрузочных пробах (табл.
Сравнивая дельты АФКПД при функциональных нагрузочных пробах (табл.
- , следует отметить, что во всех случаях этот показатель у больных ИБС высокодостоверно отличался от его значений у лиц контрольной группы.
Здесь же необходимо еще раз подчеркнуть, что снижение АФКПД у больных ИБС при всех исполь-
зованных нагрузочных пробах опережало появление клинических и электрокардиографических признаков индуцированной ишемии миокарда. Вместе с тем только при велоэргометрической пробе изменения АФКПД у лиц контрольной группы и больных ИБС имели диаметрально противоположную направленность, тогда как при ЧПЭС и при пробе с дипиридамолом снижение этого показателя в группе больных ИБС было лишь более выраженным. Иными словами, динамическую оценку АФКПД можно назвать методом выбора в дифференциальной диагностике ИБС с помощью пробы с дозированной физической нагрузкой.
Дополнительным подтверждением этого положения могут служить результаты, когда у 15 больных ИБС снижение АФКПД наблюдалось в случаях прекращения велоэргометрической пробы по неспецифическим критериям: одышка, нарушения ритма сердца, симптомы ухудшения мозгового или периферического кровообращения (табл. 4.13).
К сожалению, метод оценки АФКПД не лишен недостатков, основным из которых следует назвать необходимость регистрации и графического анализа кривых каротидной сфигмограммы, что требует затрат
времени, пусть и не очень больших, но делающих невозможным изучение этого показателя непосредственно во время проведения функциональных проб. Кроме того, при недостаточности клапанов аорты, окк- люзирующем атеросклерозе сонных артерий, больших артерио-веноз- ных шунтах определение АФКПД описанным выше способом невозможно в связи с изменениями конфигурации и морфологии объемной - каротидной сфигмограммы.
Среди методов измерения ударного объема левого желудочка, в том числе во время нагрузочных проб, тетраполярная грудная реография (ТГР) до наших дней не потеряла своего значения, несмотря на разработку и внедрение более точных методов исследования. Метод ТГР безопасен, не оказывает отрицательного эмоционального влияния на обследуемого, обладает достаточной воспроизводимостью результатов, удовлетворительно коррелирует с данными прямых и ультразвуковых методов измерения сердечного выброса, причем ошибка метода ТГР не превышает +10% [68,69].
Исследования проводят с использованием серийного отечественного реоплетизмографа РПГ2-02, оснащенного ленточными электродами разных типоразмеров, выполненными из посеребренной латуни. При проведении проб с дозированной физической нагрузкой более качественная за-пись реографических кривых может быть получена с помощью пружинных электродов из бериллиевой бронзы. Такие электроды были использованы в нашем исследовании при проведении всех описанных ниже функциональных нагрузочных проб. Регистрацию кривых осуществляли на полиграфах 6NEK-401 и “Mingograf-7” (Германия) при скорости лентопротяжного механизма, равной 50 мм/с. У части боль-
 ных исследования выполнены с использованием полифизиографа “Bioset-6000” (Германия), оснащенного встроенным тет- раполярным рео-плетизмогра- фом.
ных исследования выполнены с использованием полифизиографа “Bioset-6000” (Германия), оснащенного встроенным тет- раполярным рео-плетизмогра- фом.
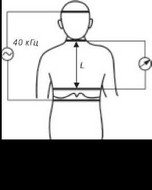
Две пары электродов на теле обследуемого помещали следующим образом (рис. 4.18). Токовые (зондирующие, генерирующие) фиксировали в области середины лба и на уровне реберных дуг. Измерительные
(потенциальные) электроды располагали сог-ласно методике W.Kubicek [70]: первый — в области шеи на уровне остистого отростка 7-го шейного позвонка, второй — в области сочленения грудины с мечевидным отростком.
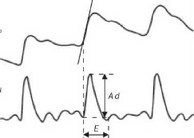
Зондирующий ток с частотой 40 кГц через токовые электроды подавали в исследуемую зону. Отсчет базового межэлектродного импеданса (Z) производили по шкале индикатора прибора РПГ2-02. Изменения импеданса во время изгнания крови определяли путем измерения величины их первой производной по нормализованной амплитуде ТГР (рис. 4.19). Для этого перед началом исследования прибор калибровали регулировкой усиления канала регистрации дифференцированной реограм- мы с установкой записи 10 или 20 мм, что соответствовало масштабу записи:
- мм = 1 Ом/с или 20 мм =0,5 Ом/с.
Для вычисления ударного объема (УО) использовали формулу, предложенную W.Kubicek [70] с дополнениями Ю.Т.Пушкаря и соавт. [68]: УО, мл = К хрх L2/Z2х Ad х E, где К — поправочный коэффициент, зависящий от анатомических особенностей исследуемой области; р — удельное сопротивление крови (Ом/ см); для грудной клетки произведение К х р равно 135 [71]; L — расстояние между потенциальными электродами (см); Z — базовый импеданс грудной клетки (Ом); Ad — амплитуда дифференцированной реограм- м ы
(Ом/с); Е — длительность периода изгнания левого желудочка (с).
Исходя из величины УО, вычисляли остальные гемодинамические показатели [72,73]:
- минутный объем кровообращения (МОК):
МОК, л/мин = (УО х ЧСС) / 1000;
- ударный индекс (УИ): УИ, мл/м2 = УО / S;
- сердечный индекс (СИ): СИ, л/мин/м2 = МОК/S,
где S — площадь поверхности тела (м2), которую определяли по номограмме [72] с учетом роста и веса обследуемого;
- общее периферическое сосудистое сопротивление (ОПСС):
ОПСС, дин/с/см-5 = (СДД х 1332 х 60) / МОК (мл), где СДД — среднее динамическое давление (мм рт.ст.), равное сумме диастолического и 1/3 пульсового АД [73]; 1332 — коэффициент перевода мм рт.ст. в дин/см;
- удельное периферическое сопротивление (УПС):
УПС, усл.ед. = СДД/СИ.
Таблица 4.14
Гемодинамическое и кислородное обеспечение дозированной физической
нагрузки
у лиц контрольной группы и больных ИБС (M±m).