Методы обследования больных с новообразованиями щитовидной железы
А — дооперационные:
УЗИ) и цитологическое исследование пунктата (при раке — характерная цитологическая картина); *
Б — интраоперационные:
В — послеоперационные:
При любом узловом образовании в щитовидной железе необходима онкологическая настороженность. При пальпаторном исследовании необходимо учитывать не только наличие узла (или узлов), но и оценивать его плотность, смещаемость, болезненность или безболезненность. Кроме того, нужно пытаться прощупать шейные лимфатические узлы. Нужно помнить, что хотя большинство больных с узлами щитовидной железы — это женщины, но риск злокачественности узла в 2 раза больше у мужчин. Кроме того, следует учитывать, что риск рака щитовидной железы у беременных, рожавших или перенесших аборт женщин выше, чем у нерожавших. Это связано с тем, что изменение концентрации эстрогенов при беременности и родах, а также плацентарные гормоны могут способствовать развитию рака щитовидной железы при генетической предрасположенности к нему. При УЗИ 95 % тиреоидных раков обладают пониженной эхогенностью, могут иметь нечеткие контуры, кальцификаты. Тем не менее даже в отсутствие этих признаков узел не может быть признан доброкачественным. Нельзя полностью исключить малигнизацию и при наличии “теплого” очага на сканограмме щитовидной железы. Хотя злокачественные опухоли последней чаще не накапливают изотоп йода и выявляются как “холодные” узлы, совпадение сканографической картины злокачественных и доброкачественных новообразований встречается в 65 % случаев. Поэтому метод радиоизотопной диагностики утратил значение “скринингового”, но активно используется для выявления рецидивов или метастазов высокодифференцированного рака щитовидной железы.
В настоящее время в практику внедряется неинвазивный метод рентгенофлюоресцентного анализа уровня стабильного йода в ткани щитовидной железы. При уровне йода в узле ниже 200 мкг/г риск злокачественности очень высок, тогда как уровень йода выше 400 мкг/г ткани может служить маркером ее доброкачественности.
Важнейшим диагностическим методом в настоящее время является тонкоигольная пункционная биопсия. Надежность этого метода зависит от техники выполнения пункции, использования УЗИ-контроля за ходом пункции, количества и качества полученного пунктата. Результат цитологического исследования во многом определяется квалификацией патоморфолога. Однако если три из четырех наиболее распространенных вариантов рака щитовидной железы (папиллярный, медуллярный, анапластический) могут быть цитологически диагностированы с высокой достоверностью, то отличить фолликулярные доброкачественные новообразования от злокачественных очень трудно. Ложноположительные результаты диагностики фолликулярного рака щитовидной железы могут быть исправлены при экспресс-диагностике во время операции, ложноотрицательные же вследствие неспособности тонкоигольной пункционной биопсии выявить два важных признака злокачественности — наличие раковых клеток в сосудах и прорастание капсулы, нередко ведут к ошибочному отказу от хирургического лечения. Кроме того, трудно, а подчас и невозможно на основании цитологического исследования отличить гистиоцитарно-макрофагальные элементы в длительно существующих очагах послеоперационного воспаления от клеток низкодифференцированного рака щитовидной железы, выявить раковые клетки в плевральном экссудате в случае метастазирования рака щитовидной железы в легкие. Часто неразрешимой задачей является и обнаружение единичных эпителиальных клеток в пункционном материале микрометастазов рака щитовидной железы в лимфатические узлы. Учитывая все это, в случае подозрения на наличие злокачественной опухоли, возникшего на основании анамнестических и клинических данных, следует независимо от результатов цитологического исследования добиваться гистологического уточнения диагноза путем профилактической резекции узла.
Наибольшее число задач в цитологической диагностике новообразований щитовидной железы решается с помощью методов иммуногистохимии. Основными задачами являются идентификация рака и метастазов тиреоид- ного происхождения, а также обнаружение эпителиальных клеток низко- дифференцированных опухолей щитовидной железы и макрофагально-гис- тиоцитарных элементов очагов хронического воспаления. Реакция опухолевых клеток на антитела к Тг и кальцитонину позволяет точно определить подтипы рака и метастазов тиреоидного происхождения.
Схема 4.1.Тактика обследования больных с новообразованиями в щитовидной железе
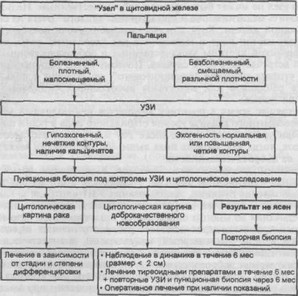
Суммируя вышеизложенное, можно предложить алгоритм действий врача-эндокринолога в отношении больного с узловым новообразованием в щитовидной железе (схема 4.1).
Лечение рака щитовидной железы. Выбор метода лечения рака щитовидной железы зависит от морфологического типа опухоли и стадии ее распространения. Для лечения злокачественных новообразований используют хирургический (гемитиреоидэктомия, субтотальная резекция, тиреоидэкто- мия), лучевой и комбинированный методы (сочетание облучения, операции и гормонотерапии). Химиотерапия применяется очень редко. Тактика лечения дифференцированного рака щитовидной железы представлена в табл. 4.3. При высокодифференцированных формах рака щитовидной железы обычно проводят тиреоидэктомию (исключение в отдельных случаях составляет папиллярный рак малых размеров). После операции в большинстве случаев применяют радиоактивный йод и, поскольку прогрессирование высокодифференцированного рака щитовидной железы зависит от уровня ТТГ, назначают супрессивное лечение тиреоидными препаратами. Обычно спустя 3 нед после тиреоидэктомии больным назначают L-тирокснн: в дозе от 2,2 мг/кг массы тела — до 60 лет (150—200 мг в день) и в дозе 1,5— 1,8 мг/кг — в возрасте старше 60 лет. Уровень ТТГ должен поддерживаться в пределах от 0,05 до 0,1 мЕД/л. Через 2—3 нед лечение тиреоидными препаратами прерывают и через 6 нед проводят сканирование всего тела с использованием 1 I (5—Ю мКи). При обнаружении функционирующей тиреоидной ткани на-
* В возрасте старше 45 лет, при инвазии в окружающие ткани. ** цасто неэффективна.
значают 50 мКи 1311, а если функционирующие метастазы определяются и после этого, то дозу удваивают. Супрессивную терапию L-тироксином возобновляют спустя 24—48 ч после облучения. Через 1 нед после назначения второй дозы I сканирование всего тела повторяют. Если вновь выявляются метастазы, лечение L-тироксином прерывают и дополнительно назначают 100 мКи I, а затем возобновляют прием тиреоидных препаратов. Повторное обследование проводят спустя 6 мес после операции, а затем каждые полгода в течение нескольких лет. В ходе этих обследований выполняется пальпаторное исследование и определяется уровень Тг в сыворотке крови. Повышение последнего у больных, получающих супрессивную терапию, свидетельствует о метастазировании опухоли.
Спустя 6 мес после операции больным, у которых ранее обнаруживались метастазы, вновь проводят сканирование всего тела. Пациентам, у которых в ходе предыдущего сканирования метастазы не выявлялись, повторное сканирование проводят только через 1 год после операции (за исключением больных с повышенным уровнем Тг). При выявлении метастазов в ходе повторного сканирования проводят повторный курс лечения, а за больными, не имеющими метастазов, осуществляют динамическое наблюдение. Независимо от уровня Тг сканирование повторяют всем больным через 3 года после операции. Рецидив заболевания наиболее вероятен в течение первых 5 лет после операции. Через 5 лет наблюдения при удовлетворительных показателях доза L-тироксина может быть снижена и уровень ТТГ допускается в пределах от 0,1 до 0,3 мЕД/л. У некоторых пациентов уровень Тг может быть повышен и в отсутствие видимых функционирующих метастазов. Таким больным не проводят терапию *' I, а выполняют рентгенологическое сканирование и сканирование костей в целях выявления Тг-секретирующих метастазов.
Таким образом, лечение папиллярного и фолликулярного рака щитовидной железы включает предельно тотальную тиреоидэктомию, длительную супрессивную терапию тиреоидными препаратами, радиойодтерапию. Десятилетняя выживаемость больных папиллярным раком составляет от 80 до 95 %, фолликулярным раком — от 80 до 85 %. Лечение анапластического рака в основном является паллиативным, а радиойодтерапия практически не дает позитивных результатов, поскольку эти опухоли не способны концентрировать радиойод. Лишь в редких случаях, когда анапластический рак содержит папиллярные или фолликулярные элементы, такое лечение может
Таблица 4.4. Синдром множественной эндокринной неоплазни и семейный (не МЭН) медуллярный рак шитовидной железы
дать некоторый эффект. Чаще всего послеоперационное лечение анаплас- тического рака сводится к комбинации облучения в высоких дозах и химиотерапии. Однако большинство этих больных умирают в среднем через 6 мес после установления диагноза.
- пальпация щитовидной железы и лимфатических узлов шеи (при раке “узел” может быть болезненным во время пальпации, плотным, спаянным с окружающими тканями; могут быть увеличены и болезненны лимфатические узлы);
- УЗИ щитовидной железы (при раке щитовидной железы может быть снижена эхогенность новообразования; определяются нечеткие контуры “узла”, наличие кальцинатов);
- тонкоигольная пункционная биопсия новообразования (под контролем
УЗИ) и цитологическое исследование пунктата (при раке — характерная цитологическая картина); *
- радиоизотопное сканирование (показания: рецидив зоба, наличие “узла” на шее, имеющего сходство с опухолью щитовидной железы, состояние после экстирпации щитовидной железы по поводу рака, выявление функционально активных метастазов рака щитовидной железы, выявление автономных новообразований щитовидной железы);
- непрямая тиреоидолимфография (топическая диагностика опухолей шеи, сходных с опухолью щитовидной железы) — проводится редко;
- рентгенография загрудинного пространства с контрастированием пищевода барием (при подозрении на загрудинное расположение щитовидной железы, рецидиве узлового зоба);
- рентгенофлюоресцентный анализ уровня стабильного интратиреоидного йода (при подозрении на рак щитовидной железы: при раке — уровень йода в новообразовании составляет менее 200 мкг/г ткани).
Б — интраоперационные:
- срочное гистологическое исследование ткани опухоли щитовидной железы;
- интраоперационное УЗИ щитовидной железы.
В — послеоперационные:
- гистологическое исследование ткани щитовидной железы;
- иммуногистохимическое исследование ткани опухоли.
При любом узловом образовании в щитовидной железе необходима онкологическая настороженность. При пальпаторном исследовании необходимо учитывать не только наличие узла (или узлов), но и оценивать его плотность, смещаемость, болезненность или безболезненность. Кроме того, нужно пытаться прощупать шейные лимфатические узлы. Нужно помнить, что хотя большинство больных с узлами щитовидной железы — это женщины, но риск злокачественности узла в 2 раза больше у мужчин. Кроме того, следует учитывать, что риск рака щитовидной железы у беременных, рожавших или перенесших аборт женщин выше, чем у нерожавших. Это связано с тем, что изменение концентрации эстрогенов при беременности и родах, а также плацентарные гормоны могут способствовать развитию рака щитовидной железы при генетической предрасположенности к нему. При УЗИ 95 % тиреоидных раков обладают пониженной эхогенностью, могут иметь нечеткие контуры, кальцификаты. Тем не менее даже в отсутствие этих признаков узел не может быть признан доброкачественным. Нельзя полностью исключить малигнизацию и при наличии “теплого” очага на сканограмме щитовидной железы. Хотя злокачественные опухоли последней чаще не накапливают изотоп йода и выявляются как “холодные” узлы, совпадение сканографической картины злокачественных и доброкачественных новообразований встречается в 65 % случаев. Поэтому метод радиоизотопной диагностики утратил значение “скринингового”, но активно используется для выявления рецидивов или метастазов высокодифференцированного рака щитовидной железы.
В настоящее время в практику внедряется неинвазивный метод рентгенофлюоресцентного анализа уровня стабильного йода в ткани щитовидной железы. При уровне йода в узле ниже 200 мкг/г риск злокачественности очень высок, тогда как уровень йода выше 400 мкг/г ткани может служить маркером ее доброкачественности.
Важнейшим диагностическим методом в настоящее время является тонкоигольная пункционная биопсия. Надежность этого метода зависит от техники выполнения пункции, использования УЗИ-контроля за ходом пункции, количества и качества полученного пунктата. Результат цитологического исследования во многом определяется квалификацией патоморфолога. Однако если три из четырех наиболее распространенных вариантов рака щитовидной железы (папиллярный, медуллярный, анапластический) могут быть цитологически диагностированы с высокой достоверностью, то отличить фолликулярные доброкачественные новообразования от злокачественных очень трудно. Ложноположительные результаты диагностики фолликулярного рака щитовидной железы могут быть исправлены при экспресс-диагностике во время операции, ложноотрицательные же вследствие неспособности тонкоигольной пункционной биопсии выявить два важных признака злокачественности — наличие раковых клеток в сосудах и прорастание капсулы, нередко ведут к ошибочному отказу от хирургического лечения. Кроме того, трудно, а подчас и невозможно на основании цитологического исследования отличить гистиоцитарно-макрофагальные элементы в длительно существующих очагах послеоперационного воспаления от клеток низкодифференцированного рака щитовидной железы, выявить раковые клетки в плевральном экссудате в случае метастазирования рака щитовидной железы в легкие. Часто неразрешимой задачей является и обнаружение единичных эпителиальных клеток в пункционном материале микрометастазов рака щитовидной железы в лимфатические узлы. Учитывая все это, в случае подозрения на наличие злокачественной опухоли, возникшего на основании анамнестических и клинических данных, следует независимо от результатов цитологического исследования добиваться гистологического уточнения диагноза путем профилактической резекции узла.
Наибольшее число задач в цитологической диагностике новообразований щитовидной железы решается с помощью методов иммуногистохимии. Основными задачами являются идентификация рака и метастазов тиреоид- ного происхождения, а также обнаружение эпителиальных клеток низко- дифференцированных опухолей щитовидной железы и макрофагально-гис- тиоцитарных элементов очагов хронического воспаления. Реакция опухолевых клеток на антитела к Тг и кальцитонину позволяет точно определить подтипы рака и метастазов тиреоидного происхождения.
Схема 4.1.Тактика обследования больных с новообразованиями в щитовидной железе

Суммируя вышеизложенное, можно предложить алгоритм действий врача-эндокринолога в отношении больного с узловым новообразованием в щитовидной железе (схема 4.1).
Лечение рака щитовидной железы. Выбор метода лечения рака щитовидной железы зависит от морфологического типа опухоли и стадии ее распространения. Для лечения злокачественных новообразований используют хирургический (гемитиреоидэктомия, субтотальная резекция, тиреоидэкто- мия), лучевой и комбинированный методы (сочетание облучения, операции и гормонотерапии). Химиотерапия применяется очень редко. Тактика лечения дифференцированного рака щитовидной железы представлена в табл. 4.3. При высокодифференцированных формах рака щитовидной железы обычно проводят тиреоидэктомию (исключение в отдельных случаях составляет папиллярный рак малых размеров). После операции в большинстве случаев применяют радиоактивный йод и, поскольку прогрессирование высокодифференцированного рака щитовидной железы зависит от уровня ТТГ, назначают супрессивное лечение тиреоидными препаратами. Обычно спустя 3 нед после тиреоидэктомии больным назначают L-тирокснн: в дозе от 2,2 мг/кг массы тела — до 60 лет (150—200 мг в день) и в дозе 1,5— 1,8 мг/кг — в возрасте старше 60 лет. Уровень ТТГ должен поддерживаться в пределах от 0,05 до 0,1 мЕД/л. Через 2—3 нед лечение тиреоидными препаратами прерывают и через 6 нед проводят сканирование всего тела с использованием 1 I (5—Ю мКи). При обнаружении функционирующей тиреоидной ткани на-
|
Стадия |
Метод |
|
1-я |
Лобэктомия, супрессивная терапия |
|
— опухоль lt;1,5 см |
Тиреидэктомия, супрессивная терапия, 1311 |
|
— опухоль gt;1,5 см |
|
|
2-я |
Тиреоидэктомия, супрессивная терапия, 1311* |
|
3-я |
Тиреоидэктомия, супрессивная терапия, 13 Ч, химио |
|
|
терапия |
|
4-я |
Тиреоидэктомия, супрессивная терапия, 13|1, химио |
|
|
терапия** |
* В возрасте старше 45 лет, при инвазии в окружающие ткани. ** цасто неэффективна.
значают 50 мКи 1311, а если функционирующие метастазы определяются и после этого, то дозу удваивают. Супрессивную терапию L-тироксином возобновляют спустя 24—48 ч после облучения. Через 1 нед после назначения второй дозы I сканирование всего тела повторяют. Если вновь выявляются метастазы, лечение L-тироксином прерывают и дополнительно назначают 100 мКи I, а затем возобновляют прием тиреоидных препаратов. Повторное обследование проводят спустя 6 мес после операции, а затем каждые полгода в течение нескольких лет. В ходе этих обследований выполняется пальпаторное исследование и определяется уровень Тг в сыворотке крови. Повышение последнего у больных, получающих супрессивную терапию, свидетельствует о метастазировании опухоли.
Спустя 6 мес после операции больным, у которых ранее обнаруживались метастазы, вновь проводят сканирование всего тела. Пациентам, у которых в ходе предыдущего сканирования метастазы не выявлялись, повторное сканирование проводят только через 1 год после операции (за исключением больных с повышенным уровнем Тг). При выявлении метастазов в ходе повторного сканирования проводят повторный курс лечения, а за больными, не имеющими метастазов, осуществляют динамическое наблюдение. Независимо от уровня Тг сканирование повторяют всем больным через 3 года после операции. Рецидив заболевания наиболее вероятен в течение первых 5 лет после операции. Через 5 лет наблюдения при удовлетворительных показателях доза L-тироксина может быть снижена и уровень ТТГ допускается в пределах от 0,1 до 0,3 мЕД/л. У некоторых пациентов уровень Тг может быть повышен и в отсутствие видимых функционирующих метастазов. Таким больным не проводят терапию *' I, а выполняют рентгенологическое сканирование и сканирование костей в целях выявления Тг-секретирующих метастазов.
Таким образом, лечение папиллярного и фолликулярного рака щитовидной железы включает предельно тотальную тиреоидэктомию, длительную супрессивную терапию тиреоидными препаратами, радиойодтерапию. Десятилетняя выживаемость больных папиллярным раком составляет от 80 до 95 %, фолликулярным раком — от 80 до 85 %. Лечение анапластического рака в основном является паллиативным, а радиойодтерапия практически не дает позитивных результатов, поскольку эти опухоли не способны концентрировать радиойод. Лишь в редких случаях, когда анапластический рак содержит папиллярные или фолликулярные элементы, такое лечение может
Таблица 4.4. Синдром множественной эндокринной неоплазни и семейный (не МЭН) медуллярный рак шитовидной железы
|
Опухоль |
МЭН НА |
МЭН НБ |
СМР |
|
Медуллярный рак |
Билатеральный |
Билатеральный |
Билатеральный |
|
Феохромоцитома |
+ |
+ |
— |
|
Патология паращитовидных |
Гиперплазия |
Редко |
Нет |
|
желез |
|
|
|
|
Специфический фенотип |
— |
+ |
— |
дать некоторый эффект. Чаще всего послеоперационное лечение анаплас- тического рака сводится к комбинации облучения в высоких дозах и химиотерапии. Однако большинство этих больных умирают в среднем через 6 мес после установления диагноза.
А так же в разделе « Методы обследования больных с новообразованиями щитовидной железы »
- Синдром гипертиреоза (тиреотоксикоза)
- Классификация зоба.
- Синдром тиреотоксикоза
- Эндокринная офтальмопатия
- Синдром гипотиреоза
- Первичный гипотиреоз
- Дисгенезия (аплазия или гипоплазия) щитовидной железы
- Вторичный гипотиреоз
- Узловой зоб
- Тиреоидиты
- Острый тиреоидит
- Подострый тиреоидит де Кервена
- Хронические тиреоидиты
- Фиброзно-инвазивный зоб Риде.гя
- Опухоли щитовидной железы
- Рак щитовидной железы
- Молекулярно-биологические аспекты патогенеза эпителиальных опухолей щитовидной железы
- КЛАССИФИКАЦИЯ РАКА ЩИТОВИДНОЙ ЖЕЛЕЗЫ ПО СТАДИЯМ [ПАЧЕС А.И., ПРОПП Р.В., 1984]
- Медуллярный рак
- Йоддефицитные заболевания
- Обмен йода в организме.
- Механизмы адаптации к дефициту йода.
- Клинические проявления йоддефицитных заболеваний.
- Методы изучения йоддефицитных заболеваний.
- Лечение йоддефицитных заболеваний.
- 4.9. Щитовидная железа и беременность
- Влияние беременности в районах зобной эндемии на размеры щитовидной железы
- Последствия беременности у женщин с предшествовавшими заболеваниями щитовидной железы
- Фертильность у женщин, оперированных по поводу рака щитовидной железы.
- Послеродовой тиреоидит