Главный комплекс гистосовместимости был открыт в связи с разработкой вопросов внутривидовой пересадки тканей, отсюда и его название. Комплекс расположен у человека на 6-й, а у мышей — на 17-й хромосоме и занимает значительный участок ДНК, включающий до 4х 106 пар оснований, или около 50 генов. Основными особенностями комплекса являются его значительная поли- генносгь — наличие нескольких неаллельных генов, белковые продукты которых сходны в структурном отношении и выполняют идентичные функции, а также ярковыраженный полиморфизм —
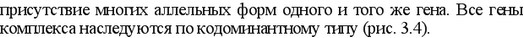
Полигенность и полиморфизм определяют антигенную индивидуальность особей данного вида.
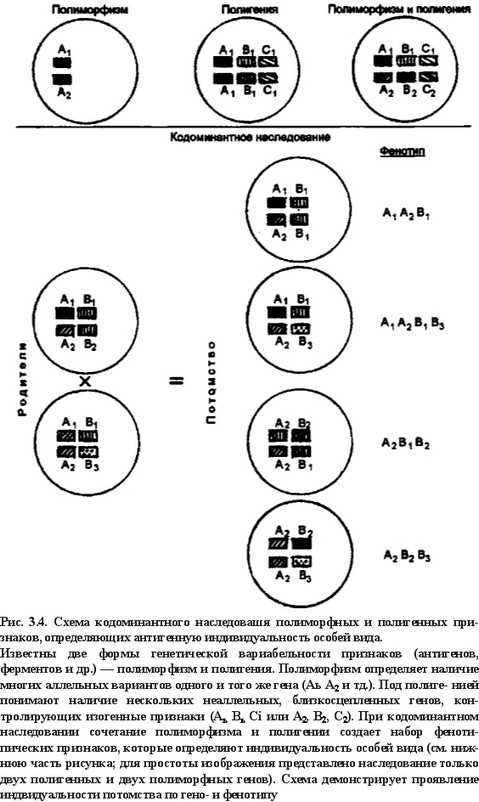
Все гены комплекса делятся на три группы. Каждая группа включает гены, контролирующие синтез полипептидов одного из трех классов (рис. 3.5). У мышей гены Н-2К, D и L, у человека — HLA-A, -В и -С ответственны за образование тяжелой цепи (а- цепи) антигенов (молекул) I класса. Дополнительный однодомен- ный пептид, ассоциированный с основной цепью, р2“микР°гло“ булин ((32-М) контролируется геном, не входящим в комплекс. У человека этот ген расположен на 15-Й, а у мышей — на 2-й хро-
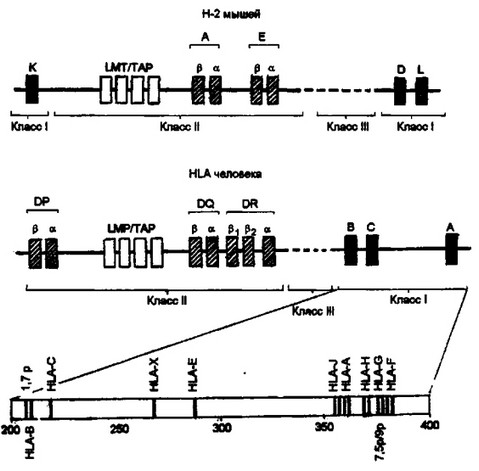
Рис. 3.5. Генная организация главного комплекса гистосовместимости у мышей н человека.
Главный комплекс гистосовместимосги как у мышей, так и у человека включает три группы генов: (1) гены, контролирующие молекулы II класса (В-2К, H-2D и H-2L — у мышей и HLA-A, -В, -С — у человека); (2) гены, контролирующие молекулы II класса (а и p-цепи молекул А и Е — у мышей и DP, DQ, DR — у человека); к этой же группе генов относятся LMP и ТАР, контролирующие соответствующие белки, которые участвуют в образовании комплекса антигенного пептида с молекулами МНС; (3) гены III класса ответственны за синтез одного из компонентов системы комплемента, фактора некроза опухолей — аир, ферментов, участвующих в синтезе гормонов
мосоме. Группа генов II класса ответственна за синтез а- и (3-цепей антигенов данного класса. Гены аир объединены в близко- сцепленные пары для каждого определенного антигена II класса: А и Е — у мышей; DP, DQ и DR — у человека. Кластер DR включает дополнительный (3-ген, что обеспечивает образование двух антигенов DR — aPi и арг- Кроме того, к классу II относятся пары генов LMP и ТАР. Низкомолекулярные белки, контролируемые этими генами, принимают участие в подготовке чужеродного антигена к презентации Т-клеткам (об этом подробнее в данной главе). Кроме хорошо описанных функционально генов класса I имеются гены того же класса (HLA-X, -Е, -J, - Н, -G, -F), предназначение которых пока неизвестно.
Гены класса III контролируют синтез белков, среди которых есть участники иммунных процессов: один из компонентов комплемента, факторы некроза опухолей (ФНО-a и ФНО-(3). Здесь же локализованы гены, контролирующие образование ряда ферментов синтеза стероидов.
Наличие в МНС генов, большинство которых кодирует иммунологически значимые полипептиды, заставляет думать, что этот комплекс эволюционно возник и развивался специально для осуществления иммунных форм защиты.
Наиболее важными в иммунологическом смысле гликопротеинами, контролируемыми комплексом, являются антигены I и II классов.
Молекулы I класса экспрессируются на клеточной проверх- ности и представляют собой гетеродимер, включающий тяжелую a-цепъ и однодоменный р2-микроглобулин, нековалентно связанный с основным полипептидом. Методами рентгеноструктурного анализа выяснена пространственая организация этого антигена (рис.
- . Тяжелая цепь включает три домена: аь а2 и аз. Конформация аз- и (32-микроглобулина напоминают складчатую структуру доменов иммуноглобулинов. Основное свойство антигенов I класса — связывание пептидов и представление их в иммуногенной форме для Т-клеток зависит от двух других доменов — aj и а2. Эти домены имеют значительные a-спиральные участки, которые при взаимодействии между собой образуют щель — место связывания пептидов. Собственно комплекс пептида с ар и аг-доменами определяет иммуногенность экзогенного антигена, его возможность взаимодействовать с антигенрас познающими рецепторами Т-клеток.
Молекулы II класса также являются гетеродимерами, построенными из нековалентно сцепленных а- и (3-цепей, каждая из которых включает по два домена (а^ и Р1Р2 соответственно). Ан- тигенсвязывающая область подобно антигенам I класса формируется a-спиралъными участками взаимодействующих цепей — до-
Рис. 3.6. Структура молекул I и II классов главного комплекса гистосовмести-
мостн.
Методами рентгеноструктурного анализа выяснена структура молекул I и II классов главного комплекса гистосовместимости. А. Молекула I класса состоит из тяжелой цепи, включающей три домена: аь а.2 и аз, и одной легкой цепи — fc- микроглобулина. Связывание анатигенного пептида молекулой I класса происходит в антигенсвязывакмцей щели, образованной а-спиралъными участками а|-и аг-доменов. Б. Молекула II класса представляет собой гетеродимер, состоящий из двух нековалентно связанных цепей: аир, каждая из которых включает два домена: aj, ct2 и р], р2, соответственно. Антигенсвязывающая область, как и у молекул I класса, образована a-слиральными участками. В построении этой области принимают участие ar и ргцепи. Между молекулами I и II классов видно структурное сходство: однотипная пространственная организация, общее количество доменов, принцип построения антигенсвязывающей области
менами ot| и f5j. Общее структурное сходство между двумя классами антигенов очевидно. Это — однотипность пространственной организации всей молекулы, количество доменов, равное четырем, конформационное строение антигенсвязывающего участка,
близкие мол. массы: около 44-49 кД.
Наряду с полигенностью МНС характеризуется крайне выраженным полиморфизмом (рис. 3.7). Ни одна другая генетическая система организма не имеет такого количества аллельных форм определенного гена, как МНС. У человека наибольшее число аллельных вариантов (от 20 до 72) известно для генов I класса и DPp, DQp и DRp генов II класса. Гены, контролирующие а-цепь антигенов II класса, характеризуются меньшей изменчивостью, а у гена DRq она по неизвестным причинам вообще отсутствует. Гомологом такого инвариантного гена у мышей является Еа. Число аллелей различных генов, представленное на рис. 3.7, выявлено для кавказской популяции (белой расы). Индейцы Америки и коренное население Востока имеют дополнительные аллели. Крайне высокий уровень аллельных генов и доминирующее присутствие в популяции гетерозигот при условии кодоминантного наследования обусловливает индивидуальность особей вида по антигенам МНС
Долгое время биологический смысл столь выраженного полиморфизма оставался непонятным, хотя какое-то (?) селективное значение такой аллельной изменчивости было очевидным. В последние несколько лет доказано, что подобный полиморфизм прямо связан с процессом презентации антигенных эпитопов Т- клеткам.
Аллельные формы антигенов МНС могут отличаться друг от друга по 20 аминокислотным остаткам. Большинство из аминокислотных замен локализовано в N-концевой части молекул и
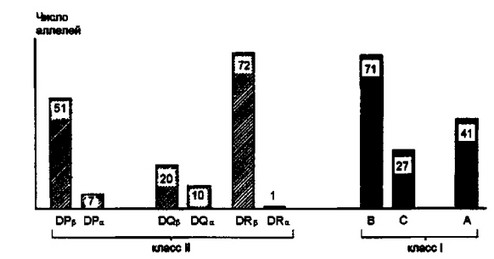
Рис. 3.7. Число аллельных форм молекул I и II классов главного комплекса гнстосовместнмосги у человека.
Видно, что среди молекул II класса наибольшей вариабельностью обладают DPp и DRp; DRa вообще не имеет аллельных форм. Наибольшая вариабельность среди молекул I класса характерна для полипептида В, хотя А и С также обладают значительным числом аллельных вариантов
главным образом в доменах, формирующих антигенсвязывающий участок (рис. 3.8). Именно в этой изменчивости аминокислотной последовательности антигенсвязывающего участка заключена потенциальная возможность взаимодействовать с различными пептидами.
С полиморфизмом антигенов МНС связано такое явление, как генетический контроль иммунного ответа. В тех случаях, когда аминокислотные остатки, образующие щель у антигенов II класса, не в состоянии связать пептидный фрагмент чужеродного антигена, Т-хелперы остаются ареактивными и их помощь В-клет- кам не реализуется. Это обстоятельство и является причиной генетически детерминированного дефекта в иммунном реагировании (подробно см. гл. 3,10).
Основные события, которые привели к формированию разнообразия генов МНС в процессе эволюции, связаны с тандемными дупликациями, точечными мутациями, рекомбинацией и конверсией генетического материала. Тандемные дупликации — процесс повторения исходного гена на той же самой хромосо-
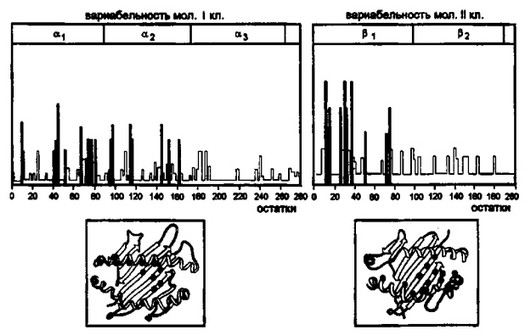
Рис. 3.8. Вариабельные положения в аминокислотной последовательности молекул I и II классов главного комплекса гистосовместимости.
Аллельные варианты молекул I и II классов обусловлены заменами аминокислотных остатков, входящих в состав ар и аг-домеиов молекул I класса и р г домен молекул II класса. Именно эти домены формируют антигенсвязывающий участок. Черные столбцы — уровень вариабельности отдельных положений в ар и ррдоменах соответственно; светлые столбцы — то же для а2- и р2-доменов; вариабельность аз крайне низкая — на рисунке не обозначена. Черные кружки (нижняя часть рисунка) — наиболее вариабельные положения аминокислотных остатков в антигенсвязывающей области.
ме — хорошо известны для многих генетических систем, контролирующих синтез белков, например иммуноглобулинов. Именно в результате этого процесса возникло несколько полигенных форм антигенов и I, и II классов. Спонтанные замены отдельных нуклеотидов в процессе редупликации ДНК (точечные мутации) также хорошо известны, они приводят к формированию аллельных генов, которые определяют полиморфизм белков. Рекомбинации между отдельными участками гомологичных хромосом в процессе мейоза могут привести к обмену как целых участков этих хромосом, так и отдельных генов и даже частей генов. В последнем случае процесс называется генной конверсией. Мутации, рекомбинации и конверсия генов создают многообразие их аллельных форм и определяют полиморфизм антигенов МНС.
