При использовании рентгеноструктурного анализа удалось показать, что щель, образуемая а-спиральными последовательностями lt;*1- и 012-доменами молекулы I класса и аг и (^-доменами молекулы II класса занята плотно упакованным пептидом. Площадь поверхности комплекса, которая контактирует с Т-клеточ- 96
Таблица 3.1
Особенности подготовки антигена к взаимодействию с молекулами
I и II классов главного комплекса гистосовместимости
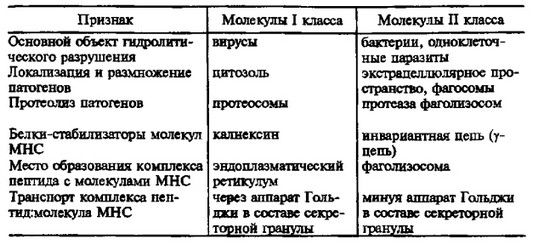
 ным антигенраспозн ающим рецептором, составляет около 60( Несмотря на значительный полиморфизм и политенностъ молекул МНС, каждая конкретная клетка, в которой происходит переработка антигена, обладает ограниченным количеством вариантов этих молекул. При этом количество пептидов, образующихся в результате протеолиза чужеродных антигенов, велико. В связи с этим возникает естественный вопрос: каким образом строится специфичность комплекса пептид:молекула МНС? Строгая кон- формационная специфичность, известная для взаимодействия антител или иммуноглобулиновых рецепторов с антигеном, в данном случае не может проявиться в силу ограниченности вариантов молекул I и II класса в клетке конкретного индивидуума. Изучение различных комплексов пептидов с молекулами МНС при их кристаллизации помогло выяснить картину связывания ограниченного числа молекул I и II классов МНС с различными фрагментами антигенов.
ным антигенраспозн ающим рецептором, составляет около 60( Несмотря на значительный полиморфизм и политенностъ молекул МНС, каждая конкретная клетка, в которой происходит переработка антигена, обладает ограниченным количеством вариантов этих молекул. При этом количество пептидов, образующихся в результате протеолиза чужеродных антигенов, велико. В связи с этим возникает естественный вопрос: каким образом строится специфичность комплекса пептид:молекула МНС? Строгая кон- формационная специфичность, известная для взаимодействия антител или иммуноглобулиновых рецепторов с антигеном, в данном случае не может проявиться в силу ограниченности вариантов молекул I и II класса в клетке конкретного индивидуума. Изучение различных комплексов пептидов с молекулами МНС при их кристаллизации помогло выяснить картину связывания ограниченного числа молекул I и II классов МНС с различными фрагментами антигенов.
Антигенные пептиды (Т-клеточные эпитопы), которые образуют связь с молекулами I класса МНС, обычно включают 8-10 аминокислотных остатков. N- и С-концевые аминокислоты таких пептидов взаимодействуют с инвариантными аминокислотными остатками, входящими в состав антигенсвязывающего желобка молекулы I класса МНС. В зависимости от длины пептида возможен их изгиб в той или иной степени. Аллельные варианты молекул I класса взаимодействуют с разными пептидами. В то же время молекулы одной определенной аллели взаимодействуют со сходными, хотя и неидентичными пептидами. Сходство пептидов определяется в первую очередь наличием так называемых якорных участков — гидрофобных аминокислотных остатков, расположенных у
" i.iK. 3701
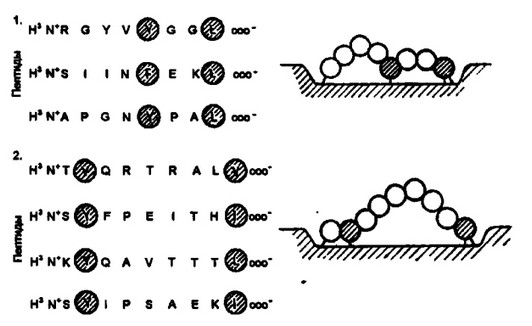
Рис.3.11.01вщфииююмодайстияа1ииг1М1ш пипвдо» с молекулами I класс* главного комплекса гнстооовйестнмостя.
С каждой аллельной формой молекулы I класса взаимодействует определенное число близких, хотя и неидентичных пептидов (панель 1 или 2; представлены пептиды, взаимодействующие с двумя отличающимися аллельными формами молекул I класса). Взаимодействие таких пептидов происходит через относительно инвариантные гидрофобные аминокислотные остатки, получившие название якорных, которые образуют ковалентную связь с реактивными группами антигенсвя- зывающего участка молекулы I класса. Поскольку расстояние между реактивными группами антигенраспознающего участка может быть короче длины пептида между якорными остатками, то возможна разная форма изгиба у взаимодействующего пептида. Возникающая форма изгиба в линейной последовательности аминокислотных остатков пептида собственно и распознается рецептором Т-клеток
разных пептидов в тех же самых положениях (рис. 3.11).
Пептиды, которые связываются молекулами 11 класса МНС, имеют большую длину и включают по крайней мере 13 аминокислотных остатков. Они располагаются в виде вытянутого отрезка в щели, образованной а-спиральными последовательностями аг и Pi-цепей. В отличие от молекул I класса инвариантные аминокислотные остатки антигенсвязывающего желобка молекул II класса Не образуют связи с концевыми аминокислотами пептидов. Однако якорные взаимодействия, очевидно, существуют, хотя молекулярная природа таких взаимодействий еще не понята.
3.2.3. Строение и генетический контроль Т-клеточных антигенраспознающнх рецепторов
3.2.3.1. Краткая характеристика
Попытки выявить Т-клеточные антигенраспознающие рецепторы (ТКР) с помощью антииммуноглобулиновых антител, как
Каждая функционально зрелая Т-клетка имеет около ЗЮ4 ТКР. Они представляют собой гетеродимер, построенный из а- и. (3-цепей, ковалентно связанных между собой цистеиновым мостиком. Каждая цепь состоит из вариабельного V- домена и константного С-домена, гомологичных соответствующим доменам иммуноглобулинов (рис. 3.13).В структуре ТКР представлен также шарнирный домен с цистеиновым остатком, который образует дисульфидный мостик, объединяющий а- и (3-цепи в единую молекулу. На клеточной мембране ТКР удерживается гидрофобной трансмембранной последовательностью аминокислотных остатков. Характерной чертой трансмембранного домена является присутствие в нем положительно заряженных аминокислотных остатков. Заканчивается каждая цепь коротким цитоплазматическим хвостом, погруженным в цитоплазму.

Отличие ТКР от иммуноглобулинового рецептора состоит в том, что он одновалентен, в то время как аналогичный рецептор В-клеток двухвалентен. Кроме того, ТКР не секретируется во внеклеточное пространство, что также отличает его от иммуноглобулинового рецептора. Однако все эти различия не могут считаться определяющими, так как основное свойство — построение активного антпгенраспознающего участка за счет взаимодействия двух V-доменов — остается общим.
