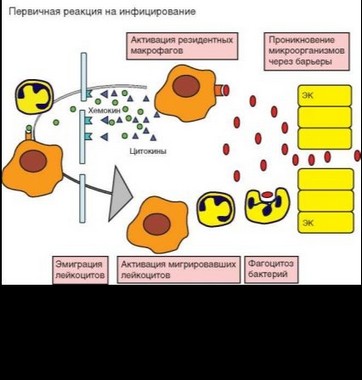
При развитии воспаления под влияние провоспалительных факторов быстро попадают клетки эндотелия мелких сосудов — капилляров и
посткапиллярных венул. В качестве факторов при этом выступают прежде всего цитокины, секретируемые макрофагами и другими вовлекаемыми в воспаление клетками, — IL-1P и TNFa (рис. 2.23). Эндотелиальные клетки конститутивно экспрессируют рецепторы для этих цитокинов. Под влиянием цитокинов происходит активация эндотелиальных клеток с трансформацией из плоских в высокие клетки и экспрессией ряда мембранных молекул, включая Р- и Е-селектины, рецепторы L-селектинов (адрессины) и интегринов (ICAM-1, VCAM-1), а также секрецией провоспалительных цитокинов и хемокинов.
На лейкоцитах крови конститутивно экспрессированы L-селектины, рецепторы для Р- и Е-селектинов (PSGL-1 и другие адрессины), а также интегрины LFA-1, Мас-1, p150,95 и aDP2, находящиеся в неактивной (свернутой) форме. Взаимодействие молекул адгезии лейкоцитов и активированных клеток эндотелия служит основой процесса эмиграции лейкоцитов из кровяного русла. Процесс осуществляется в 4 стадии (рис. 2.24).
• Стадия 1 (стадия качения). В описанной выше исходной ситуации имеются условия для взаимодействия L-селектинов лейкоцитов пристеночного слоя с адрессинами на эндотелиальных клетках, а также E- и P-селектинов эндотелиальных клеток с адрессинами лейкоцитов. Поскольку это взаимодействие слабое (из-за невысокого сродства и легкого смывания селектинов
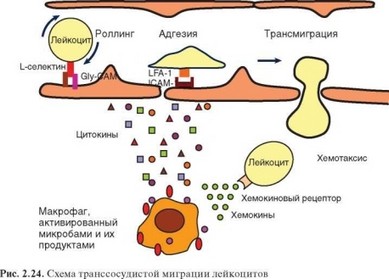
с поверхности клеток), лейкоциты взаимодействуют с клетками сосудистой стенки непрочно и клетки перекатываются вдоль стенки капилляра или венулы по направлению тока крови. Эта фаза занимает 1—5 с.
- Стадия 2 (стадия активации). Хемокины, продуцируемые эндотелиальными клетками (IL-8 и др.), воздействуют на рецепторы лейкоцитов и вызывают их активацию с участием ГТФ-связывающих белков семейства Rho. Одновременно с этим происходит слабое взаимодействие неактивных молекул LFA-1 и других лейкоцитарных интегринов с их рецепторами, экспрессированными под влиянием цитокинов на поверхности эндотелиальных клеток. При этом генерируется сигнал типа «снаружи внутрь» (см. раздел 2.3.1.2) и происходит «активация интегринов» — развертывание молекулы и «открытие» ее головной части, что многократно повышает сродство интегринов к их рецепторам. Эта стадия занимает до 20 с.
- Стадия 3 (стадия прочной адгезии). В результате описанных выше изменений взаимодействие лейкоцитарных интегринов с рецепторами эндотелиальных клеток становится прочным, и клетки останавливаются. Во взаимодействии со стороны лейкоцитов участвуют преимущественно молекулы LFA-1, а со стороны эндотелия — ICAM-1. Эта стадия длится несколько минут.
- Стадия 4 (стадия экстравазации). После остановки лейкоцит становится доступным для хемотаксических сигналов, поставляемых хемокинами и другими хемотаксическими факторами (пептиды fMLP, С3а, С5а, лейкотри- ен D4 и др.). В продвижении между эндотелиальными клетками решающая роль принадлежит гомотипическим (подобное с подобным) взаимодействиям 2 типов, осуществляемых молекулами PeCAM (CD31) и CD99. PeCAM участвует в проникновении лимфоцита в межэндотелиальное пространство и выходе из него, а CD99 — в преодолении зоны контакта между эндотелиальными клетками. Экстравазация лейкоцита занимает до 10 мин.
Дальнейшее продвижение лейкоцитов осуществляется за счет адгезивных взаимодействий с межклеточным матриксом и хемотаксического вектора, задаваемого гуморальными факторами, исходящими из очага воспаления. В адгезивных взаимодействиях участвуют ргинтегрины лейкоцита (молекулы серии VLA) и белки матрикса — фибронектин, ламинин, коллаген. Наиболее важные хемотаксические агенты — факторы, вызывающие экстравазацию: бактериальные пептиды fMLP, а также группа эндогенных хемотаксичес- ких факторов, синтезируемых de novo в очаге воспаления (преимущественно макрофагами) или образующихся при расщеплении других факторов (компонентов комплемента). К эндогенным хемотаксическим факторам относят фрагменты компонентов комплемента С3а, С5а, липидные метаболиты (лейкоториен D4 и фактор агрегации тромбоцитов), а также хемокины. Как уже отмечалось, хемокины различаются по способности привлекать разные типы лейкоцитов. Особенно четко такие различия проявляются в отношении нейтрофилов и моноцитов. Хемотаксической активностью в отношении нейтрофилов обладают а-хемокины (IL-8, факторы группы GRO и т.д.), а в отношении моноцитов — в-хемокины (факторы групп MCP и MIP).
Обязательное условие направленного движения клеток — градиент хемо- таксических факторов. Показано, что перепад концентрации фактора должен составлять не менее 1% на дистанцию, равную диаметру клетки.
Однако наиболее важна для осуществления хемотаксиса активная направленная подвижность клеток. В основе движения лейкоцитов лежит реакция контрактильных белков цитоскелета, прежде всего актина. Мобилизация компонентов цитоскелета происходит при активации через родопсиноподобные рецепторы хемотаксических факторов (см. выше). Вследствие поляризации и происходящей при этом реорганизации цитоскелета клетка из округлой становится треугольной. В сторону объекта хемотаксиса выдвигается ламеллоподий — участок цитоплазмы, бедный органеллами, но содержащий сеть микрофиламентов, в частности нитчатый (filamentous) F-актин. Ориентацию клетки в процессе хемотаксиса определяет полимеризация микротрубочек, а процесс движения — сокращение микрофиламентов.
Некоторая часть мембранных гликопротеинов перемещается в сторону полюса поляризации, на котором значительно усиливается экспрессия в2-интегринов. Аппарат Гольджи переориентируется в направлении движения клетки. Происходит конформационная перестройка (ремоделирование) фосфолипидов мембраны. При этом клетка секретирует эластазу, коллаге- назу и катепсины, что способствует преодолению базальных мембран вокруг сосудов и под эпителиальными пластами, а также других «преград».
Как известно, раньше других клеток в очаг воспаления мигрируют нейтрофилы, существенно позже туда попадают моноциты. Однако скорость хемотаксического перемещения нейтрофилов и моноцитов сопоставима (около 15 мкм/мин, т.е. почти 1 мм/ч). Различия во времени их проникновения в очаг воспаления связаны в значительной степени с разной исходной локализацией: нейтрофилы преобладают в пристеночном слое сосудистого русла и быстрее начинают движение к очагу воспаления.
