Микроорганизмы выработали способы нейтрализации факторов кисло- родзависимой бактерицидности, а также NO и связанных с ним азотсодержащих соединений, основанные на действии бактериальных супероксиддис-
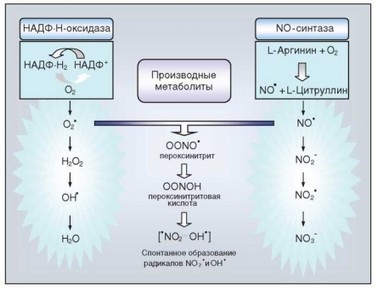
мутаз, каталаз и др. Однако у фагоцитов сформировались альтернативные механизмы бактерицидности.
Закисление внутренней среды фаголизосомы
При эндоцитозе содержимое эндосом закисляется. Для ранних эндосом характерны слабокислые значения рН (6,0—6,5). В содержимом поздних эндосом рН составляет 5,5—6,0, а в лизосомах — lt;5,0. Аналогичные изменения рН происходят при созревании фагосом. Закисление содержимого гранул — необходимое условие их слияния с фагосомами. Последовательное закисление среды в эндосомах — результат активности V-АТФазы — сложного белка, перекачивающего протоны из цитозоля в гранулы. V-АТФаза состоит из нескольких субъединиц. V-АТФаза отсутствует в фагосомах, но доставляется в них с лизосомами. В нейтрофилах V-АТФаза содержится во всех разновидностях гранул, кроме специфических (отсюда нейтральная реакция их содержимого). В фаголизосомах рН составляет 4,5—5,0. В фаголизосомах нейтрофилов pH среды несколько выше, чем в аналогичных структурах макрофагов. Это связано с более активной работой в нейтрофилах NADPH-оксидазы, сопряженной с потреблением протонов для формирования перекиси водорода. Кроме того, активные формы кислорода ослабляют активность V-АТФазы.
Закисление среды фаголизосомы оказывает бактериостатическое и бактерицидное действие, поскольку при значениях рН, близких к 4,5, снижает
ся электростатический потенциал клеток микроорганизмов, что приводит к нарушению поступления в них питательных веществ. Кроме того, кислая среда способствует активации большинства ферментов (особенно из азу- рофильных гранул), обладающих бактерицидной и бактериолитической активностью. Продукты, выделяющиеся при разрушении микроорганизмов, усиливают закисление.
Ферменты
При описании азурофильных и специфических гранул нейтрофилов уже перечисляли содержащиеся в них ферменты (общее число ферментов, выявляемых в фаголизосомах — более 60). Как известно, сначала с фагосо- мами сливаются специфические гранулы, содержащие ферменты, активные при нейтральных и слабощелочных значениях рН (именно такой pH имеет среда фагосом на данном этапе): щелочную фосфатазу и лизоцим, входящие в группу катионных белков (см. далее).
Азурофильные гранулы доставляют в фаголизосомы широкий набор кислых гидролаз и других ферментов, активных при кислых значениях рН: мие- лопероксидазу, 5’-нуклеотидазу, p-арилсульфатазу, p-глюкуронидазу, кислую глицерофосфатазу, а также гликозидазы. Азурофильные гранулы — дополнительный источник лизоцима и лактоферрина. Из азурофильных гранул в фаголизосому поступают также нейтральные протеазы, объединяемые в группу серпроцидинов, — еще одних представителей катионных белков.
Большинство сосредоточенных в фаголизосомах ферментов участвуют в расщеплении убитых микроорганизмов.
Катионные белки
В составе катионных белков преобладают щелочные аминокислотные остатки (что и определяет их катионность). Среди катионных белков есть как обладающие ферментативной активностью (лизоцим и серпроцидины), так и конкурентные белки, бактерицидное действие которых основано на связывании жизненно важных для патогенов веществ (лактоферрин, витамин В12-связывающий фактор).
Лизоцим — катионный белок. Его молекулярная масса 15 кДа, изоэлектрическая точка (pI) — 10. Лизоцим — фермент, обладающий активностью мурамидазы. Действуя на гликановый компонент молекул, лизоцим вызывает деполимеризацию пептидогликанов клеточной стенки микроорганизмов, тем самым нарушая ее целостность. Обычно субстрат лизоцима в интактной клетке маскирован поверхностными молекулами. В связи с этим активность лизоцима проявляется только при его комбинации с другими ферментами, например, в фаголизосоме.
Серпроцидины (от Serine protease cidin) — группа гомологичных белков, обладающих протеазной активностью, включающая катепсин G, эластазу, азурацидин и протеиназу-3. Молекулярная масса серпроцидинов варьирует от 25 до 29 кДа. Щелочной характер этих белков обсуловлен высоким содержанием аргинина и амидированных форм дикарбоновых аминокислот (глутамин, аспарагин). Некоторые серпроцидины присутствуют не только в нейтрофилах, но и в моноцитах. Эти белки обладают микробоцидной активностью, не коррелирующей с протеолитической активностью. In vitro серпорцидины действуют на грамположительные и грамотрицательные бактерии, простейших, патогенные грибы, а также на клетки эукариот. Наибольшей микробоцидностью обладает катепсин, наименьшей — эласта- за и протеиназа-3. Однако выключение гена эластазы значительно снижает гибель фагоцитированных микроорганизмов. Часто серпроцидины действуют совместно и при этом оказываются более эффективны, чем по отдельности. Катепсин G сохраняет микробицидную активность даже во фрагментированном состоянии. Активность серпроцидинов вне клеток подавляется ингибиторами сериновых протеиназ серпинами. Серпроцидины структурно и функционально родственны гранзимам цитотоксических лимфоцитов.
Лактоферрин — катионный белок, служащий маркером специфических гранул. Для него характерна способность формировать прочный комплекс с двумя ионами Fe3+ или других металлов с переменной валентностью. Взаимодействие происходит с участием ионов бикарботата. При связывании ионов железа образуется вещество красного цвета, что определило первоначальное обозначение лактоферрина как «красного белка».
Способность лактоферрина связывать ионы железа — основа его бактерицидного действия. Лактоферрин образует хелаты с ионами Fe3+ и создает их дефицит. Ионы железа участвуют в разнообразных жизненно важных процессах микроорганизмов, включая размножение. Секвестрирование ионов железа некоторые авторы рассматривают как один из фундаментальных механизмов защиты макроорганизма не только от инвазии патогенов, но и от роста опухоли. Бактериостатическое действие лактоферрина, основанное на конкуренции за ионы железа, — реальный механизм врожденного иммунитета. Помимо этого показана возможность прямого микробоцид- ного действия лактоферрина на некоторые патогены, однако оно выражено достаточно слабо.
BPI-протеины (от Bacteria permeability inducing) — белки, повышающие проницаемость бактериальной стенки — образуют еще одну группу катионных белков с бактерицидной активностью. Молекулярная масса BPI-протеинов составляет 59 кДа. Они представлены в нейтрофилах и эозинофилах. Как и другие катионные белки, BPI-протеины обогащены основными аминокислотными остатками, в частности лизином, и содержат гидрофобные участки. Их изоэлектрическая точка (р!) составляет около 9,5. Белки этой группы действуют на грамотрицательные бактерии, распознавая ЛПС (они гомологичны ЛПС-связывающим белкам). BPI-протеины связываются с поверхностью бактерий при помощи электростатических взаимодействий. При проникновении в мембрану BPI-протеины проявляют сродство к ЛПС, блокируя его активность (это может быть основанием для их возможного клинического применения). Литическое действие BPI-протеинов коррелирует с повышением проницаемости бактериальной стенки для белков.
Бактерицидные пептиды
Бактерицидные, или антибиотические, пептиды — наиболее интенсивно изучаемые бактерицидные факторы многоклеточных. Выделяют несколько групп бактерицидных пептидов, из которых наиболее известны дефензины и кателицидины.
Дефензины — катионные пептиды молекулярной массой 3—5 кДа (обычно содержат около 30 аминокислотных остатков), с характерным высоким содержанием остатков аргинина и других основных аминокислот (лизина, гистидина), а также гидрофобных аминокислот (валина, лейцина, пролина и т.д.). Основные и гидрофобные аминокислоты пространственно разобщены, что придает молекуле пептида амфипатичность. Для дефензинов характерна в-складчатая структура. Важнейшее их свойство — наличие 6 остатков цистеина, формирующих 3 дисульфидные связи. В зависимости от расположения этих связей выделяют а-, в- и 0-дефензины. Для а-дефензинов характерно следующее распределение дисульфидных связей (указаны номера остатков цистеина, скрепляемых связью): 1—6, 2—4, 3—5. Связь между 1-м и последним (6-м) остатками цистеина делает молекулу циклической. Эта цикличность не характерна для в-дефензинов, тогда как 0-дефензины образуют цикл за счет пептидной связи между крайними, не цистеиновыми остатками.
У человека описано 6 разновидностей а-дефензинов. Дефензины группы а — важный компонент фаголизосом нейтрофилов: на их долю приходится 5—7% общего белка нейтрофилов. Нейтрофилы содержат 5 разновидностей а-дефензинов. Они представлены также в некоторых макрофагах (например, легочных). В эпителиальных клетках (в частности, в эпителии крипт слизистой оболочки кишечника) присутствуют 2 другие разновидности а-дефензинов. У человека известно 2 в-дефензина, локализованых в эпителии дыхательных путей, но не в лейкоцитах.
Кателицидины (пептиды, гомологичные кателину) — положительно заряженные амфипатические пептиды. В их структуре преобладают а-спирали- зованные участки. Кателицидины содержат функционально важный домен, гомологичный катепсину L (кателину). В нейтрофилах человека присутствует 1 вариант кателицидинов — LL-37.
Бактерицидные пептиды проявляют антибактериальную, антимикотическую и антивирусную активность. Их бактерицидность связана с особенностями их строения. Взаимодействие дефензинов с клетками микроорганизмов не зависит от рецепторов и обусловлено электростатическими взаимодействиями положительно заряженных остатков собственных аминокислот с отрицательно заряженными группами (в составе пептидо- гликанов, ЛПС и др.) на поверхности патогенов. В реализации следующей фазы взаимодействия дефензинов с патогеном решающая роль принадлежит амфипатичности структуры этих пептидов: положительно заряженные группы продолжают контактировать с анионными молекулами клеточной стенки, а гидрофобные участки способствуют внедрению молекулы в клеточную мембрану патогена, что приводит к нарушению ее целостности. Существует несколько моделей, описывающих летальное действие дефензи- нов. Согласно одной из них («сборка бочки»), мономер пептида встраивается в клеточную стенку микроорганизма, затем к этому мономеру последовательно присоединяются другие. В результате формируется трехмерная циклическая структура («бочка»), образующая канал, через который проходят ионы и более крупные молекулы (гидрофобные участки дефензинов при этом связаны с компонентами мембраны микроорганизма, а гидрофильные участки обращены внутрь микроба). Нарушение целостности мембраны и изоляции внутренней среды микроорганизма от окружения приводит к его гибели.
Дефензины локализованы и оказывают свое действие преимущественно внутри нейтрофилов, точнее, в их фаголизосомах. Однако в результате секреции дефензины могут поступать во внеклеточное пространство и проявлять там свои бактерицидные свойства. Однако эта возможность ограничена содержанием в плазме крови и межклеточной жидкости серпинов — ингибиторов сериновых протеаз, подавляющих действие дефензинов. Во внеклеточном пространстве дефензины проявляют хемокиноподобные и иммунорегуляторные свойства при более низких концентрациях, чем в фаголизосомах.
