Защита от инфекций — основное предназначение иммунитета. Первоначально иммунитет определяли как устойчивость к инфекционным заболеваниям. С разработки методов вакцинации, т.е. создания искусственного иммунитета началось развитие иммунологии, причем не только в донаучной, эмпирической форме, но и в форме самостоятельной науки. До сих пор усилия исследователей в области прикладной иммунологии направлены в первую очередь на разработку и совершенствование методов иммунопрофилактики и иммунотерапии инфекционных заболеваний.
- Инфекционные агенты как иммуногены. Запуск противоинфекционного иммунитета
Основы фундаментальной иммунологии создавались на базе экспериментальных исследований с использованием модельных систем, которые не всегда можно отождествить с естественными процессами, происходящими при инфицировании организмов. Поэтому имеет смысл соотнести все общие закономерности иммунитета с их конкретными проявлениями при инфекционных заболеваниях. Начать следует с событий, связанных с запуском реакций иммунитета при инфекционных процессах.
Пути поступления и распространения в организме инфекционных агентов
Пути проникновения инфекционных агентов определяют не только локализацию патологического процесса, но и особенности иммунной защиты. В подавляющем большинстве случаев инфекционные агенты попадают в организм через слизистые оболочки в трех основных трактах — дыхательном, пищеварительном и урогенитальном. В связи с этим наиболее ранние иммунологические события при инфекционных процессах связаны с иммунной системой слизистых оболочек (см. 3.4.2.3). На ранних этапах инфекции реакцию слизистых оболочек опосредует вовлечение клеток и гуморальных факторов врожденного иммунитета.
Дальнейшие процессы могут ограничиться органами, в которые проник инфекционный агент, особенно когда последний обладает троп- ностью к клеткам определенных типов, что особенно характерно для
внутриклеточных патогенов. Однако чаще инфекционный фактор имеет склонность к распространению лимфогенным или гематогенным путями. Лимфогенным путем он попадает в региональные лимфатические узлы, которые становятся очередной (после места проникновения) площадкой для реализации иммунной защиты. В лимфатических узлах к факторам врожденного иммунитета подключаются клетки и гуморальные факторы адаптивного иммунитета, инициируемого на этом этапе процесса. Преодоление данного барьера приводит к генерализации инфекционного заболевания, а вслед за этим — к распространению иммунных процессов на системный уровень, что не всегда приводит к адекватному результату и граничит с состоянием патологии, обусловленной повреждающим действием не только инфекционных агентов, но и самих факторов иммунитета.
Значение для иммунных процессов локализации инфекционных агентов вне или внутри клетки
Как было показано выше (см. раздел 3.6), в зависимости от локализации патогена адекватными (т.е. эффективными) являются различные механизмы иммунной защиты (табл. 4.1). Внеклеточные патогены могут быть нейтрализованы антителами, с помощью которых к ним могут быть привлечены эффекторные факторы врожденного иммунитета. Патогены, локализующиеся в гранулах, могут быть уничтожены факторами врожденного иммунитета (бактерицидные компоненты фагоцитов), стимулированными Т-лимфоцитами и их цитокинами. Патогены, интегрированные в геном или локализованные в цитозоле, уничтожаются вместе с инфицированной клеткой цитотоксическими лимфоцитами — естественными (NK) или адаптивными (Т). Наконец, особые (пока недостаточно полно охарактеризованные) способы защиты адресованы внеклеточным патогенам, локализующимся на поверхности слизистых оболочек.
Таблица 4.1. Локализация патогенов и эффективные пути иммунной защиты
|
Локализация патогенов |
Примеры |
Антигенпре- зентирующие клетки |
Т-хелперы, ключевые цитокины |
Эффекторные механизмы и факторы |
|
Внекле точная (внутри организма) |
Все патогены (бактерии, вирусы, грибы, простейшие) проходят фазу внеклеточного существования; для многих это основное место обитания |
Макрофаги, В-клетки, дендритные клетки |
Th2 (IL-4) |
Фагоцитоз, антитела, комплемент |
|
Внеклеточная (на поверхности слизистых оболочек) |
Neisseria gonor- rhoeae, Candida albicans, Vibrio cholerae, Helicobacter pylori, гельминты |
В-клетки, тучные и дендритные клетки |
Th2 (IL-5, IL-4) |
Антитела классов IgE, IgA, тучные клетки, эозинофилы, макрофаги |
Окончание табл. 4.1
|
Локализация патогенов |
Примеры |
Антигенпре- зентирующие клетки |
Т-хелперы, ключевые цитокины |
Эффекторные механизмы и факторы |
|
Внутриклеточная (в ядре, цитозоле) |
Вирусы, хламидии, риккетсии, листе- рии, простейшие |
Дендритные клетки |
Th1 (IL-2) |
Цитотоксические Т-лимфоциты, NK-клетки |
|
Внутриклеточная (в гранулах) |
Микобактерии, лейшмании, легио- неллы, трипаносомы, криптококки, гистоплазмы, Yersinia pestis |
Дендритные клетки, макрофаги |
Th1 (IL-12, IFNy) |
Макрофаги, CD4+ Т-клетки |
Яркое проявление адаптации системы иммунитета к взаимодействию с патогенным окружением — осуществление адекватного выбора пути ответа уже на этапе распознавания антигена. Этот выбор осуществляют клетки инициаторы иммунного ответа — дендритная клетка и CD4+ Т-лимфоцит. Дендритная клетка выбирает различные пути презентации антигена (в составе молекул МНС I или II класса), что диктуется вне- или внутриклеточной локализацией возбудителя. Кроме того, дендритная клетка генерирует различные сигналы в зависимости от химической природы и физико-химических характеристик его «опознавательных» молекул. СD4+ Т-клетка, в зависимости от сигналов, поступающих через TCR и костимулирующие молекулы от дендритной клетки, делает выбор между несколькими альтернативными вариантами дифференцировки Т-хелперов, которые обеспечивают развитие адекватной формы ответа. Механизмы, с участием которых реализуется влияние патогенов на выбор иммуноцитами пути иммунного ответа, пока неясны. Полное и точное знание таких механизмов необходимо для создания вакцинных препаратов, которые включали бы «правильное направление» ответа и обладали в связи с этим максимальной протективной эффективностью. Ошибки при выборе пути дифференцировки чреваты неблагоприятным исходом заболевания. Классический пример — зависимость успешности иммунной защиты мышей разных линий при инфицировании лейшманиями от избираемого пути дифференцировки Т-хелперов (см. раздел 3.5.3.1). В этом примере выбор адекватной формы иммунного ответа определяется генетическими особенностями организма хозяина.
Аналогичные, хотя и менее четкие примеры могут быть найдены в патологии человека. Так, установлено, что характер течения лепры зависит от генетически детерминированного выбора Th1- или ^2-зависимого пути иммунной защиты от микобактерий. Адекватный механизм защиты от M. leprae — развитие TM-зависимого клеточного иммунного ответа воспалительного типа. При выборе этой формы иммунного ответа развивается туберкулоидная форма проказы — относительно мягко текущая и поддающаяся медикаментозному контролю. При развитии альтернативной формы защиты — ^2-зависимого гуморального иммунного ответа — развивается лепроматозная форма проказы — тяжелое неизлечимое заболевание.
Поверхностные структуры микроорганизмов и их взаимодействие с рецепторами клеток иммунной системы
Антигены микроорганизмов изучены достаточно полно. Их описание содержатся в курсах микробиологии. Мы остановимся только на некоторых особенностях этих антигенов, важных для развития противоинфекционной иммунной защиты.
Антигенная структура бактерий определяется главным образом особенностями строения их клеточной стенки. Структура клеточных стенок различных бактерий представлена на рис. 4.1. Основу клеточной стенки всех микроорганизмов составляют пептидогликаны, в состав которых входят остатки мурамиловой кислоты и пептидные компоненты. У грамположи- тельных бактерий мурамилпептиды являются поверхностными структурами. На поверхности грамотрицательных бактерий поверх мурамилпептидов локализуется липидный бислой, в составе которого присутствуют ЛПС, играющие роль эндотоксинов. Основа ЛПС — полисахарид, соединенный с короткими группами липида А, обусловливающего токсичность ЛПС. С ним связано также большинство проявлений биологической активности ЛПС. Поверхность микобактерий имеет дополнительные компоненты в виде гликолипидов, миколевой кислоты, липоарабиноманнана и т.д. Своими особенностями отличаются структуры поверхностей грибков, простейших, риккетсий и других микроорганизмов, выступающих в качестве патогенов.
Главная особенность, характерная для многих молекул поверхности патогенных микроорганизмов, — способность взаимодействовать с мембранными структурами клеток иммунной системы, относимыми к группе патогенрас- познающих рецепторов, в первую очередь — с мембранными структурами TLR. То есть поверхностные молекулы патогенов выступают в качестве
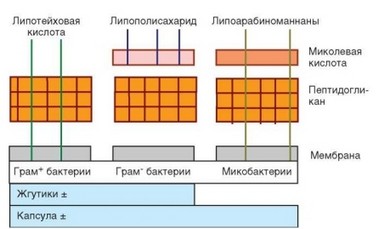
Рис. 4.1. Структура клеточной стенки бактерий различных групп. Отражено слоистое строение клеточной стенки бактерий, различное у грамположительных, грамотрицательных бактерий и микобактерий (модифицировано по А. Ройту)
«образов патогенности» — PAMP. Таким образом, химические особенности поверхности патогенов определяют реакцию на них клеток врожденного иммунитета (в первую очередь миелоидных клеток, участвующих в запуске воспалительной реакции и обладающих фагоцитарной активностью — нейтрофилов, моноцитов, макрофагов). К той же группе относят дендритные клетки, которые не только вносят прямой вклад во врожденный иммунитет, но и отвечают за включение адаптивного иммунитета. Свойствами PAMP обладают и некоторые молекулы, расположенные в более глубоких слоях клеточной стенки (в частности, пептидогликаны, которые экспонированы на поверхности только грамположительных бактерий). Однако рецепторы к таким PAMP локализованы не на поверхности клеток иммунной системы, а внутриклеточно. Так, внутриклеточные NOD-рецепторы распознают пептидогликаны, а TLR-9, локализующиеся в цитоплазматических гранулах, — CрG-последовательности бактериальной ДНК.
Классические клетки адаптивного иммунитета, лимфоциты, особенно в активированном состоянии, также несут TLR и некоторые другие пато- генраспознающие рецепторы. Однако характер их реакции на PAMP изучен плохо. Возможность ответа лимфоцитов на PAMP указывает на относительность разделенния иммунитета на врожденный и адаптивный. Во всяком случае, клетки адаптивного иммунитета сохраняют многие свойства клеток врожденного иммунитета, в частности, способность распознавать PAMP и реагировать на них.
Позже в эволюции на первый план выходит распознавание рецепторами лимфоидных клеток чужеродных молекул микроорганизмов в качестве антигенов. При этом значительная часть микробных антигенов относится к категории тимуснезависимых, т.е. не требует обязательного участия Т-клеток для запуска и «усовершенствования» гуморального иммунного ответа. Одни Т-независимые антигены (например, ЛПС) являются митогенами для В-кле- ток, т.е. относятся к ТН-антигенам I рода. Другие (например, бактериальные полисахариды) обеспечивают активацию В-клетки через кластеризацию BCR, т.е. относятся к ТН-антигенам II рода. В обоих случаях отсутствие участия Т-клеток в формировании ответа ограничивает его возможности — среди антител преобладают молекулы класса IgM, сродство которых к антигенным эпитопам невелико; вторичный ответ отсутствует или выражен слабо. Однако у Т-независимого ответа есть и преимущество — он развивается намного быстрее Т-зависимого. Поэтому он приемлем как реакция (пусть не очень совершенная), обеспечивающая защиту в период до формирования сильного Т-зави- симого адаптивного иммунного ответа. Напомним также, что гуморальный иммунный ответ актуален преимущественно для внеклеточных патогенов, а также для защиты от экзотоксинов. Однако подавляющее большинство патогенов имеет внеклеточную фазу существования, во время которой они доступны для воздействия антител. О природе антигенов и эпитопов, индуцирующих Т-клеточный иммунный ответ, известно меньше. Существенно, что распознавание образов патогенности TLR является фактором, благоприятствующим активации ТЫ-лимфоцитов и развитию клеточного иммунного ответа.
Антигенная структура вирусов схематично изображена на рис. 4.2. Вирусы состоят из нуклеокапсида, в котором расположен нуклеопротеид, включающий одну или несколько молекул нуклеиновой кислоты, связанных с
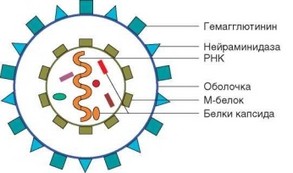
Рис. 4.2. Схема строения вируса гриппа
несколькими белками-ферментами, контролирующими процессы репликации (обратной транскриптазой и др.), а также другие белки (интегразы, полимеразы и др.). Нуклеокапсид имеет оболочку, в состав которой входит белок М. Иногда оболочку капсида «усиливают» липиды. Оболочка вируса содержит повторяющиеся белковые комплексы, предназначенные, с одной стороны, для защиты нуклеоида от действия нуклеаз, а с другой — для взаимодействия вируса с клетками организма-хозяина.
Запуск иммунных процессов, связанных с активацией врожденного иммунитета, зависит главным образом от распознавания вирусных нуклеиновых кислот (в случае ретровирусов — двуспиральной РНК) пато- генраспознающими рецепторами, локализованными не на поверхности, а в цитоплазматических гранулах клеток врожденного иммунитета (TLR-3, TLR-7, TLR-8, TLR-9). Оболочка вирусов содержит белки, распознаваемые в большей степени В-клетками и продуцируемыми ими антителами. В вирусе гриппа это гемагглютинин и нейраминидаза. Серотип вируса, определяющий специфичность образуемых антител, выражают формулой, содержащей обозначения типа этих молекул (например, H2N5).
Таким образом, патогены содержат ряд веществ, распознаваемых рецепторами врожденного и адаптивного иммунитета и обусловливающих мобилизацию механизмов естественного иммунитета, активацию лимфоцитов и их подготовку к участию в адаптивном иммунном ответе.
Важное свойство антигенных молекул патогенов состоит в их вариабельности (табл. 4.2), формируемой за счет мутационного процесса, расширяющего приспособительные возможности микроорганизмов (в том числе способность избегать негативного влияния факторов иммунной защиты в организме хозяина). Особенно высокий полиморфизм характерен для вирусов. Вариабельность некоторых их антигенов (гемагглютинин вируса гриппа, антигены оболочки ВИЧ) делает практически невозможным формирование защитного иммунитета и очень затрудняет предупреждение заболеваний с помощью вакцинации. Существует корреляция изменчивости антигенов и их роли в создании протективного иммунитета. Так, в случае гриппа оба эти свойства максимально выражены у поверхностного
белка гемагглютинина; существенно слабее — у другого поверхностного белка — нейраминидазы и отсутствуют у стабильного матриксного белка М. Вариабельность такого рода проявляется в изменении антигенного спектра вируса гриппа от эпидемии к эпидемии. Анализ типов гемагглютининов и нейраминидазы у вирусов, вызывавших эпидемии гриппа на протяжении 100 лет, показал, что эти типы постоянно изменяются: для гемагглютинина от одной эпидемии к следующей, для нейраминидазы — через 2—3 эпидемии. При этом спустя некоторое время (3—5 эпидемий) может наблюдаться возвращение ранее уже зарегистрированного серотипа.
Таблица 4.2. Типы вариабельности микроорганизмов и противоинфекционный иммунитет
|
Тип вариабельности |
Результат вариабельности |
Последствия для иммунной защиты |
Примеры |
|
Мутационный процесс внутри вида |
Различные серологические варианты (типы, субтипы) |
К каждому варианту формируется специфический механизм защиты |
Серотипы стрептококков, микроорганизмов кишечной группы и т.д. |
|
Антигенный дрейф (следствие серии точечных мутаций) |
Постоянно накапливающиеся изменения протектив- ных антигенов |
Сформировавшийся протек- тивный механизм срабатывает только частично; он не распространяется на конечные продукты изменчивости |
Изменчивость вируса гриппа по гемагглютинину |
|
Антигенный сдвиг (следствие обмена генетическим материалом между различными линиями микроорганизмов) |
Скачкообразно проявляющиеся изменения специфичности протек- тивных антигенов |
Сформировавшийся протектив- ный иммунитет не распространяется на измененные варианты |
Изменчивость вируса гриппа по гемагглютинину |
|
Смена вариантспецифических антигенов |
Поочередная экспрессия продуктов различных генов вариантспецифической серии |
В ходе заболевания патоген повторно выходит из-под контроля формирующихся иммунных механизмов, что определяет его ремиттирующее течение |
Сонная болезнь, вызываемая Tripanosoma brucei |
Антигенные свойства микробных антигенов могут изменяться даже в течение одной эпидемии, что приводит к развитию повторных заболеваний. Известно 2 основных механизма подобной изменчивости — дрейф (drift) и сдвиг (shift). Первый механизм — результат точечных мутаций в генах, кодирующих антиген, а второй — следствие обмена участков хромосомы между вирусами в организме промежуточного хозяина.
Еще один вариант изменчивости антигенной структуры патогенов представляют ситуации, когда специфичность антигена возбудителя изменяется в конкретном инфицированном макроорганизме. Это приводит к активации заболевания после его временного ослабления, а при повторяемости подобных изменений — к ремитирующему течению болезни. Такие явления могут возникать вследствие мутаций соответствующих генов возбудителя или смены генов, кодирующих антиген. Последняя ситуация характерна для трипаносомы, вызывающей сонную болезнь (Tripanosoma brucei). Трипаносомы имеют около 1000 генов (10% генома), кодирующих маркерный антиген — вариантспецифический гликопротеин. В течение заболевания происходит поочередная индукция разных генов этой группы по мере накопления антител к гликопротеину предшествующего типа.
Факторы патогенов, модифицирующие активность иммунной системы хозяина
Эволюция патогенов происходит параллельно и в прямой связи с эволюцией высших животных, служащих для них хозяевами. При этом микроорганизмы эволюционируют быстрее и лучше приспосабливаются к хозяину, в том числе к особенностям его иммунной системы. В связи с этим у бактерий и вирусов сформировалось множество механизмов, позволяющих блокировать или ослаблять действие иммунной системы или обходить ее эффекторные механизмы. Если PAMP и антигены возбудителей непосредственно запускают соответственно врожденную и адаптивную ветви иммунитета, направленные на защиту от патогенов, то другие их макромолекулы модулируют протективные реакции иммунитета, ослабляя их эффективность или полностью блокируя их. Рассмотрим некоторые группы иммуномодулирующих факторов патогенов.
Суперантигены и В-клеточные митогены
Поликлональный ответ лимфоцитов нельзя рассматривать как адаптивную реакцию, поскольку специфичность образующихся факторов (антител или эффекторных клеток) не связана с распознаванием патогенов и их продуктов. Фактически эта реакция не специфична. Этим обусловлена непродуктивность поликлонального ответа Т-лимфоцитов на суперантигены (см. раздел 3.2.2.4). Напомним, что в нее вовлечена большая группа клонов Т-клеток (до 20—30%), содержащих в рецепторе TCR в-цепи определенных семейств, обладающих сродством к суперантигену, взаимодействующему с боковой поверхностью молекулы MHC. Свойствами суперантигенов обладают многие бактериальные экзотоксины. Помимо поликлональной пролиферации суперантигены вызывают массированный выброс цитокинов активированными Т-клетками. Этот процесс тоже нельзя рассматривать как адекватную форму ответа на патоген. Он может вызвать патологические последствия. Наконец, такая реакция завершается массовым апоптозом Т-клеток, активированных суперантигеном. Это обусловливает потерю Т-клеток при некоторых инфекционных заболеваниях, в том числе вирусных, и может послужить причиной временной иммуносупрессии.
Микроорганизмы часто экспрессируют молекулы, митогенные для В-лимфоцитов. Обычно в низких дозах они выступают в качестве ТН-1- антигенов. Отрицательный эффект подобной реакции состоит в непроизводительных затратах энергии и пластического материала, вовлечении большого числа В-клеток в реакцию, лишенную протективного эффекта, а при ТН-1-ответе — в развитии неадекватного гуморального иммунного ответа, ограниченного вовлечением IgM-антител с низким сродством к антигенам и характеризующегося отсутствием иммунологической памяти.
Нужно отметить, что некоторые молекулы патогенов сочетают в себе свойства РАМР, антигенов и митогенов. Наиболее яркий пример — ЛПС. Он взаимодействует с патогенраспознающим рецептором TLR-4/CD14 и активирует клетки врожденного иммунитета, а также через активацию АПК и экспрессию на них костимулирующих молекул, содействует развитию адаптивного иммунного ответа. В высоких дозах ЛПС выступает в качестве митогена, препятствующего нормальному развитию гуморального иммунного ответа, а в малых дозах — как ТН-1-антиген, распознаваемый ВCR и запускающий специфический гуморальный ответ, хотя и в малопродуктивной форме.
Факторы, взаимодействующие с иммуноглобулинами
Некоторые микроорганизмы синтезируют белки, способные взаимодействовать с доменами Fc-конца тяжелой цепи, т.е. обладающие активностью Fс-рецепторов. Из них лучше других изучен белок А клеточной стенки Staphilococcus aureus (наиболее богат им штамм Cowan), широко используемый для выделения иммуноглобулинов и с другими исследовательскими целями. Белок А взаимодействует с участками доменов CH2 и CH3. Он конкурирует с Fcy-рецепторами за связывание с IgG. По-видимому, основная роль белка А «с точки зрения» стафилококка состоит в ослаблении эффекта опсонизации бактерий IgG-антителами, вследствие конкуренции этих молекул с Fcy-рецепторами. Кроме белка А известны другие белки, конкурирующие с иммуноглобулинами (белок G и др.).
Факторы, взаимодействующие с цитокинами
Большая группа факторов, продуцируемых патогенами, особенно вирусами, реализует свое модифицирующее действие на иммунный ответ через взаимодействие с цитокинами или воспроизведение их эффектов. Фактор, синтезируемый вирусом саркомы Шоупа, продуцирует растворимый фактор, связывающий TNFa и препятствующий его взаимодействию с рецепторами и, следовательно, развитию воспалительной реакции. Вирус осповакцины вырабатывает ингибитор сериновой протеазы ICA, необходимой, с одной стороны, для образования зрелой формы IL-1P, с другой — для реализации апоптоза. Вирус Эпштейна-Барр секретирует белок — продукт гена DCRF1, гомологичный IL-10 и воспроизводящий его эффекты, в частности, подавление секреции некоторых цитокинов и дифференцировки Thl-клеток, а также ориентацию иммунного ответа на гуморальный путь в ущерб клеточноопосредованному, играющему основную роль в защите от вирусов.
Факторы, связывающие компоненты комплемента
Вирус простого герпеса связывает С3Ь, а вирус коровьей оспы — C4b, тем самым вмешиваясь в работу системы комплемента, нарушая пути его актвиации (преимущественно — классический путь).
Факторы, влияющие на фагоцитоз
Патогены вырабатывают ингибиторы фагоцитоза, служащие наиболее мощным механизмом антибактериальной защиты. К ингибиторам этой группы относят прежде всего компоненты капсулы микроорганизмов (например, гиалуроновую кислоту грамположительных бактерий, белки шипов нейссерий или фимбрий стрептококков). Микобактерии, напротив, экспрессируют на поверхности белок, связывающий фибронектин, выступающий в качестве опсонина (поскольку распознается р1-интегри- нами поверхности фагоцитов). С другой стороны, микобактерии содержат внутриклеточные факторы, препятствующие слиянию фагосом с лизосо- мами, что необходимо для разрушения и переваривания содержимого фаго- сом. Таким образом микобактерия, благодаря опсонизации фибронектином «уходит» из опасной межклеточной зоны во внутриклеточное пространство фагоцитов, в котором она сохраняет жизнеспособность и размножается. Только образование оксида азота под действием IFNy способно преодолеть эти защитные механизмы и вызвать гибель микобактерий.
Факторы, подавляющие экспрессию молекул главного комплекса гистосовместимости
Аденовирусы содержат факторы, подавляющие экспрессию молекул MHC-I, вирус кори — молекул MHC-II, цитомегаловирус подавляет экспрессию и тех, и других молекул. В результате происходит ослабление экспрессии антигенных пептидов вирусного происхождения и снижение эффективности презентации антигена Т-клеткам — CD8+ (при подавлении экспрессии MHC-I) и CD4+ (при ослаблении экспрессии MHC-II). Особенно существенно ослабление экспрессии MHC-I. Оно имеет и оборотную сторону, поскольку создает возможность проявления защитной активности NK-клеток. Некоторые вирусы обладают механизмами, подавляющими захват и обработку гликолипидов и их встраивание в молекулы CD1d. С другой стороны, вирусы могут способствовать усилению экспрессии неполиморфных молекул HLA-E. Так, цитомегаловирус экспрессирует молекулу, структурно сходную с HLA-E, способную ингибировать активность NK-клеток.
Факторы, влияющие на экспрессию стрессорных белков
Вирусы индуцируют стрессорные белки, распознаваемые естественными киллерами и активирующие эти клетки. С другой стороны, вирусы могут препятствовать экспрессии этих белков. Так, цитомегаловирус индуцирует синтез белка UL16, связывающего факторы активации NK-клеток — молекулы МГС и ULBP, что препятствует реализации защитной функции NK-клеток.
Список факторов патогенов, модулирующих защитные иммунные реакции хозяина, может быть значительно расширен. Наличие этих факторов свидетельствует о двустороннем характере взаимодействия патогенов и организма хозяина в процессе иммунного ответа на инфекции.
Защитный характер иммунного ответа при инфекционных заболеваниях
Иммунный ответ на инфекционные агенты, как и любой иммунный ответ, складывается из двух основных этапов:
- начального периода, когда реализуется первая линия иммунной защиты и «строится» адаптивный иммунный ответ (индуктивная фаза иммунного ответа);
- эффекторная фаза адаптивного иммунного ответа.
В результате достигается состояние, которое обозначают термином «иммунитет» в узком значении этого слова, подразумевающем состояние реализованной защиты, устойчивости организма к данному инфекционному агенту. Это состояние тоже складывается из двух периодов в зависимости от механизмов обеспечения резистентности:
- период устойчивости, обусловленной присутствием эффекторных факторов защиты, сформировавшихся во время иммунного ответа и сохранивших свою активность;
- период иммунологической памяти, гарантирующей более эффективную защиту при повторном проникновении инфекционного агента, по сравнению с первичной инфекцией.
Из сказанного следует, что при наличии функционально полноценной иммунной системы организм никогда не оказывается без средств защиты от внешней агрессии. Иммунная защита только меняет свои механизмы, что сопровождается ростом специфичности (прицельности) защиты и повышением ее интенсивности. Только в период индуктивной фазы иммунного ответа иммунная защита основывается исключительно на использовании факторов врожденного иммунитета. В последующем происходит подключение факторов адаптивного иммунитета, а период иммунологической памяти полностью основан на механизмах адаптивного иммунитета.
Реализация первой линии защиты и индукция иммунного ответа
Сразу после проникновения во внутреннюю среду организма патогены испытывают воздействие факторов иммунной защиты. Сначала действуют механизмы врожденного иммунитета, а также промежуточное звено иммунной системы — «неклассические» субпопуляции лимфоцитов. Распознавание чужеродных молекул (PAMP) — первое событие в запуске иммунного ответа. Следствие этого распознавания, осуществляемого с участием патогенраспознающих рецепторов, в первую очередь мембранных TLR, — активация клеток врожденного иммунитета. В результате активации экспрессируются гены цитокинов и секретируются провоспалительные цитокины, обеспечивающие привлечение в очаг инфицирования лейкоцитов — нейтрофилов, а затем моноцитов и других клеток крови.
Активация местных и пришлых клеток обеспечивает реализацию главной защитной реакции первой линии защиты — фагоцитоза. При фагоцитозе возможно распознавание дополнительных PAMP, не локализованных на поверхности клетки (например, пептидогликанов бактерий, CpG-последовательностей их ДНК и др.), что служит еще одним стимулом к активации клеток. Поглощение патогенов фагоцитами облегчается опсонизацией. В первые дни реакции на микроорганизмы в качестве опсонизирующих факторов выступают белки острой фазы — пентраксины (их образование гепатоцитами стимулируют цитокины), а также компоненты комплемента. Первоначально комплемент активируется преимущественно по альтернативному пути. Другой стимул к его активации — естественные IgM-антитела, спонтанно синтезируемые В1-клетками. Уже в этот период вырабатываются некоторые цитокины, стимулирующие фагоцитарную активность: NKT-клетки секретируют IFNy в самый ранний период реакции на патогены. Плазмоцитоидные дендритные клетки реагируют на распознавание PAMP секрецией IFNa. Определенный вклад в защиту от патогенов на этом этапе вносят у5Т-клетки, однако этот вклад пока точно не расшифрован. К перечисленному следует добавить активность неспецифических бактерицидных факторов (например, дефензинов), вырабатываемых не только мие- лоидными, но и эпителиальными клетками. Способность эпителиальных и эндотелиальных клеток, активируемых провоспалительными цитокинами, воспроизводить многие эффекты макрофагов делает их дополнительными эффекторными клетками врожденного иммунитета, роль которых особенно велика в период острой фазы реакции на патоген.
Все вышесказанное в большей степени отражает реакцию на внедрение бактерий, грибов, простейших и других относительно крупных одноклеточных патогенов. Инфицирование вирусами, хотя и вызывает воспалительный ответ, протекает с более умеренным вовлечением фагоцитов и других факторов врожденного иммунитета. Тем не менее, фагоцитоз инфицированных клеток чрезвычайно важен, поскольку основные молекулы вирусов, несущие PAMP, распознаются внутриклеточными TLR. Одно из ранних проявлений реакции иммунной системы на вирусы — запуск выработки интерферонов I типа (особенно IFNa и IFNP), обладающих противовирусным действием. Основной источник интерферонов — плазмоцитоидные дендритные клетки, дополнительный источник — макрофаги и другие клетки врожденного иммунитета. Главными эффекторами противовирусного иммунитета на этом этапе служат естественные киллеры, активируемые при распознавании стрессорных молекул инфицированных клеток и дополнительно стимулируемые цитокинами, которые секретируют NKT-клетки.
Защитная роль этих процессов очень велика, о чем можно судить по тяжелым последствия нокаута генов, отвечающих за реализацию функций упомянутых выше клеток врожденного иммунитета. При этом выявляют значительное утяжеление течения инфекционных процессов в первую неделю их развития. Это вполне соответствует представлению о том, что в этот период названные клетки и гуморальные факторы являются единственными защитными механизмами иммунной системы, способными к мобилизации практически немедленно после попадания в организм патогенов.
В этот же период интенсивно происходят процессы, обеспечивающие подготовку следующего этапа иммунной защиты — реализуется индуктивная фаза адаптивного иммунного ответа. В качестве ее инициатора выступают клетки врожденного иммунитета — миелоидные дендритные клетки. Захватив материал, содержащий молекулы патогенов, они транспортируют его в региональные лимфатические узлы, где презентируют Т-лимфоцитам — CD4+ и CD8+. Первые служат основными «организаторами» иммунного ответа. В отличие от клеток врожденного иммунитета, вовлекаемых в иммунный ответ тотально, клетки адаптивного иммунитета
(лимфоциты) вступают в него в составе единичных клонов, активация которых осуществляется на основе специфичности их антигенраспознающих рецепторов. Клетки этих клонов активируются, выделяют аутокринный ростовой фактор IL-2. Их численность многократно возрастает, и они дифференцируются в различные разновидности хелперных Т-клеток, которые помогают вовлечению в иммунный процесс остальных лимфоцитов. CD8+ Т-клетки, получившие стимулирующий сигнал от дендритных клеток и дополнительный стимул от Th1-хелперов, дифференцируются в цитотоксические Т-лимфоциты. Те же TM-клетки способны оказать помощь макрофагам, существенно усиливая их активность. Наконец, под влиянием антигена активируются клоны В-лимфоцитов. Проходя несколько этапов дифференцировки и отбора при участии ^2-лимфоцитов или особых фолликулярных Т-хелперов, они развиваются в антителопродуцирующие клетки. Так формируется полный набор клеток, участвующих в адаптивном (антигенспецифическом) иммунном ответе. Спектр клеток, вовлекаемых в иммунный ответ, и формирующиеся эффекторные механизмы в очень большой степени определяются локализацией патогена — внутри или вне клеток (рис. 4.3).
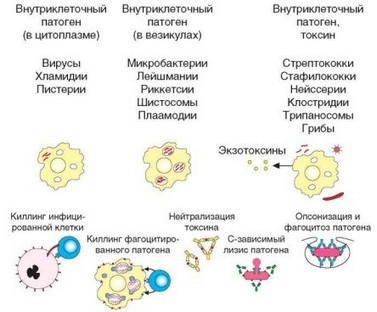
Рис. 4.3. Локализация патогена определяет тип иммунной защиты. В зависимости от локализации патогена, его эпитопы презентируются в составе молекул MHC-I или MHC-II, что предопределяет дальнейшее вовлечение клеток иммунной системы в иммунный ответ и тип эффекторных реакций, как правило, адекватный для защиты от данного конкретного патогена
Фазу формирования адаптивного ответа обозначают как индуктивную. В это период эффекторная активность факторов адаптивного иммунитета только начинает проявляться (как уже отмечалось, защиту в этот период обеспечивают исключительно факторы врожденного иммунитета).
Эффекторная фаза иммунного ответа
Переход к эффекторной фазе происходит постепенно. Временная граница, отделяющая ее от первой фазы, примерно соответствует концу первой — началу второй недели после инфицирования. В эффекторную фазу иммунного ответа механизмы иммунной защиты состоят из реакций врожденного иммунитета, усиленных факторами адаптивного иммунитета. Собственные эффекторные механизмы адаптивного иммунитета немногочисленны и их вклад в защиту относительно невелик. Он сводится к нейтра
