Рассмотрим феноменологию отторжения аллогенных тканей на примере трансплантатов кожи. После подсадки кожного лоскута происходит его васкуляризация. Этот процесс в основном завершается через 3—4 сут. В случае подсадки органов на сосудистой ножке этот этап отсутствует. Начиная с 5—7-х суток, проявляются признаки иммунной реакции организма — инфильтрация лоскута мононуклеарами, развитие иммунного воспаления.
При различиях между донором и реципиентом по генам MHC отторжение происходит на 10—12-е сутки Оно проявляется в нарушении питания трансплантата вследствие тромбоза сосудов, некрозе ткани, подсыхании и отделении трансплантата от ложа. При различиях по слабым локусам гистосовместимости реакция развивается медленнее и иногда приобретает хроническую форму с постепенным отмиранием клеток трансплантата и их замещением клетками хозяина в течение нескольких месяцев.
Трансплантационная реакция сочетает некоторые черты цитотоксической и воспалительной форм клеточного иммунного ответа. Она реализуется с участием как CD8+, так и CD4+ Т-лимфоцитов. Первые являются основными эффекторными клетками, ответственными за гибель клеток трансплантата; вторые обеспечивают развитие иммунного воспаления, способствующего гибели пересаженной ткани через нарушение трофики и активацию факторов врожденного иммунитета.
Афферентное звено иммунного ответа на аллотрансплантат состоит из двух параллельных путей, приводящих к активации CD4+ и CD8+ Т-лим- фоцитов. Вовлечение в ответ CD4+ Т-клеток происходит за счет миграции из трансплантата в региональный лимфатический узел клеток Лангерганса. Известен феномен «клеток-пассажиров»: для того, чтобы аллогенный трансплантат был распознан иммунной системой хозяина, в нем должны присутствовать клетки костномозгового происхождения, при искусственном вымывании которых трансплантат утрачивает иммуногенность. Этими клет
ками являются дендритные клетки, а в случае кожных трансплантатов — их разновидность, клетки Лангерганса.
Показано, что Т-клетки могут распознавать молекулы MHC с помошью двух разных механизмов — прямого и непрямого, опосредованного через презентацию аутологичными АПК (рис. 4.8). В последнем случае презентация реализуется по классическому пути: молекула MHC вместе с другими молекулами аллогенных клеток поступает в дендритные клетки путем эндоцитоза, расщепляется в их эндосомах и включается в состав молекул MHC-II. Такой путь презентации обычно реализуется при активации CD4+ Т-лимфоцитов. В соответствии с основными закономерностями развития иммунного ответа этот процесс реализуется в региональном лимфатическом узле, в который мигрируют из трансплантата содержащиеся в нем дендритные клетки («клетки-пассажиры»). Вероятно, именно они служат источником донорских молекул MHC.
Прямое распознавание MHC-антигенов чаще реализуется при активации CD8+ Т-клеток. В этом случае TCR непосредственно взаимодействует с аллогенной молекулой MHC. Вероятно, источником антигенного сигнала
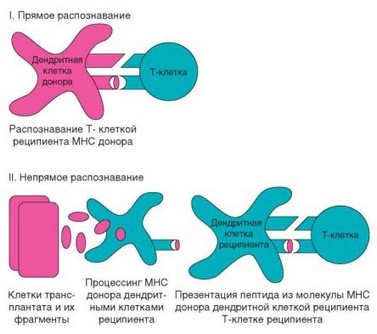
Рис. 4.8. Прямое и непрямое распознавание молекул главного комплекса гистосовместимости (MHC) при траснплантации тканей. Клетки и молекулы донора и реципиента обозначены разными цветами. Прямое распознавание предполагает распознавание Т-клеткой реципиента целой молекулы MHC, непрямое — распознавание эпитопов донорской молекулы MHC в составе MHC хозяина
служит клетка-пассажир — аллогенная дендритная клетка, которая сама представляет молекулу MHC класса I Т-лимфоциту реципиента. Полагают, что в этом процессе основную роль играет распознавание не антигенного пептида (вероятно, он вообще не имеет значения), а особенностей структуры молекулы MHC, отличающейся от MHC хозяина. Очевидно, аллогенная дендритная клетка, как и сингенная, поставляет костимулирующие сигналы. Соотношение прямого и опосредованного распознавания молекул MHC на этом этапе трансплантационной реакции изучено недостаточно. Считают, что оба типа распознавания участвуют в вовлечении в иммунный ответ как СD4+, так и CD8+ Т-клеток, однако во втором случае преобладает прямое распознавание.
Формирующиеся эффекторные Т-клетки обоих типов (TW-клетки и цитототоксические Т-лимфоциты) поступают в циркуляцию и в результате экспрессии на их поверхности хемокиновых рецепторов (ССR1, ССR2, ССR3, CCR5 и др.), мигрируют в очаги воспаления, всегда сопутствующего трансплантации, и инициируют реакции, приводящие к отторжению ткани. Наряду с этими антигенспецифическими клетками в трансплантат мигрируют естественные киллеры, а также воспалительные клетки, прежде всего макрофаги. Лимфоидная инфильтрация — одно из самых типичных морфологических проявлений трансплантационной реакции.
Как уже упоминалось, реакция отторжения складывается из двух составляющих, опосредованных CD8+ и CD4+ Т-клетками. С одной стороны, это типичная цитотоксическая реакция, опосредованная естественными киллерами и цитотоксическими Т-лимфоцитами. Участие естественных киллеров обусловлено отсутствием на клетках мишенях сингенных молекул MHC. Цитотоксические Т-лимфоциты распознают молекулы MHC-I донора на поверхности клеток трансплантата напрямую. Цитотоксические клетки обоих типов осуществляют цитолиз по перфориновому и Fas-зависимому механизмам. Дополнительный вклад в отторжение аллотрансплантатов вносит IFNy, выделяемый цитотоксическими клетками обоих типов. Этот цитокин способствует развитию апоптоза клеток трансплантата и стимулирует реализацию реакций, опосредуемых CD4+ Т-клетками. Данные о вовлечении в этот процесс клеток «промежуточного типа» — у5Т- и NKT-клеток практически отсутствуют.
Клеточный ответ воспалительного типа, опосредованный CD4+ T-клетками и макрофагами, создает фон для реализации цитотоксического ответа (рис. 4.9). Вызываемое этими клетками иммунное воспаление инициируется взаимодействием Th1-клеток с макрофагами. При этом TM-лимфоциты повторно стимулируются пептидными фрагментами молекул MHC-II донора, представляемыми макрофагами. Такие активированные TW-клетки в свою очередь стимулируют макрофаги через костимулирующую молекулу CD40. TM-лимфоциты выделяют IFNy и TNFa. Эти цитокины, с одной стороны, служат дополнительными активаторами макрофагов, а с другой — сами по себе появляют провоспалительную и деструктивную активность. Активированные макрофаги выделяют провоспалительные цитокины, а также активные формы кислорода, оксид азота, ферменты и другие факторы, оказывающие при инфицировании бактерицидное действие, а при трансплантации участвуют в разрушении пересаженных тканей. Кроме
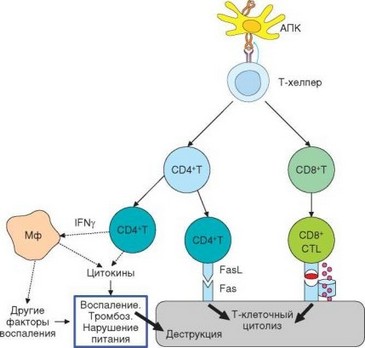
Рис. 4.9. Клеточные механизмы отторжения трансплантата. Отражены 2 основных механизма, обеспечивающие отторжение аллотрансплантата: цитолиз, осуществляемый преимущественно CD8+ и в меньшей степени CD4+ Т-клетками, и нарушение питания трансплантата вследствие локального воспаления
того, продукты макрофагов способствуют развитию локального воспаления, сопровождающегося нарушением микроциркуляции, формированием тромбов и другими изменениями, что нарушает трофику трансплантата и приводит к его отторжению.
Повторная подсадка тканей, несущих те же антигены, которые присутствовали в первом трансплантате, вызывает ускоренную реакцию отторжения, обозначаемую как реакция second set («второй заход»). Она проявляется несколько иначе, чем первичная реакция. Основное отличие состоит в отсутствии довольно длительной фазы васкуляризации и сокращении индуктивной фазы. При вторичном ответе на трансплантат с достаточно сильными антигенными отличиями от клеток реципиента, его кровоснабжение, как правило, не устанавливается (отсюда название — «бледный трансплантат»). При повторной подсадке органов на сосудистой ножке быстро развивается тромбоз сосуда, и кровоснабжение нарушается. Это само по себе препятствует приживлению трансплантата, который с самого начала оказывается в условиях ишемии и дефицита питательных веществ. Сосудистая реакция развивается под влиянием цитокинов, секретируемых эффекторными Т-лимфоцитами, которые быстро образуются из клеток памяти и стимулируют макрофаги; последние тоже вносят вклад в цитокиновую реакцию. В то же время нарушение кровоснабжения делает невозможным и излишним развитие реакции цитотоксических лимфоцитов в том объеме, в каком она реализуется при первичном ответе. В отсутствие спазма сосудов быстрое формирование эффекторных клеток из клеток памяти также обеспечивает ускоренное отторжение трансплантата.
Еще П. Медавар показал, что гуморальные антитела не играют существенной роли в отторжении аллотраснплантата. В некоторых ситуациях антитела даже препятствуют отторжению, защищая клетки трансплантата от разрушительного действия Т-лимфоцитов. При повторной подсадке аллогенных тканей антитела, образующиеся в ходе иммунного ответа на аллоантигены, вносят вклад в реакцию отторжения. Они могут диффундировать в трансплантат, формировать иммунные комплексы с мембранными антигенами его клеток, привлекая макрофаги и обусловливая их FсR-зави- симую активацию (рис. 4.10). В конечном счете это способствует развитию воспалительной реакции.
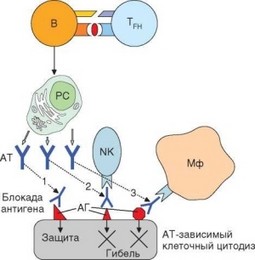
Рис. 4.10. Неэффективность гуморального иммунитета при отторжении трансплантата. Антитела не являются основным фактором отторжения трансплантатов, хотя могут привлекать макрофаги (3) и естественные киллеры (2) к его разрушению. Более важна конкуренция антител и Т-клеток за клетки-мишени (1), хотя эту конкуренцию едва ли следует понимать буквально, поскольку В- и Т-эпитопы, как правило, не совпадают
При пересадке ксенотрансплантатов антитела могут играть ключевую роль в отторжении. Однако это не иммунные, а естественные антитела к а-гликановым остаткам, присутствующие в сыворотке крови всех людей. Мишени этих антител (а-гликаны) входят в состав мембранных гликопротеинов клеток большинства животных, но отсутствуют у человека. В результате развивается быстрая реакция, сопровождающаяся спазмом сосудов, напоминающая реакцию secondset на аллотрансплантат.
