Опухоли мочеполовой системы у детей наблюдаются значительно реже, чем у взрослых. Существуют опухоли, которые встречаются в основном в детском возрасте. В экономически развитых странах опухоли мочеполовой системы у детей наблюдаются у 15 на 100 000 детей от периода новорожденности до 16 лет. В результате значительного снижения смертности от детских инфекций в большинстве европейских стран на передний план вышлите заболевания, которые раньше не были основными в общей статистике детской смертности. Среди них важное место занимают онкологические заболевания, которые составляют 10,4% общей детской смертности (Ахунзянов А.А. и др., 2000).
Опухоли почек. По данным К.Л. Москачевой (1055), Л,А. Дурнова (1994) и других авторов, опухоли почек у детей занимают первое место среди опухолей мочеполовой системы и составляют 50% наблюдений от общего числа опухолей мочеполовых органов. Доброкачественные опухоли почек у детей встречаются крайне редко.
Нефробластома (опухоль Вильмса). Опухоль Вильмса (нефро- бластома, эмбриональный рак почки, аденосаркома почки, эмбриональная нефрома, смешанная опухоль почки) является наиболее специфичной опухолью детского возраста и составляет до 7% всех злокачественных новообразований у детей. Многие годы нефробластома служила моделью для изучения онкологических заболеваний у детей.
В 1899 г. Вильмс в своей монографии (Mixed Tissue Tumors of the Kidney) дал обзор литературы по опухолям почек у детей, с тех пор эти новообразования стали известны как опухоли Вильмса. Эффективной терапии этого заболевания не существовало.
Распространенность. Опухоль Вильмса, или нефробластома — выоокозлокачествепная эмбриональная опухоль, происходящая из развивающихся тканей почек (метапефрогенетического ростка). Это наиболее частое злокачественное новообразование мочеполовой системы у детей и составляет 7-8 случаеЕ на 1 000 000 детей в возрасте от 1 до 15 лет (Joung J., Muller D., 1975). Средний показатель опухоли Вильямса в Финляндии, Швеции, США, Австралии, Италии,
Голландии и Великобритании равняется 7,о. При этом наибольший показатель в Финляндии (9,5) и наименьший — в Великобритании (5,1). По данным Института детской онкологии ОНЦ РАМН, иефро- бластома встречалась у 20% детей с солидными новообразованиями (исключая опухоли ДПС). Наиболее часто ее наблюдали у детей до 5 лет (75%).
Частота нефробластомы у мальчиков и девочек примерно одинакова (соотношение мальчиков и девочек =* 1:1,1). У мальчиков диагноз устанавливают в более раннем возрасте - в среднем в 3,5 гида, у девочек - в 3 года и 6,5 мес, В 12% случаев с односторонней опухолью отмечается многоочаговое поражение почки. Двустороннее поражение почек наблюдается в 7% случаев, причем в 85% эти опухоли синхронные. У девочек несколько чаще, чем у мальчиков, наблюдается многоочаговый (57%) и двусторонний опухолевый процесс (58,5%).
Нефробластомы нередко сочетаются с врожденными аномалиями развития. Lemerte (1976) выявил врожденные пороки развития у 13% детей с нефробластомой, NakissaJ. ct. al. (1989) описали 38% аномалий мочеполовой системы среди 133 больных нефробластомой. Ряд аномалий тесно связан с нефробластомой. К ним относят спорадическую аниридию, гемигипертрофию и почечные аномалии.
Этиология На материалах клиники Института детской онкологии ОНЦ РАМН попытались выяснить связь семейного онкологического анамнеза и возраста родителей на заг олеваемость. Чем старше мать, тем больше у нее шансов родить ребенка с нефробластомой (Рябов А.И., 1970; Ясонов А.В., 1980). В связи с этим возраст родителей можно считать фактором риска.
В последних сообщениях имеются данные о повышенном риске развития опухоли Вильмса у детей, чьи отцы работают на химических предприятиях (Olshan A. et al1990). Механизм опосредованного влияния по мужской линии этих профессий на тератогенез не ясен.
Патогенез. Макроскопически нефробластома обычно представляется солитарной опухолью, хорошо отграниченной от нормальных тканей почки. Она может встречаться в любой части органа. Большая нефробластома вызывает деформацию полостей почки. В ряде случаев опухоль инкапсулирована, и в ней встречаются зоны некроза с образованием полостей, иногда с массивными кровоизлияниями. При так называемых мультикистозных формах нефробластомы на поверхности разреза выявляются множественные тонкостенные кисты. Возможна инвазия окружающих опухоль тканей — почечной вены, нижней полой вены и даже почечной лоханки и мочеточника (Ritchey О. et ah, 1988). В 7-10% случаев метастазами поражаются регионарные лимфатические узлы, прежде всего парааортальные, расположенные между нижней мезентериальной артерией и диафрагмой (Williams J., 1973).
Прорастание кровеносных сосудов способствует стремительному метастазированию, которое может наблюдаться и без этого, Наиболее часто гематогенные метастазы развиваются в легких, печени, реже
Гистологическая картина разнообразна, но всегда имеются эпителиальные и соединительнотканные клетки. Поданным В.Н. Суховой
В последние годы выделяют благоприятную, нормальную и неблагоприятную нефробластомы. К первой относят мультикистозные, тубулярные и фиброаденоматозные формы опухоли, а к последним
Клиническая картина. Опухоль Вильмса у внешне здорового ребенка обнаруживается матерью или педиатром во время обычно го диспансерного осмотра (рис. 29.1). Гладкая, иногда с неровной поверхностью, плотная, безболезненная опухоль в брюшной полости часто бывает первым признаком заболевания. Макрогематурия встречается более чем в 25% наблюдений (Ledlie L. et al., 1970) и выявляется тогда, когда опухоль прорастает в чашечную систему почки. Такие опухоли развиваются в зонах, прилежащих к лоханке, и диагностируются в ранних стадиях развития. Другие симптомы неспецифичны. К ним относят желудочно-кишечные расстройства, общее недомогание, лихорадку, боль в животе. Повышение артери- ачьного давления чаще регистрируется при двустороннем поражении (SuhavochaJ. et al., 1972).

Рис. 29.1. Ребенок 5 лет. Опухоль Вильмса слева. Деформация живота
Пальпируемая опухоль у ребенка может быть округлей удлиненной или неправильной формы, с гладкой или бугристой поверхностью. Подвижность опухоли зависит от величины. При быстром росте опухоль опускается в таз, поднимает ее купол диафрагмы, край печени (или селезенки). Нижний отдел грудной клетки расширяется, кожа живота растягивается, резко расширяется сосудистая сеть в подкожной клетчатке
Ребенок жалуется на боль различной интенсивности. Боль может быть тупой иногда она напоминает почечную колику.
При прорастании опухоли через капсулу или в лоханку, т.с. на поздних стадиях определяется гематурия Иногда этот симптом обнаруживается после травмы живота или поясничной области
Опухолевая интоксикация, микро- или макрогематурия являются причиной выраженной анемии, а мокоцитоз, гистиоцнтоз, эозинофилия, лимфоцитоз, нейтрофилез, увеличение СОЭ свидетельствуют о степени тяжести опухолевого процесса и вероятности метастазирования или распада опухоли.
Опухоль Вильмса может сочетаться с гломерулосклерозом и драш-синдромом.
Важное место в диагностике опухоли Вильмса занимают ультразвуковые, рентгенологические и радионуклидные методы исследования. Ультразьуковая томография играет особенно большую рочь при диагностике нефробластомы. Определяют размеры почек, неоднородную плотность ее паренхимы, деформацию чашечек и лоханки.
При обзорной рентгенографии брюшной полости можно выявить кальцификаты, которые встречаются в 60-70% случаев нейробластомы и в 15% случаев нефробластомы. Определяются увеличение и нечеткость контуров почки, а также позвоночного столба сколиоз. Экскреторная урография позволяет в 82% случаев нефробластомы определить локализацию и характер патологического процесса по типичной деформации и смещению полостей почки (Волкова Л.Д., 1991) (рис. 29.2, 29.3).
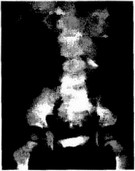
Рис. 29.2. Экскреторная урограмма. Опухоль Вильмса слева у ребенка 3 лет
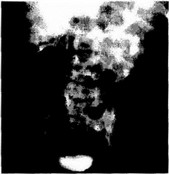
Рис. 29.3. Экскреторная урограмма. Опухоль Вильмса слепа у ребенка 2 лет
Абдоминальная компьютерная томография (особенно с внутривенным контрастированием) позволяет четко определить границы опухоли как в почке, так и за ее пределами, выявить пораженные метастазами лимфатические узлы, метастазы в печень и помогает составить представление о состоянии контралатеральной почки (рис. 29.5) Диагностические возможности компьютерной томографии больше, чем ультразвуковой (Reiman j. etal., 1986). Чувствительность компьютерной томографии в диагностике опухоли почки у детей достигает 92%. Внедрение компьютерной томографии привело к снижению роли инвазивной артериографии при обследовании больного с пефробластомай. В последнее время широко применяется наравне с компьютерной томографией и магнитно-резонансная томография, которая при многих равных диагностических условиях имеет существенное преимущество — отсутствие рентгенологического облучения детского организма. В отдельных случаях прибегают к пиевмо- рет роперитонеум у.
Необходимо также рентгенологическое исследование органов грудной клетки из-за возможного метастатического поражения легких. Для выяснения распространенности метастатических изменений и выявления небольших метастазов, которые не выявляются на обычных рентгенограммах, используют компьютерную томографию. Williams J. ct al. (1988) у 9% детей обнаружили на компьютерных
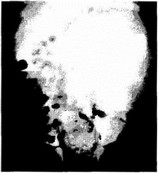
Рис. 29.4. Экскреторная урограмма. Опухоль Виль.мса слева у ребенка 1 года
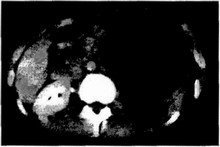
Рис. 29.5. Компьютерная томография почки. Опухоль Видьмса слепа
томограммах метастазы нефробластомы, которые рентгенологически не определялись.
Радионуклидный метод позволяет обнаружить дефект изображения почечной паренхимы, определить потерю функции почек.
Дифферетщальная диагностика. Наиболее часто приходится дифференцировать со силеномсгалией, ретикулосаркоматозным
поражением тонкой и толстой кишки, кистами брыжейки и яичников, болезнью Гиршпрунга (особенно при длительном копростазе).
Не представляв г больших трудностей при проведении дифференциации с гидронефрозом, поликистозом почки и т.д.
Если после обследования указанными меюдами остаются сомнения в диагнозе, необходимы почечная артериография и пункционная биопсия (рис. 29.6, 29.7).

Рис. 29.6. Селективная артериография. Опухоль почтеи слева у ребенка 2 лет
В табл. 28 представлен перечень исследований, которые необходимо выполнить до начала лечения больных нефробластомой (рекомендации NWTS-4).
Прогностические факторы весьма разнообразны. К основным относят опухолевую инвазию почечной вены, возраст ребенка, гистологическое строение нефробластомы, стадию заболевания, разрыв опухоли до или во время операции. Наиболее значимы из них стадия болезни, гистологическое строение опухоли (благоприятное или неблагоприятное), метастазы в лимфатических узлах и диссеми нация опухоли
Лечение при оп)'холи Вильмса у детей находится в состоянии постоянного изменения и развития, а сотрудничество многих спе-
Рис. 29 7. Селективная артериография. Опухоль Вильмса справа у ребенка 5 лет
циалистов дает возможность определить наиболее рациональную тактику.
В настоящее время общепризнана комплексная терапия больных ттефробластомой, в которую входит оперативное удаление опухоли, лучевое и интенсивное лекарственное лечение.
Лечение детей с пефробласпюмои зависит в основном от стадии заболевания и морфологического строения опухоли. Предварительно выполняют цитологическое исследование материала, полученного при аспирационной пункции опухоли тонкой иглой, В случае отсутствия морфологического подтверждения диагноза (при опухоли Вильмса I стадии, когда получить материал трудно из-за небольшого размера новообразования) рекомендуется органосохраняющее оперативное вмешательство. При выполнении операции необходимо срочное гистологическое исследование ткани но краю резекции опу- хоч и.
При морфологическом подтверждении диагноза на первом этапе назначают предоперационную химиотерапию. На втором этапе проводится нефроуретерэктомия (Шароев Т.А., 2о06).
По данным Международного общества детских урологов, поли- химиотсрапия позволяет «сдвинуть» стадию заболевания с более
Таблица 28
Методы обследования дегей с опухолью почки
высокой на более низкую, что улучшает прогноз. Эта закономерность часто встречается в педиатрической онкологии.
Оперативное лечение остается основным в комплексной терапии больных опухолью Вильмса, Полностью удаляют все пораженные опухолью ткани, определяют стадию процесса для правильного назначения дальнейшей адъювантной терапии. В большинстве случаев показана радикальная кефроуретерэктомия, и только при Т стадии возможна резекция поики (pF-re. 29.8).
Основные принципы оперативного лечения больных нефроблаг- томой:

Рис. 29.8. Опухоль Вилъмса (макропрепарат)
•маркировка ложа опухоли в зоне сомнительно радикального удаления рентгеноконтрастными клипсами для планирования зон обчучения;
Отдельные авторы прибегают к лапароскопическому методу
(Denes F. et al., 2006).
Химиотерапия. Наиболее широко используются сочетания дак- тиномицина, циклофосфана, винкристина и адриамицина.
Для предварительного лечения предлагается следующая схема: винкристин 1,5 мг/м2 внутривенно в 1-й, 8-й, 15-й день (максимальная разовая доза 2 мо); дактиномишш 1000 мкг/м2 внутривенно капельно в 1-й день па 400 мл изотонического раствора хлорида натрия.
Если к 15-му дню не происходит значительного уменьшения опухоли (более чем на 50%), то вместе с 3-м введением винкристина внутривенно вводят 40 мг/м2 адрпамидина.
При нефробластомах I стадии с благоприятным гистологическим строением необходимо провести короткий курс дооперапионной химиотерапии дактиномицином и винкристином. У больных со II стадией (при метастазах в регионарные лимфатические уз ты) и с Ш стадией введение дополнительного адриамицина снижает частоту рецидивов заболевания,
В европейских странах до операции лекарственное лечение проводят двумя препаратами, а схемы послеоперационной химиотерапии определяются в зависимости от стадии заболевания и гистологического строения нефробластомы. Гак, при I стадии (включая анапластические опухоли) послеоперационное лечение осуществляется коротким курсом с использованием двух препаратов; при II стадии (без поражения регионарных лимфатических узлов метастазами) можно применять трехкомпонептное лекарственное лечение в течение 28 нед; при II стадии с метастатическим поражением регионарных лимфатических узлов и III стадии химиотерапия может быть аналогичной проводимой при II стадии, но дополняется лучевой терапией (15 Гр + локальное облучение небольшими полями зон нерадикального удаления опухоли в дозе 10-15 ГрУ
Лучевая терапия. В 50-е годы лучевая терапия была единственным средством, дополняющим оперативное лечение. Эта комбинация позволила улучшить результаты лечения с 20% до 50-57% (Paterson IX, 1958; Kmzel J. et al., 1960; и др.). Предоперационное облучение использовали в основном у детей с первично большими опухолями с целью уменьшения их размеров. Применение пред- и послеоперационной лучевой терапии должно более значимо увеличивать эффективность комбинированного лечения больных нефробластомои за слет включения всех положительных механизмов, направленных на увеличение радикальности оперативных вмешательств (предупреждение развития местнорегионарных рецидивов и разрыва опухоли во время операции, снижение опасности развития отдаленных метастазов). Однако, несмотря на положите п ьные моменты лучевой терапии, в последние годы ее роль в комбинированном лечении снизилась, что объясняется появлением новых эффективных противоопухолевых препаратов и их сочез аний.
Многолетние кооперативные исследования, проведенные в США и Европе, позволили сформулировать современные показания к применению лучевой терапии (таб. 29).
Начало облучения с 6-8-го дня после операции. Вся брюшная полость подвергается лучевому воздействию, если имеются остаточные перитонеальные имплантаты или если был разрыв капсулы опухоли с обсеменением брюшной полости.
Ряд авторов (D'Angio J. ct al., 1978; Thomas T. ct al., 1984) подчеркивают необходимость строгого соблюдения сроков начала терапии: больные, у которых лучевая терапия осуществлялась через 10 дней после операции и более, имели значимо больший риск местного рецидива заболевания по сравнению с детьми, у которых лучевое воздействие начинали в более ранние сроки.
Перед операцией в зону лучевого воздействия включают пораженную почку с ее сосудами и лимфатическими узлами. Верхняя граница располагается на уровне купола диафрагмы, нижняя — на уровне нижней мезентериальной артерии, внутренняя — за средней линией, по противоположному краю позвоночного столба. В общем мишень облучения составляют опухоль или сс ложе (при рецедиве), почка или ее ложе (при рецидиве) с 2-3 см от ее края. Границы мишени те же и в послеоперационном периоде, за исключением того, что облучают не почку, а ее ложе. При необходимости допоянительного локального облучения ложа опухоли вследствие остаточной опухоли, неблагоприятного гистологического строения нужно исключить облучение позвоночника.
При облучении всей брюшной полости необходимо тщательно защищать тазобедренные суставы для предупреждения нарушения роста костей, что в отдаленные сроки может привести к соскальзыванию головки бедра. Это осложнение встречается даже при дозах ниже 20 Гр.
Правильный выбор объема облучения нс только уменьшает число отдаленных осложнений, но и отчетливо влияет на исход заболевания: использование ограниченных полей облучения ведет к увеличению числа рецидивов опухоли (Thomas D. et al., 1984).
Лучевая терапия осуществляется на дистанционных мегаволь- тных аппаратах (гамма-терапевтических установках типа «Рокус», линейных ускорителях, генерирующих фотоны с энергией 4-4 МэВ) с использованием двух противолежащих встречных полей (переднего и заднего).
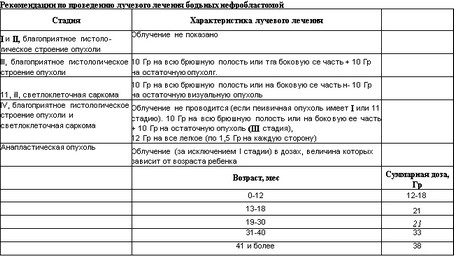
При современном комплексном лечении детей с нефробластомой необходимо подведение относительно невысоких доз (суммарной очаговой дозы) ионизирующего излучения.
При необходимости облучения всей брюшной полости рекомендуют дозу 10 Гр, рассчитанную на среднюю фронтальную плоскость, разовую очаговую дозу 1,5-1,8 Гр, подводимую 5 раз в неделю (Thomas D., 1092).
В Институте детской онкологии ОНЦ РАМН до настоящего времени при облучении брюшной полости использовали дозы 20- 24 Гр, которые подводили с использованием гиперфракционирова- ния. Суточную дозу 2 Гр делили на две фракции по 1 Гр с интервалом
При больших опухолях, не реагирующих на полихимиотерапию, а также при опухолях, имеющих неблагоприятное гистологическое строение, рекомендуется дозу на опухоль увеличивать до 40- 45 Гр.
В исследованиях D’Angio et al. (1981) показано, что у маленьких (до 12 мес) детей с нефробластомой I—II стадии с благоприятным гистологическим строением лучевую терапию применять не следует, так как Она не влияет на результаты комбинированного лечения (операция + двухкомпонентиая химиотерапия). При нефробластоме III стадии благоприятного гистологического строения уменьшение очаговой дозы от 20 до 10 Гр (по 1,8 Гр) может увеличить частоту рецидивов после двухкомпонентной химиотерапии (дактиномицин + винкристин). Этот отрицательный эффект не наблюдается, если к двум лекарственным препаратам добавить адриамицин. В результате снижается число поздних лучевых повреждений и повышается возможность излечения клинически не выявляемых до лечения метастазов.
Двусторонняя нефробластома. Двустороннее поражение потек обнаруживается у 5% детей с. нефробластомой. Каждый больной с синхронной двусторонней опухолью нуждается в индивидуальном подходе. Тактика зависит от распространенности процесса в каждой почке.
При удовлетворительной функции почек современная полихимиотерапия может обеспечить регрессию опухоли, достаточную для ее экономного удаления. Сначала можно использовать двухкомпонентную химиотерапию (дактиномицин + винкристин), а в случае ее малой эффективности назначают другие химиопрепарагы. При показаниях облучение почки проводят в дозе не выше 16 Гр по 1,6-1.8 Гр
После первой двухсторонней органосохраняющей операции хими- отерапию проводят так же, как при далеко зашедшем одностороннем поражении. При росте опухоли через 1,5-6 мес проводят следующее оперативное вмешательство с целью попытки удаления всей видимой опухоли, выполняя резекцию и ее биопсию. После операции продолжают химиотерапию. Нели при повторной операции всю опухоль удалить не удалось, то через 6 мсс выполняют последующую операцию, направленную на радикальное удаление опухоли с двух сторон, вплоть до перевода в рскопривное состояние с последующим программным гемодиализом и пересадкой донорской почки.
Лечение больных с метастазами в легкие. Проблема лечения больных нефробластомой, имеющих метастазы в легкие (наиболее частое метастазирование), остается актуальной. В настоящее время обсуждается комплексное лечение этих детей с оперативным удалением метастазов. Как полагает большинство клиницистов, оперативное вмешательство чаще необходимо для гистологического подтверждения наличия метастазов. Несмотря на опасность нарушения роста грудной клетки и гипоплазии молочной железы (у девочек), необходимо проведение тотального облучения легких. В случаях полной регрессии метастазов после трехкомпонентной химиотерапии (Kraker J1992). Все легкое рекомендуется облучать в дозе 12 Гр.
В Институте детской онкологии ОНЦ РАМН при облучении легких использовали гиперфракционирование. Облучение проводили на гамма-тсрапевтическои установке типа «Рокус» и на линейном ускорителе фотонами 4-6 МэВ с двух встречных полей (переднего и заднего) с обязательным включением всей мишени в 80% изодоз- ную кривую и защитой позвоночного столба свинцовыми блоками. Суточную дозу 2-2,4 Гр разделяли на два сеанса по 1-1,2 Гр с 4-часовым интервалом; курс составил 7 дней, всего 14 фракций. Полная регрессия остаточных метастазов отмечена у 53% детей. Эффективность химиолучевого лечения была выше у детей с односторонним изолированным поражением легких и меньшим числом метастазов, а также при более длительном интервале между сроками окончания первичного лечения и диагностированием метастазов. При одновременном лекарственном и лучевом лечении получен худший эффект, чем при химиотерапии, предшествовавшей облучению.
На результаты лечения существенно влияет стадия онкологического процесса. Так, при I стадии добиваются выздоровления у 90-98% больных, при II стадии — 95%, при III стадии — до 70%, при IV стадии только до 50% (Шароев Т.П., 2006). При двустороннем поражении в зависимости от распространенности процесса излечение составляет от 10 до 50% случаев.
. Ангиомиолипома почки у детей встречается крайне редко (Мегера В.В.и др., 2000). До настоящего времени неясно, следует ли эту опухоль относить к истинным доброкачественным опухолям почки или она является пороком развития. Ее основой являются жировая ткань, кровеносные сосуды и гладкомышечные волокна. Больным показано постоя иное наблюдение у специалиста, при сомнении в диагнозе чрескожная биопсия. При выраженном болевом синдроме проводят оперативное вмешательство.
Опухоли почек. По данным К.Л. Москачевой (1055), Л,А. Дурнова (1994) и других авторов, опухоли почек у детей занимают первое место среди опухолей мочеполовой системы и составляют 50% наблюдений от общего числа опухолей мочеполовых органов. Доброкачественные опухоли почек у детей встречаются крайне редко.
Нефробластома (опухоль Вильмса). Опухоль Вильмса (нефро- бластома, эмбриональный рак почки, аденосаркома почки, эмбриональная нефрома, смешанная опухоль почки) является наиболее специфичной опухолью детского возраста и составляет до 7% всех злокачественных новообразований у детей. Многие годы нефробластома служила моделью для изучения онкологических заболеваний у детей.
В 1899 г. Вильмс в своей монографии (Mixed Tissue Tumors of the Kidney) дал обзор литературы по опухолям почек у детей, с тех пор эти новообразования стали известны как опухоли Вильмса. Эффективной терапии этого заболевания не существовало.
Распространенность. Опухоль Вильмса, или нефробластома — выоокозлокачествепная эмбриональная опухоль, происходящая из развивающихся тканей почек (метапефрогенетического ростка). Это наиболее частое злокачественное новообразование мочеполовой системы у детей и составляет 7-8 случаеЕ на 1 000 000 детей в возрасте от 1 до 15 лет (Joung J., Muller D., 1975). Средний показатель опухоли Вильямса в Финляндии, Швеции, США, Австралии, Италии,
Голландии и Великобритании равняется 7,о. При этом наибольший показатель в Финляндии (9,5) и наименьший — в Великобритании (5,1). По данным Института детской онкологии ОНЦ РАМН, иефро- бластома встречалась у 20% детей с солидными новообразованиями (исключая опухоли ДПС). Наиболее часто ее наблюдали у детей до 5 лет (75%).
Частота нефробластомы у мальчиков и девочек примерно одинакова (соотношение мальчиков и девочек =* 1:1,1). У мальчиков диагноз устанавливают в более раннем возрасте - в среднем в 3,5 гида, у девочек - в 3 года и 6,5 мес, В 12% случаев с односторонней опухолью отмечается многоочаговое поражение почки. Двустороннее поражение почек наблюдается в 7% случаев, причем в 85% эти опухоли синхронные. У девочек несколько чаще, чем у мальчиков, наблюдается многоочаговый (57%) и двусторонний опухолевый процесс (58,5%).
Нефробластомы нередко сочетаются с врожденными аномалиями развития. Lemerte (1976) выявил врожденные пороки развития у 13% детей с нефробластомой, NakissaJ. ct. al. (1989) описали 38% аномалий мочеполовой системы среди 133 больных нефробластомой. Ряд аномалий тесно связан с нефробластомой. К ним относят спорадическую аниридию, гемигипертрофию и почечные аномалии.
Этиология На материалах клиники Института детской онкологии ОНЦ РАМН попытались выяснить связь семейного онкологического анамнеза и возраста родителей на заг олеваемость. Чем старше мать, тем больше у нее шансов родить ребенка с нефробластомой (Рябов А.И., 1970; Ясонов А.В., 1980). В связи с этим возраст родителей можно считать фактором риска.
В последних сообщениях имеются данные о повышенном риске развития опухоли Вильмса у детей, чьи отцы работают на химических предприятиях (Olshan A. et al1990). Механизм опосредованного влияния по мужской линии этих профессий на тератогенез не ясен.
Патогенез. Макроскопически нефробластома обычно представляется солитарной опухолью, хорошо отграниченной от нормальных тканей почки. Она может встречаться в любой части органа. Большая нефробластома вызывает деформацию полостей почки. В ряде случаев опухоль инкапсулирована, и в ней встречаются зоны некроза с образованием полостей, иногда с массивными кровоизлияниями. При так называемых мультикистозных формах нефробластомы на поверхности разреза выявляются множественные тонкостенные кисты. Возможна инвазия окружающих опухоль тканей — почечной вены, нижней полой вены и даже почечной лоханки и мочеточника (Ritchey О. et ah, 1988). В 7-10% случаев метастазами поражаются регионарные лимфатические узлы, прежде всего парааортальные, расположенные между нижней мезентериальной артерией и диафрагмой (Williams J., 1973).
Прорастание кровеносных сосудов способствует стремительному метастазированию, которое может наблюдаться и без этого, Наиболее часто гематогенные метастазы развиваются в легких, печени, реже
- в костях и тканях ЦНС С морфологической точки зрения нефро- бластома представляет собой смесь эпителиальных и стромальных элементов в различных пропорциях (Bonadio D. et al„ 1983)
Гистологическая картина разнообразна, но всегда имеются эпителиальные и соединительнотканные клетки. Поданным В.Н. Суховой
- , морфологическим критерием нефробластомы является присутствие в почке недифференцированной опухочевой ткани или нефрогенньтх структур на разных уровнях развития. Эпителиальные и соединительнотканные элементы могут встречаться в различных сочетаниях, иметь разную степень дифференцировки и даже быть настолько недифференцированными, что порой трудно определить их гистогенез. Кроме основных типов клеток, в опухоли всегда представлена фиброзная строма с большим количеством мелких сосудов типа капилляров и более крупных артериальных стволов. Иногда наблюдается выраженный ангиоматоз. Около 30% составляют ткани других типов: гладкие и поперечнополосатые мышечные волокна, хрящевая ткань, кость, нервные стволы и др.
В последние годы выделяют благоприятную, нормальную и неблагоприятную нефробластомы. К первой относят мультикистозные, тубулярные и фиброаденоматозные формы опухоли, а к последним
- новообразования со значительными очагами клеточного атипизма (анаплазией), светлоклеточной саркомы и рабдоидной формы опухоли. Бластомы с неблагоприятным гистологическим строением встречаются примерно в 12% случаев (Haas Q. et ah, 1981). Светлоклеточная саркома состоит из клеток с плохо окрашивающейся цитоплазмой и нечеткими краями. Они инфильтрируют паренхиму и имеют склонность к метастазированию в кости. Злокачественные рабдоидные опухоли почки у детей наиболее неблагоприятны. Они состоят из клеток с ацидофильной цитоплазмой и имеют склонность к отдаленному метастазированию, особенно в головной мозг (Weeks I. et ah, 1989).
Клиническая картина. Опухоль Вильмса у внешне здорового ребенка обнаруживается матерью или педиатром во время обычно го диспансерного осмотра (рис. 29.1). Гладкая, иногда с неровной поверхностью, плотная, безболезненная опухоль в брюшной полости часто бывает первым признаком заболевания. Макрогематурия встречается более чем в 25% наблюдений (Ledlie L. et al., 1970) и выявляется тогда, когда опухоль прорастает в чашечную систему почки. Такие опухоли развиваются в зонах, прилежащих к лоханке, и диагностируются в ранних стадиях развития. Другие симптомы неспецифичны. К ним относят желудочно-кишечные расстройства, общее недомогание, лихорадку, боль в животе. Повышение артери- ачьного давления чаще регистрируется при двустороннем поражении (SuhavochaJ. et al., 1972).

Рис. 29.1. Ребенок 5 лет. Опухоль Вильмса слева. Деформация живота
Пальпируемая опухоль у ребенка может быть округлей удлиненной или неправильной формы, с гладкой или бугристой поверхностью. Подвижность опухоли зависит от величины. При быстром росте опухоль опускается в таз, поднимает ее купол диафрагмы, край печени (или селезенки). Нижний отдел грудной клетки расширяется, кожа живота растягивается, резко расширяется сосудистая сеть в подкожной клетчатке
Ребенок жалуется на боль различной интенсивности. Боль может быть тупой иногда она напоминает почечную колику.
При прорастании опухоли через капсулу или в лоханку, т.с. на поздних стадиях определяется гематурия Иногда этот симптом обнаруживается после травмы живота или поясничной области
Опухолевая интоксикация, микро- или макрогематурия являются причиной выраженной анемии, а мокоцитоз, гистиоцнтоз, эозинофилия, лимфоцитоз, нейтрофилез, увеличение СОЭ свидетельствуют о степени тяжести опухолевого процесса и вероятности метастазирования или распада опухоли.
Опухоль Вильмса может сочетаться с гломерулосклерозом и драш-синдромом.
Важное место в диагностике опухоли Вильмса занимают ультразвуковые, рентгенологические и радионуклидные методы исследования. Ультразьуковая томография играет особенно большую рочь при диагностике нефробластомы. Определяют размеры почек, неоднородную плотность ее паренхимы, деформацию чашечек и лоханки.
При обзорной рентгенографии брюшной полости можно выявить кальцификаты, которые встречаются в 60-70% случаев нейробластомы и в 15% случаев нефробластомы. Определяются увеличение и нечеткость контуров почки, а также позвоночного столба сколиоз. Экскреторная урография позволяет в 82% случаев нефробластомы определить локализацию и характер патологического процесса по типичной деформации и смещению полостей почки (Волкова Л.Д., 1991) (рис. 29.2, 29.3).

Рис. 29.2. Экскреторная урограмма. Опухоль Вильмса слева у ребенка 3 лет

Рис. 29.3. Экскреторная урограмма. Опухоль Вильмса слепа у ребенка 2 лет
Абдоминальная компьютерная томография (особенно с внутривенным контрастированием) позволяет четко определить границы опухоли как в почке, так и за ее пределами, выявить пораженные метастазами лимфатические узлы, метастазы в печень и помогает составить представление о состоянии контралатеральной почки (рис. 29.5) Диагностические возможности компьютерной томографии больше, чем ультразвуковой (Reiman j. etal., 1986). Чувствительность компьютерной томографии в диагностике опухоли почки у детей достигает 92%. Внедрение компьютерной томографии привело к снижению роли инвазивной артериографии при обследовании больного с пефробластомай. В последнее время широко применяется наравне с компьютерной томографией и магнитно-резонансная томография, которая при многих равных диагностических условиях имеет существенное преимущество — отсутствие рентгенологического облучения детского организма. В отдельных случаях прибегают к пиевмо- рет роперитонеум у.
Необходимо также рентгенологическое исследование органов грудной клетки из-за возможного метастатического поражения легких. Для выяснения распространенности метастатических изменений и выявления небольших метастазов, которые не выявляются на обычных рентгенограммах, используют компьютерную томографию. Williams J. ct al. (1988) у 9% детей обнаружили на компьютерных

Рис. 29.4. Экскреторная урограмма. Опухоль Виль.мса слева у ребенка 1 года

Рис. 29.5. Компьютерная томография почки. Опухоль Видьмса слепа
томограммах метастазы нефробластомы, которые рентгенологически не определялись.
Радионуклидный метод позволяет обнаружить дефект изображения почечной паренхимы, определить потерю функции почек.
Дифферетщальная диагностика. Наиболее часто приходится дифференцировать со силеномсгалией, ретикулосаркоматозным
поражением тонкой и толстой кишки, кистами брыжейки и яичников, болезнью Гиршпрунга (особенно при длительном копростазе).
Не представляв г больших трудностей при проведении дифференциации с гидронефрозом, поликистозом почки и т.д.
Если после обследования указанными меюдами остаются сомнения в диагнозе, необходимы почечная артериография и пункционная биопсия (рис. 29.6, 29.7).

Рис. 29.6. Селективная артериография. Опухоль почтеи слева у ребенка 2 лет
В табл. 28 представлен перечень исследований, которые необходимо выполнить до начала лечения больных нефробластомой (рекомендации NWTS-4).
Прогностические факторы весьма разнообразны. К основным относят опухолевую инвазию почечной вены, возраст ребенка, гистологическое строение нефробластомы, стадию заболевания, разрыв опухоли до или во время операции. Наиболее значимы из них стадия болезни, гистологическое строение опухоли (благоприятное или неблагоприятное), метастазы в лимфатических узлах и диссеми нация опухоли
Лечение при оп)'холи Вильмса у детей находится в состоянии постоянного изменения и развития, а сотрудничество многих спе-

Рис. 29 7. Селективная артериография. Опухоль Вильмса справа у ребенка 5 лет
циалистов дает возможность определить наиболее рациональную тактику.
В настоящее время общепризнана комплексная терапия больных ттефробластомой, в которую входит оперативное удаление опухоли, лучевое и интенсивное лекарственное лечение.
Лечение детей с пефробласпюмои зависит в основном от стадии заболевания и морфологического строения опухоли. Предварительно выполняют цитологическое исследование материала, полученного при аспирационной пункции опухоли тонкой иглой, В случае отсутствия морфологического подтверждения диагноза (при опухоли Вильмса I стадии, когда получить материал трудно из-за небольшого размера новообразования) рекомендуется органосохраняющее оперативное вмешательство. При выполнении операции необходимо срочное гистологическое исследование ткани но краю резекции опу- хоч и.
При морфологическом подтверждении диагноза на первом этапе назначают предоперационную химиотерапию. На втором этапе проводится нефроуретерэктомия (Шароев Т.А., 2о06).
По данным Международного общества детских урологов, поли- химиотсрапия позволяет «сдвинуть» стадию заболевания с более
Таблица 28
Методы обследования дегей с опухолью почки
|
Методы обследования |
Описание |
|
Анамнез |
Выяснение общего состояния, семейного анамнеза по опухолевым заболеваниям и врожденным аномалиям |
|
Осмотр |
Измерение артериального давления, массы тела, роста; выявление оттухолево1х образований, врожденных аномалий, особенно мочеполовой системы, гемигипертрофии и атшридии |
|
Лабораторные исследи ван и я |
Общий анализ крови; анализ мочи; определение уровней креатинина, остаточного азота, щелочной фосфатазы, уровней катехоламинов |
|
Рентгенография |
Прямые, боковые рентгенограммы; внутривенная урография |
|
|
Ультразвуковая томография для выявления изменений в противоположной почке и наличие опухолевого метастаза в полой вене Изучение костей скелета при светлоклеточной саркоме Изучение костей скелета при светлоклеточной саркоме Компьютерная томография брюшной и грудной полости (головного мозга при рабдоидной саркоме) Ангиография для точного измерения опухоли в обеих почках и мониторное лечение при двусторонней опухоли |
высокой на более низкую, что улучшает прогноз. Эта закономерность часто встречается в педиатрической онкологии.
Оперативное лечение остается основным в комплексной терапии больных опухолью Вильмса, Полностью удаляют все пораженные опухолью ткани, определяют стадию процесса для правильного назначения дальнейшей адъювантной терапии. В большинстве случаев показана радикальная кефроуретерэктомия, и только при Т стадии возможна резекция поики (pF-re. 29.8).
Основные принципы оперативного лечения больных нефроблаг- томой:

Рис. 29.8. Опухоль Вилъмса (макропрепарат)
- трансперитонеальньн доступ, при котором можно произвести тщательную ревизию органов брюшной полости (печени, лимфатических узлов забрюшннного пространства и второй почки) и при необходимости выполнить биопсию;
- тщательное атравматичное удаление опухоли с предупреждением ее разрыва и минимальным манипулированием опухолью;
- удаление нефробластомы с предварительной перевязкой почечной артерии и вены;
- обязательная диссекция парааортальных и паракавальных лим фатических узлов;
•маркировка ложа опухоли в зоне сомнительно радикального удаления рентгеноконтрастными клипсами для планирования зон обчучения;
- биопсия и иссечение всех подозрительных участков тканей.
Отдельные авторы прибегают к лапароскопическому методу
(Denes F. et al., 2006).
Химиотерапия. Наиболее широко используются сочетания дак- тиномицина, циклофосфана, винкристина и адриамицина.
Для предварительного лечения предлагается следующая схема: винкристин 1,5 мг/м2 внутривенно в 1-й, 8-й, 15-й день (максимальная разовая доза 2 мо); дактиномишш 1000 мкг/м2 внутривенно капельно в 1-й день па 400 мл изотонического раствора хлорида натрия.
Если к 15-му дню не происходит значительного уменьшения опухоли (более чем на 50%), то вместе с 3-м введением винкристина внутривенно вводят 40 мг/м2 адрпамидина.
При нефробластомах I стадии с благоприятным гистологическим строением необходимо провести короткий курс дооперапионной химиотерапии дактиномицином и винкристином. У больных со II стадией (при метастазах в регионарные лимфатические уз ты) и с Ш стадией введение дополнительного адриамицина снижает частоту рецидивов заболевания,
В европейских странах до операции лекарственное лечение проводят двумя препаратами, а схемы послеоперационной химиотерапии определяются в зависимости от стадии заболевания и гистологического строения нефробластомы. Гак, при I стадии (включая анапластические опухоли) послеоперационное лечение осуществляется коротким курсом с использованием двух препаратов; при II стадии (без поражения регионарных лимфатических узлов метастазами) можно применять трехкомпонептное лекарственное лечение в течение 28 нед; при II стадии с метастатическим поражением регионарных лимфатических узлов и III стадии химиотерапия может быть аналогичной проводимой при II стадии, но дополняется лучевой терапией (15 Гр + локальное облучение небольшими полями зон нерадикального удаления опухоли в дозе 10-15 ГрУ
Лучевая терапия. В 50-е годы лучевая терапия была единственным средством, дополняющим оперативное лечение. Эта комбинация позволила улучшить результаты лечения с 20% до 50-57% (Paterson IX, 1958; Kmzel J. et al., 1960; и др.). Предоперационное облучение использовали в основном у детей с первично большими опухолями с целью уменьшения их размеров. Применение пред- и послеоперационной лучевой терапии должно более значимо увеличивать эффективность комбинированного лечения больных нефробластомои за слет включения всех положительных механизмов, направленных на увеличение радикальности оперативных вмешательств (предупреждение развития местнорегионарных рецидивов и разрыва опухоли во время операции, снижение опасности развития отдаленных метастазов). Однако, несмотря на положите п ьные моменты лучевой терапии, в последние годы ее роль в комбинированном лечении снизилась, что объясняется появлением новых эффективных противоопухолевых препаратов и их сочез аний.
Многолетние кооперативные исследования, проведенные в США и Европе, позволили сформулировать современные показания к применению лучевой терапии (таб. 29).
Начало облучения с 6-8-го дня после операции. Вся брюшная полость подвергается лучевому воздействию, если имеются остаточные перитонеальные имплантаты или если был разрыв капсулы опухоли с обсеменением брюшной полости.
Ряд авторов (D'Angio J. ct al., 1978; Thomas T. ct al., 1984) подчеркивают необходимость строгого соблюдения сроков начала терапии: больные, у которых лучевая терапия осуществлялась через 10 дней после операции и более, имели значимо больший риск местного рецидива заболевания по сравнению с детьми, у которых лучевое воздействие начинали в более ранние сроки.
Перед операцией в зону лучевого воздействия включают пораженную почку с ее сосудами и лимфатическими узлами. Верхняя граница располагается на уровне купола диафрагмы, нижняя — на уровне нижней мезентериальной артерии, внутренняя — за средней линией, по противоположному краю позвоночного столба. В общем мишень облучения составляют опухоль или сс ложе (при рецедиве), почка или ее ложе (при рецидиве) с 2-3 см от ее края. Границы мишени те же и в послеоперационном периоде, за исключением того, что облучают не почку, а ее ложе. При необходимости допоянительного локального облучения ложа опухоли вследствие остаточной опухоли, неблагоприятного гистологического строения нужно исключить облучение позвоночника.
При облучении всей брюшной полости необходимо тщательно защищать тазобедренные суставы для предупреждения нарушения роста костей, что в отдаленные сроки может привести к соскальзыванию головки бедра. Это осложнение встречается даже при дозах ниже 20 Гр.
Правильный выбор объема облучения нс только уменьшает число отдаленных осложнений, но и отчетливо влияет на исход заболевания: использование ограниченных полей облучения ведет к увеличению числа рецидивов опухоли (Thomas D. et al., 1984).
Лучевая терапия осуществляется на дистанционных мегаволь- тных аппаратах (гамма-терапевтических установках типа «Рокус», линейных ускорителях, генерирующих фотоны с энергией 4-4 МэВ) с использованием двух противолежащих встречных полей (переднего и заднего).

При современном комплексном лечении детей с нефробластомой необходимо подведение относительно невысоких доз (суммарной очаговой дозы) ионизирующего излучения.
При необходимости облучения всей брюшной полости рекомендуют дозу 10 Гр, рассчитанную на среднюю фронтальную плоскость, разовую очаговую дозу 1,5-1,8 Гр, подводимую 5 раз в неделю (Thomas D., 1092).
В Институте детской онкологии ОНЦ РАМН до настоящего времени при облучении брюшной полости использовали дозы 20- 24 Гр, которые подводили с использованием гиперфракционирова- ния. Суточную дозу 2 Гр делили на две фракции по 1 Гр с интервалом
- ч. Отмечена хорошая переносимость такого курса лучевой терапии без каких-либо выраженных острых реакций кишечника.
При больших опухолях, не реагирующих на полихимиотерапию, а также при опухолях, имеющих неблагоприятное гистологическое строение, рекомендуется дозу на опухоль увеличивать до 40- 45 Гр.
В исследованиях D’Angio et al. (1981) показано, что у маленьких (до 12 мес) детей с нефробластомой I—II стадии с благоприятным гистологическим строением лучевую терапию применять не следует, так как Она не влияет на результаты комбинированного лечения (операция + двухкомпонентиая химиотерапия). При нефробластоме III стадии благоприятного гистологического строения уменьшение очаговой дозы от 20 до 10 Гр (по 1,8 Гр) может увеличить частоту рецидивов после двухкомпонентной химиотерапии (дактиномицин + винкристин). Этот отрицательный эффект не наблюдается, если к двум лекарственным препаратам добавить адриамицин. В результате снижается число поздних лучевых повреждений и повышается возможность излечения клинически не выявляемых до лечения метастазов.
Двусторонняя нефробластома. Двустороннее поражение потек обнаруживается у 5% детей с. нефробластомой. Каждый больной с синхронной двусторонней опухолью нуждается в индивидуальном подходе. Тактика зависит от распространенности процесса в каждой почке.
При удовлетворительной функции почек современная полихимиотерапия может обеспечить регрессию опухоли, достаточную для ее экономного удаления. Сначала можно использовать двухкомпонентную химиотерапию (дактиномицин + винкристин), а в случае ее малой эффективности назначают другие химиопрепарагы. При показаниях облучение почки проводят в дозе не выше 16 Гр по 1,6-1.8 Гр
- раз в неделю. Повышение дозы несет опасность развития лучевого нефрита в единственной почке. Послеоперационное облучение воны удаленной почки проводится в том же объеме и в тех же дозах, как и при лечении односторонней опухоли.
После первой двухсторонней органосохраняющей операции хими- отерапию проводят так же, как при далеко зашедшем одностороннем поражении. При росте опухоли через 1,5-6 мес проводят следующее оперативное вмешательство с целью попытки удаления всей видимой опухоли, выполняя резекцию и ее биопсию. После операции продолжают химиотерапию. Нели при повторной операции всю опухоль удалить не удалось, то через 6 мсс выполняют последующую операцию, направленную на радикальное удаление опухоли с двух сторон, вплоть до перевода в рскопривное состояние с последующим программным гемодиализом и пересадкой донорской почки.
Лечение больных с метастазами в легкие. Проблема лечения больных нефробластомой, имеющих метастазы в легкие (наиболее частое метастазирование), остается актуальной. В настоящее время обсуждается комплексное лечение этих детей с оперативным удалением метастазов. Как полагает большинство клиницистов, оперативное вмешательство чаще необходимо для гистологического подтверждения наличия метастазов. Несмотря на опасность нарушения роста грудной клетки и гипоплазии молочной железы (у девочек), необходимо проведение тотального облучения легких. В случаях полной регрессии метастазов после трехкомпонентной химиотерапии (Kraker J1992). Все легкое рекомендуется облучать в дозе 12 Гр.
В Институте детской онкологии ОНЦ РАМН при облучении легких использовали гиперфракционирование. Облучение проводили на гамма-тсрапевтическои установке типа «Рокус» и на линейном ускорителе фотонами 4-6 МэВ с двух встречных полей (переднего и заднего) с обязательным включением всей мишени в 80% изодоз- ную кривую и защитой позвоночного столба свинцовыми блоками. Суточную дозу 2-2,4 Гр разделяли на два сеанса по 1-1,2 Гр с 4-часовым интервалом; курс составил 7 дней, всего 14 фракций. Полная регрессия остаточных метастазов отмечена у 53% детей. Эффективность химиолучевого лечения была выше у детей с односторонним изолированным поражением легких и меньшим числом метастазов, а также при более длительном интервале между сроками окончания первичного лечения и диагностированием метастазов. При одновременном лекарственном и лучевом лечении получен худший эффект, чем при химиотерапии, предшествовавшей облучению.
На результаты лечения существенно влияет стадия онкологического процесса. Так, при I стадии добиваются выздоровления у 90-98% больных, при II стадии — 95%, при III стадии — до 70%, при IV стадии только до 50% (Шароев Т.П., 2006). При двустороннем поражении в зависимости от распространенности процесса излечение составляет от 10 до 50% случаев.
. Ангиомиолипома почки у детей встречается крайне редко (Мегера В.В.и др., 2000). До настоящего времени неясно, следует ли эту опухоль относить к истинным доброкачественным опухолям почки или она является пороком развития. Ее основой являются жировая ткань, кровеносные сосуды и гладкомышечные волокна. Больным показано постоя иное наблюдение у специалиста, при сомнении в диагнозе чрескожная биопсия. При выраженном болевом синдроме проводят оперативное вмешательство.
