Почечная недостаточность — сложный симптомокомплекс с необратимым нарушением всех функций почек и прежде всего их способности к поддержанию постоянства внутренней среды организма и очищению крови от продуктов метаболизма.
По клиническому течению различают острую (ОПН) и хроническую (ХПН) почечную недостаточность.
Острая почечная недостаточность. Термином «острая почечная недостаточность» обозначают внезапное нарушение почечных функций с резким снижением или отсутствием образования мочи, задержкой в организме продуктов метаболизма, значительным изменением постоянства внутренней среды. Прекращение или снижение клубочковой фильтрации, вовлечение в патологический процесс канальцев и межуточной ткани сопровождаются гиперволемией, гиперазотемией, дизэлектролитемией и нарушением кислотно-щелочного равновесия.
ОПН в общепедиатрической практике диагностируют у 0,48-1,6% детей (Наумова В.И., 1976). У новорожденных ОПН выявляется в
Этиология и патогенез. ОПН у детей развивается по причинам общего характера или обусловлена непосредственно заболеванием почек. В зависимости от локализации первичного повреждения ОПН подразделяют на прсрсттальную, ренальную и нострсналытуто.
Преренальные причины обусловлены острым нарушением почечного кровотока в результате расстройства системы кровообращения, вызванного шоком (травматическим, геморрагическим, инфекционно-токсическим, анафилактическим), острой дегидратацией, сердечной недостаточностью.
К ренальным причинам ОПН относятся состояния с непосредственным повреждением нефроиа: острое нарушение почечной гемодинамики, повреждение тубулоинтерстициальной ткани, внутрисосудистая блокада почечного кровотока, а также токсическое и аллергическое воздействие лекарственных препаратов, солей тяжелых металлов, ядов.
Пострснальными причинами развития ОПН являются различные патологические процессы, приводящие к нарушению оттока мочи (мочекаменная болезнь, опухоли, аномалии развития мочевой системы).
Основным патогенетическим фактором ОПН у детей является острое расстройство гемодинамики, обусловленное гиповолемией, артериальной гипотензией, компенсаторной централизацией кровообращения и снижением почечного кровотока. Расстройство центральной и внутрипочечной гемодинамики приводит к гипоксии почечной ткани, некрозу наиболее чувствительных к недостатку кислорода эпителиальных клеток почечных канальцев с резким снижением их функции (Игнатова М.С., 1973; Наумова В.И., 1976; Напаян А.В., 1991).
Уменьшение или прекращение клубочковой фильтрации и гипоксическое повреждение базальных мембран канальцев ведут к усилению канальцевой рсабсорбции интралюминарной жидкости. Эта жидкость проникает в интерстициальную ткань, вызывая отек почечной паренхимы и повышение внутрипочечного давления. Необходимо отметить, что в патогенезе ОПН немаловажную роль играют биологически активные вещества, которые выделяют клетки в ответ на повреждение (вазоактивные, просклеротические медиаторы, проста гл а н дины)
Развитию и прогрессированию ОПН способствуют внутрипочеч- ное нарушение гемодинамики, внутрисосудистая блокада кровотока в почке на фоне ДВС-синдрома и первичное повреждение тубулоинтерстициальной ткани почки.
Клиническая картина В клиническом течении ОГ1Н выделяют начальную, олигоанурическую, полиурическую и восстановительную стадии
Симптоматика начальной стадии ОПН разнообразна и в большой степени определяется патологическим процессом как пусковым моментом повреждения почек. Однако уже на этой стадии наблюдается снижение диуреза, что позволяет врачу заподозрить нарушение функции почек и провести соответствующие диагностические и лечебные мероприятия. Начальная стадия может развиваться остро вследствие шока, который сопровождается спазмом периферических сосудов, олигурией и в ближайшие сутки нарушением функции почек. При гнойно-септической интоксикации диурез снижается постепенно, в течение нескольких суток.
Клинические проявления олигоануричсской стадии, обусловлены нарушением азотовыделительной функции, кислотно-щелочного равновесия, электролитного состава крови и анемией. Состояние больного прогрессивно ухудшается, нарастает адинамия, отмечаются сухость кожных покровов, жажда, тошнота, рвота. Из-за развития метаболического ацидоза наблюдается расстройство дыхания, гипергидратация приводит к периферическим отекам, асциту, отеку легких, гидроперикарду, отеку мозга. Ухудшение сердечной деятельности проявляется тахиаритмией, склонностью к сосудистому коллапсу, артериальной гипер-, а затем и гипотензией.
Таким образом, разнообразие клинической картины ОПН в оли- гоанурической стадии обусловлено гипергидратацией и уремической интоксикацией, которые вызваны водно-эле.кгролитными нарушениями, расстройствами кислотно-щелочного равновесия, гиперазотемией и накоплением среднемолекулярных олигопептидов.
Полиурическая стадия сопровождается постепенным увеличением количества выделяемой мочи, состояние больного тяжелое, Азотемия вначале нарастает, в последующие сроки определяется тенденция к стабилизации, возможны тяжелые расстройства водно- электролитного баланса (гипокал и- и гипонатриемия). Нередко поли- урическую стадию называют критической. На период восстановления диуреза приходится 37% летальных исходов ОПН (Папаян В.А., Цыбулькина Г.И., 1991).
Стадия клинического выздоровления обычно продолжается от 25 до 70 дней. Через 2 нед нормализуются диурез, электролитный состав крови, азотовыделительная функция почек и кислотно-щелочное равновесие. Состояние больного стабилизируется и становится удовлетворительным. Однако полное восстановление всех почечных функций продолжается в течение 6-28 мес. Восстановление клубочковой фильтрации и регенерация почечных канальцев происходят медленно. Долго сохраняются низкая относительная плотность мочи, ник- турия. После выздоровления полного структурного восстановления почек не происходит, всегда остаются очаги склеротических изменении (Ольхова Е.Б., 1999).
Диагностика ОПН в начальной стадии затруднена, так как в этот период преобладают клинические симптомы основного заболевания, приведшего к ОПН. В этот период большое значение имеют подробный анамнез, результаты объективного обследования и лабораторные данные. Ультразвуковое допплеровское исследование позволяет определить состояние ренальной гемодинамики, выявить увеличение почек, повышение эхогенности кортикального слоя, что является неспецифическим признаком ОПН (Ольхова Е.Б., 1999).
Диагностика олигоанурической стадии ОПН обычно не вызывает затруднений при внимательном наблюдении за ребенком, анализе лабораторных показателей крови и мочи, объективной оценке функционального состояния жизненно важных органов и систем
Лечение при ОПН заключается в применении консервативных методов и заместительной почечной терапии. Лечение начальной стадии всегда консервативное и направлено на ликвидацию или уменьшение воздействия причины ОПН.
Па ранней стадии наиболее важны противошоковые мероприятия, направленные на устранение гиповолемни и гипоксии, ликвидацию централизации кровообращения, цасстроиств водно-электролитного баланса. Под контролем центрального венозного давления необходима коррекция гипо- и гиперволемии. При ЛД выше 60 мм рт. ст. используют диуретики, артериальная гипотензия является показанием к применению реополиглюкина, альбумина и других кровезаменителей, При гипергидратации наряду с диуретиками вводят гипертонические растворы глюкозы (20-40% раствор глюкозы с добавлением 1 ЕД инсулина на 4 г сухой глюкозы). Применение низкомолекулярного осмотического диуретика — маннитола способствует повышению почечного кровотока, расширяет сосуды коркового слоя почек, способствует улучшению клубочковой фильтрации и снижению сопротивления афферентных и эфферентных артериол в результате освобождения простагландинов.
Петлевой диуретик — фуросемид, способствует расширению сосудов кортикального слоя почек, ингибирует реабсорбцию натрия, приводит к повышению диуреза. Необходимо отмстить, что использование фуросемида дает хороший эффект лишь на ранних стадиях ОПН.
При необходимости воздействия на метаболический ацидоз количество вводимого 4% раствора гидрокарбоната натрия рассчитывают по формуле: дефицит основании X масса тела/3 = количество вводимого внутривенно 4% раствора бикарбоната натрия.
Для стимуляции обменных процессов при ОПН незначают АТФ, ко к ар б оке и лаз у, глутаминовую кислоту, витамины группы В. Снижение распада белков и стимуляция секреторной активности канальцевого эпителия достигаются введение?' анаболических стероидов (неробол, ретаболил, тестостерон и др.).
Олигоаиуривеская стадия с гиперазотемией явлениями гипергидратации и диеэлектролитемией является показанием к проведению заместительной терапии. Применение гемодиализа, перитонеального диализа необходимо начинать при установлении анурической стадии ОПН, не дожидаясь высокой азотемии и клинических проявлений интоксикации. Короткие (2 ч) ежедневные сеансы гемодиализа легче переносятся старшими детьми с ОПН и позволяют предотвратить нарастание азотемии и электролитных нарушений.
У больных с уремической и гнойной интоксикацией более эффективна гемофильтрация или гемодиафильтрация.
Лечение полиуричсской стадии заключается в создании водного режима. Детям не ограничивают прием жидкости, поваренной соли, увеличивают калорийную нагрузку. При нормализации азотемии и скорости клубочковой фильтрации больного выписывают под амбулаторное наблюдение.
Хроническая почечная недостаточность — сложный сим птомоком- плекс, вызванный гибелью нефронов который развивается у больных в результате прогрессирования патологического процесса различной этнологии в почках. Угасание функции почек связано с динамикой потери числа функционирующих нефронов и может продолжаться от нескольких дней до многих месяцев и лет. Почечная недостаточность, продолжавшаяся более б мес, считается хронической.
Распространенность. В мире число детей с терминальной почечной недостаточностью составляет от 5 до 14 на 1 млн населения в год (Fine R.N. et al„ 1984; Loirat C. et al., 1994). В Российском регистре детей с ХИН в 2002 г. зарегистрировано 966 человек (Молчанова Е А., Валов А.Л., 2004). Необходимо заметить, что в регистре в силу разных причин сильно занижено число пациентов.
Распространенность ХПН колеблется в зависимости от возраста пациентов. 5,1% детей сХТТП моложе 5 лет; 25,5% — 6- 10 лет; 69,7% — 5.1-16 лет, т.е. более половины больных составляют дети старшего
возраста. В заместительной терапии нуждаются 32% больных в возрасте до 5 лет, 72% — 6-10 лет и 87% ботьных 11-16 лег (Broyer М. et ad-, 1993).
Больных с ХПН значительно больше, чем получающих заместительную терапию. Следовательно, оценка распространенности ХПН по числу больных, получающих заместительную терапию, неадекватна и нуждается в серьезных коррективах.
Классификация ХПН Существует множество классификаций ХПП. Классификация ХПН, предложенная Международной классификацией болезней (МКБ 10), малопригодна в практической работе, поскольку не учитывает уровень азотемии и клинические проявления уремии.
Наиболее приемлема с клинической точки зрения классификация, предложенная Н. А. Лопаткиным в 1972 г., по которой различают латентную, компенсированную, иптермиттирующую и терминальную стадии почечной недостаточности. Традиционные биохимические методы исследования крови и мочи позволяют определить суммарное нарушение функции почек и стадию почечной недостаточности при отсутствии нарушения пассажа мочи и остром воспалительном процессе в почках.
Этиология и патогенез. Многие авторы считают большую часть заболеваний наследственными (Chavers R.M et aL., 1994; Hardy А.М., 1995; Johnson R.W.C., 1996; Matas A.J., 1996).
Этиология ХПН у детей различна в различных возрастных группах. D. Potter и соавт. (1980) выделяет три возрастные группы детей с терминальной почечной недостаточностью. Большинство детей с обструктивной уропатией относятся к младшей возрастной группе, а опухоль Вильмса наблюдается исключительно у детей до 5-летнего возраста. Более трети заболеваний, приводящих к терминальной почечной недостаточности у детей, являются урологическими; у 36% пациентов обнаруживается обструктивная уропатия, дис- и гипоплазии почек и пиелонефрит, и только у 4,6% детей — гломерулонефрит,
Представленные сведения существенно отличаются от причин развития ХПН у взрослых, у которых до 30% занимает гломерулонефрит.
Этиологические факторы, характерные для ХПН у детей, secbivfa четко акцентируют некоторые стороны патогенеза, что позволяет говорить о характерных его особенностях.
Несмотря на многообразие этиологичсских факторов, морфологические изменения в почках при выраженной ХПН однотипны И сводятся к преобладанию фибробластических процессов с замещением функционирующих нефронов соединительной тканью, гипертрофией оставшихся (ремнантных) нефронов и утратой морфологического своеобразия исходного процесса. Повышенная нагрузка на функционирующие иефроны усугубляет их структурные изменения и является, по современным представлениям, основным неиммунным механизмом прогрессирования ХИН. При уремии наблюдается ряд приспособительных феноменов, облегчающих работу почек. Например, хорошо известна ретенция уратов у больных с ХИН, что приводит не только к повышению содержания мочевой кислоты в сыворотке крови, по и к выпадению ее кристаллов в мягких тканях, Параллельно задержке уратов в сыворотке крови больных накапливаются гиппуровая кислота и индоксил сульфат, ингибирующие транспорт уратов в канальцах и способствующие увеличению фракционной экскреции мочевой кислоты. Сказанное справедливо и в отношении ряда других веществ. Так, повышение в крови количества азотистых шлаков увеличивает осмотическую нагрузку на почки, что приводит к повышению экскреции воды, мочевины, креатинина и т д. Не случайно после первых процедур гемодиализа у большинства больных одновременно со снижением концентрации в крови мочевины сокращается и диурез (Тареева И.Е., 2000),
Клиническая каритина. Течение болезни и ход лечения терминальной почечной недостаточности у детей, в отличие от взрослых, имеет целый ряд существенных особенностей, связанных с ростом и массой тела, этиологией, клиническими проявлениями, гормональными изменениями, половой зрелостью и другими факторами (Holliday М.А. et al., 1994; Schaefer 1 et ah, 1996). К ним относятся; задержка психомоторного развития, анемия, артериальная гипертензия, сердечно-сосудистые осложнения, гипергидратация.
Для латентной стадии (клубочковая фильтрация 50-60 мл/мин) характерно типично течение с полиурией, никтурией, гипертензией, умеренно выраженной анемией в результате снижения почечного синтеза эритропоэ ги на.
Компенсированная и интермиттирующая стадии (клубочковая фильтрация 15-49 мл/мин) сопровождаются полиурией с никтури- ей, слабостью, снижением трудоспособности, похуданием. У большинства больных выявляют гипертензию и анемию. На этих стадиях эффективна консервативная терапия
При терминальной стадии (клубочковая фильтрация ниже 15 мл/мин) полиурия часто сменяется олигурией. Больные вялы,
апатичны. У них резко снижен аппетит (вплоть до анорексии), во рту сухость и неприятный вкус, отмечается тошнота. Типичны резкая слабость, зябкость, инверсия сна, кожный зуд, тонические судороги икроножных мышц. Гипертензия часто становится трудно контролируемой, приводит к резкому снижению зрения, острой левожелудочковой недостаточности с отеком легких. Кожа сухая, бледная или желтушная с серым оттенком (вследствие анемии и «прокрашивания» урохромами), геморрагиями и следами расчесов. Нередко развиваются моноартриты вследствие вторичной подагры, больные жалуются на боли в костях и позвоночнике (гиперпаратиреоя), парестезии и резкую слабость в нижних конечностях (нолинейропа- тия), носовые кровотечения.
При далеко зашедшей уремии обнаруживаются запах аммиака изо рта, периодичес кое дыхание (декомпснеированный метаболический ацидоз), перикардит, уремическая прекома,
В тер мин ильной стадии ХПИ спасти жизнь больному может только заместительная почечная терапия.
Задержка психомоторного развития, С увеличением продолжительности диализотсрапии возрастает количество неврологических осложнений (Chan С M.J., 1979). 11о мнению R.S. Fennell et al. (1990), ]
главная причина задержки психомоторного развития заключается не в уремии самой по себе: многие дети с врожденными заболеваниями почек имеют пороки развития других органов и систем, включая ЦНС, которые являются причинами задержки развития ребенка и 1 могут проявляться через длительный промежуток времени уже на : стадии заместительной терапии (Polinsky M.S. et al., 1987).
В качестве одной из существенных причин, способствующих задержке развития, можно назвать недостаточность питания (Evans D, et al., 1980; Arnold W.C., 1983). Кроме того, дети с ХПИ испытывают отрицательное психологическое воздействие родителей и медперсонала, связанное с длительным пребыванием в стационаре, многократными болезненными процедурами, общим истощением, ограничением подвижности и отсутствием нормального социального окружения. Так, установлена.зависимость между числом дней, проведенных в больнице, и показателями роста пациентов (Kleinknecht S. et al., 1983).
Остеодистрофия. В сыворотке крови низкий уровень гормона роста, повреждения появляются прежде всего в метафизарпых зонах. Заболевания зубов отмечены только при ХГП I с младенческого возраста (Bublitz Л. et. al., 1981), что требует специального внимания.
Анемия Патогенез анемии при почечной недостаточности довольно хорошо изучен В норме 90% эритропоэтина синтезируется в проксимальных канальцах почки или в интерстнции (Ермоленко В.М., 1997; Шейман Д.А., 1997; Shaw R., 1967; Ahern M.J., 1989).
Кроме уменьшения синтеза эритропоэтина в пораженных почках, на снижение его уровня в кровь влияет дефицит железа, витаминов группы В и фолиевой кислоты (Юданова Л.С. и др., 1992; Шостка Г.Д., 1995; Geerling W., 1993). Кроме того, азотемивеская интоксикация ингибирует активность эритропоэтина (Radtke H.W., 1981). Достоверно установлено, что у детей с ХГ1Н происходит значительное снижение уровня гемоглобина в крови при уменьшении клиренса эндогенного креатинина ниже 35 мл/мин (Schrcr К., 1987). При одном и том же уровне креатинина у взрослых содержание гемоглобина выше на 20 ЕД, чем у детей.
Анемия является одной из главных причин сердечной недостаточности, в частности гипертрофии левого желудочка. S. Berweck (2000) отмечает уменьшение гипертрофии левого желудочка через некоторое время после уменьшении анемии и повышении уровня гемоглобина до 100-110 мг/л и гематокрита до 40%. Коррекция анемии вызывает повышение аппетита, увеличение двигательной активности и нормализацию гормонального статуса.
Артериальная гипертензия отмечается тогда, когда систолическое давление превышает 150 мм рт.ст. По данным К. Schrer (1981) 79% пациентов из 119 детей с терминальной почечной недостаточностью нуждались в назначении гипотензивной терапии. Частота и тяжесть гипертензии у детей зависят от первичного заболевания, продолжительности болезни и способа лечения.
Чаще всего артериальная гипертензия вызывается нарушениями водно-солевого баланса. В 65% наблюдений при гипертензии удается добиться устойчивого снижения артериального давления (АД) с помощью диеты с ограничением поваренной соли и жидкости, и проведением ультрафильтрации с достижением «сухого веса» (Brennan B.L., 1980).В ряде случаев повышение артериального давления связано с гемодинамическими нарушениями, которые вызваны увеличением общего периферического сопротивления. По данным M.S. Neff (1971), диастолическое давление и общее периферическое сопротивление повышались при увеличении гематокрита до 40% в случаях назначения больным эритропоэтина. Снижение дозы эритропоэтина и назначение вазодилататоров позволяют коптротировать артериальное давление,
Активация системы ренин-ангиотензин-алъдостерон вызывает артериальную гипертензию, наиболее плохо поддающуюся лечению, В большинстве случаев удается снизить артериальное давление с помощью каптоприла. Если диета и медикаментозная терапия ие приносят успеха, выполняют билатеральную нефрэктомию.
По разным данным артериальная гипертензия наблюдается у 80-95% больных с терминальной почечной недостаточностью.
В.В Сафонов (2003) проанализировал результаты обследования 128 пациентов, находившихся на программном гемодиализе. Артериальное давление было повышено у 86,4% взрослых пациентов и у 78,7% детей. Это свидетельствует о том, что артериальная гипертензия в детском возрасте не менее актуальна, как и у взрослых.
Артериальная гипертензия у больных на гемодиализе имела несколько вариантов развития.
При первом варианте в процессе введения больных в диализную программу после удаления избыточной жидкости, достижения «сухого веса», регуляции питьевого режима у 30% детей и 26% взрослых пациентов артериальное давление нормализовалось без дополнительных усилий и медикаментозной терапии.
При втором варианте у 62% детей и 66% взрослых пациентоз, несмотря на устранение гиперволемии, артериальное давление оставалось повышенным и достигало 180-220/140-160 мм рт.ст. несмотря на гипотензивную терапию. Назначение гипотензивных препаратов позволило поддерживать АД на уровне 140-160/100 мм рт.ст. Такое артериальное давление приемлемо для проведения пересадки почки.
При третьем варианте у 8% дегей и 8% взрослых пациентоь артериальное давление достигало 180-240/120-140 мм рт.ст. и не поддавалось консервативной терапии. Такая «злокачественная гипертензия» исключает трансплантацию почки. Единственным способом корригировать «злокачественную гипертензию» у этих больных является билатеральная нсфрэктомия и перевод в рснопривное состояние. Эта дополнительная операция (как минимум одна) лишает больного остаточной функции почек, что усугубляет его и без того тяжелое состояние. Реиопривное состояние подразумевает и выключение эндокринной функции почек.
Таким образом, проблема артериальной гипертензии одинаково остро стоит как у детей, так и у взрослых пациентов с терминальной почечной недостаточностью. В.В. Сафонов и соавт. (2003) не выявили заметной разницы ни в час готе, ни в эффективности того или иного вида коррекции артериального давления у детей и взрослых пациентов.
Анатомо-функциональное состояние сердечно-сосудистой системы. Тяжелые изменения функции сердечно-сосудистой системы являются главной причиной смерти детей с ХИН. Течение и прогноз сердечно-сосудистых осложнений у детей с герминальной почечной недостаточностью существенно отличаются от таковых у взрослых. Атеросклероз, ишемическая болезнь сердца, эндокардит, обычные у взрослых, у детей встречаются чрезвычайно редко. Напротив, гипер- калиемическая остановка сердца и перикардит остаются наиболее распространенными осложнениями у детей (Schrer К. et al., 1987). У 2/3 детей па гемодиализе выявлена кардиомегалия как компенсация недостаточности сократительной функции желудочков, у 1/3 детей — левожелудочковая недостаточность, особенно при гипертензии (Bosch A. ct al., 1990). Сосудистые осложнения, такие, как атеросклероз и инфаркт миокарда, у детей встречаются крайне редко (O’Regan S., 1984).
По данным В.В. Сафонова (2003), у всех обследованных детей выявлена гипертрофия левого желудочка и межжелудочковой перегородки. Ее выраженность прямо зависит от сроков диализотерапии: чем дольше диализотералия, тем больше выражена гипертрофия левого желудочка. У детей, которые находятся на диализе больше 1 года, отмечается дилатация сначала левого желудочка, а затем и других полостей сердца.
Дисфункция клапанов сердца свидетельствует о недостаточности клапанного аппарата. Она выявлена у детей, которые находились на программном гемодиализе больше 15 мес. По-видимому, дисфункция клапанов обусловлена нарушением пропорции сердца в результате расширения его камер, с одной стороны, и потери свойств эластичных и мышечных компонентов клапанов из-за хронической интоксикации и нарушения трофики — с другой.
На сериях ЭЮ' у детей отмечается отрицательная динамика. Глубина изменений прямо зависит от продолжительности диализотерапии. К типичным следует отнести проявление электролитных нарушений. Заостренный зубец Г в отведениях V^-Vg (рис. 28,1). Форма зубца 7'свидетельствует о гиперкалиемии (содержание калия gt; 5,5 ммоль/л), с одной стороны, и о гипоксическом поражении миокарда — с другой.
Удлинение комплекса QRST более 0,38 с, т.е. увеличение его продолжительности, является признаком гипокал ьциемии (рис. 28.2). Эта особенность ЭКГ по мере продолжения гемодиализа проявляется у всех детей.
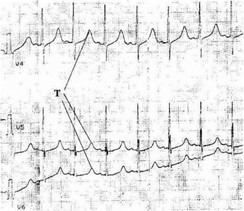
Рис. 28.1. Заостренный зубец Т — электрокардиографический признак I инеркалиемии и гипоксии миокарда
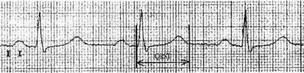
Рис. 28.2. Удлинение интервала QRST — электрокардиографический признак гипокальциемии
При продолжении диад изотерапии на сериях ЭКГ появляются признаки перегрузки правого предсердия в виде высокоамплитудного зубца Р в отведениях I, И, aVF (рис. 28.3), а также трофические изменения миокарда.
Динамические изменения ЭКГ соответствуют данным других методов исследования и указывают на то, что у детей при проведении программною гемодиализа довольно быстро развивается сердечная недостаточность.
Шйш _
Рис. 28.3. Перегрузка правого предсердия — высокий зубец Р
Рентгенография грудной клетки полностью подтверждает результаты всех предыдущих методов исследования; расширение границ сердца как влево, так и вправо, увеличение КТИ свыше 0,4 и углубление «талии» сердца (рис. 28.4).
При длительной диализотерапии (более 17 мес) в результате развития дистрофических процессов в миокарде на рентгенограмме нередко определяется «каплевидное» сердщ (рис. 28.5). Такой рентгенологический признак (в сочетании с данными других методов исследования) является предвестником декомпенсации сердечной недостаточ ности,
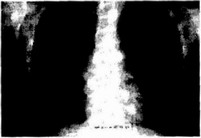
Рис, 28.5. Рентгенограмма грудной клетки. Дистрофия миокарда - «каплевидное» сердце
Тяжелые анагомо-функциональные нарушения выявлены у всех без исключения детей с терминальной почечной недостаточностью, находившихся на программном гемодиализе, У взрослых эти нарушения развиваются в 2 раза реже и выражены гораздо меньше, чем у детей. Кроме того, у взрослых пациентов сердечная недостаточность при проведении гемодиализа развивается в несколько раз медленнее, чем у детей.
Довольно быстрое развитие сердечной недостаточности в детском возрасте обусловлены несколькими факторами, среди которых, помимо азотемической интоксикации, наиболее важными считаются:
¦ гиперволемия;
В связи с этим всем детям, находящимся на программном гемодиализе, проводится кардиотропная терапия. Помимо диеты с исключением продуктов, содержащих калий, и регуляции «сухого веса», который достигается жестким ограничением жидкости и ультрафильтрацией, она включает в себя назначение сердечных гликовидов (дигоксин), препаратов, улучшающих трофику миокарда (рибоксин по 100 мг 2 раза в сутки в течение 3-4 иед, цитохром С по 50,0 мг внутривенно капелвно в течение 10 днем), ингибитора ангиотен- зинпревращающего фермента (каптоприл по 25-50-100 мг/сут в зависимости от величины артериального давления) После курса кардиотропной терапии состояние миокарда необходимо контролировать путем систематического проведения ЭКГ и эхокардиографии. При появлении отрицательной динамики курс проводимой терапии необходимо повторить.
Никакая терпия не может компенсировать перечисленных отрицательных факторов иафуикциюмиокарда. Развитие сердечной недостаточности не удается предотвратить и компенсировать ( Данилков А. И 1996).
Поэтому для детей с терминальной почечной недостаточностью единственным способом предотвратить развитие сердечной недостаточности и продлить жизнь является трансплантация почки.
У взрослых пациентов, в отличие от детей, любой вид диализа и трансплантация почки служат альтернативными методами лечения.
Иммунный статус. Традиционно считается, что дети с почечной недостаточностью страдают иммунодефицитом (Наумова В.И., 1991). В литературе много работ, свидетельствующих о предрасположенности детей с ХПН к инфекционным заболеваниям, о снижении их способности к полноценной реакции на бактериальную и вирусную инфекцию, о склонности к генерализации инфекционного процесса и развитию сепсиса (Игнатова М.С., 1986). В пользу этого вывода говорят и работы А.К. Цыбышевой (1983), М.В. Brenner (1987), которые сообщают об уменьшении у детей с ХПН продукции IgM, лимфопении, дефиците Т- и В-лимфоцитов, снижении фагоцитарной активности гранулоцитов, т.е. о снижении главных показателей гуморального и клеточного иммунитета. S М. Friedman (1981),
S. Mezzano (1984) и М.С. Игнатова (1986) объясняют это уремической и песпецифической интоксикацией, нарушением продукции лейко- поэтинов, подавлением ферментной системы лимфоцитов.
Приведенные сведения предполагают менее агрессивный иммунный ответ после трансплантации почки у детей по сравнению со вipoc- лыми пациентами. Между тем положительные результаты трансплантации почки у взрослых пациентов, по сведениям большинства авторов, как правило, несколько лучше, чем у детей (Сутыко А.Д., 1995, 1996; Ettenger R.B., 1989; Tejani А., 1994, 1995; Hardy А.М., 1995). Только усиленная иммуиосупрессивпая терапия позволяет увеличить 3-лст- inofo выживаемость больных с 89% в 1980-1985 г. до 94% в 1986-1991 г.
Увеличение выживаемости наблюдалось во всех возрастных группах (Loirat С et al., 1994). Годичная выживаемость трансплантата составила у детей от живого родственного донора и после трупной трансплантации почки — 84% и 59% соответственно и в младшей возрастной группе — 77% и 65% соответственно (Loirat С. et al, 1994).
На выживаемость больных и трансплантата влияет множество различных факторов. Наибольшее значение имеют иммунная совместимость и исходное состояние иммунитета у реципиента (Василенко И.А., 1998; Цветков Д.В., 1998; Gjertson D.W., 1996; Giral- Classe М. et al., 1998; Tanabe К., 1998).
В.В. Сафонов (2003) провел сравнительный анализ исходного состояния иммунитета у детей и взрослых. Для оценки состояния клеточного иммунитета было определено общее число лейкоцитов в периферической крови реципиентов, ожидающих трансплантации почки. Определили также относительное содержание лимфоцитов и их субпопуляций в крови. Оказалось, что у детей и взрослых, находящихся на программном гемодиализе, поддерживается удовлетворительное напряжение клеточного иммунитета. Число лимфоцитов и их субпопу тяций соответствеует норме. Однако у детей число Т- хелперов (CD4) в 1,4 раза достоверно превышает анало1 ичный показатель у взрослых. В связи с этим соотношение CD4/CD8 тоже выше у детей. Более того, напряжение иммунитета у детей, находящихся на программном гемодиализе, выше, чем у группы взрослых больных.
Все авторы единодушны в том, что для достижения аналогичных результатов дети после трансплантации почки требуют более активной индукционной и базовой иммуносупрессии, чем взрослые пациенты.
Состояние желудочно-кишечного тракта. Для контроля за состоянием желудочно-кишечного тракта применяют эзофагогастродуо- деиоскопию. П.Л. Щербаков (1998) пришел к выводу, что и у детей (83%), и у взрослых (81%), больных с ХПН, встречаются гастриты разной формы (рис. 28.6).
Это может быть диффузная или звездная гиперемия слизистой оболочки, утолщение складок, гиперплазия слизистой оболочки различной выраженности.
Вторыми по частоте заболеваемости являются бульбит и дуоденит у детей (60 и 70% соответственно) и у взрослых (77 и 84%).
Дуоденит выражается в виде утолщенных складок, гиперемии, лимфапгиэктазий в постбульбарных отделах двенадцатиперстной кишки.
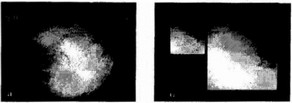
Рис. 28.6. Гастроскопия.
а — гастрит «булыжная мостовая»; б — геморрагический гастрит
Эрозии слизистой облочки пищевода и желудка (рис. 28.7) встречаются у 30% детей и 22% взрослых пациентов.
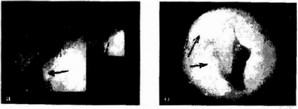
Рис. 28.7. Гастроскопия. Эрозии желудка (а) и двенадцатиперстной кишки (б)
Язвы желудка бывают единичными, различной глубины, округлой формы, с ровными краями, размером 0,4-1,2 см (рис. 28.8).
Отметим, у взрослых пациентов не встречаются язвенные поражения слизистой оболочки желудка.
Косвенные эндоскопические признаки панкреатита в виде инт- рамукозных точечных кровоизлияний различной давности, преимущественно в кардиальном отделе и теле желудка, и папиллит выявляются у 17% детей.
Всем больным необходимо проводить соответствующую терапию, в частности, при незначительных воспалительных изменениях
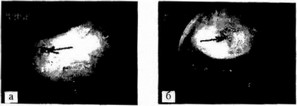
Рис- 28.8. Гастроскопия. Язвы желудка (а) и луковицы двенадцатиперстной кишки (б)
назначают: спазмолитики (но-шпа, никошпан) и ферменты (мезим форте, панзшюрм, фестал) в обычных дозах.
Эрозивные и язвенные поражения слизистой оболочки требуют болееактивпого лечения. Например, применяютранитидинилиомез— по 1 капсуле 2-3 раза в сутки; метронидазол (трихопол) — по 250 мг 2 раза в сутки; фосфалюгель — по 1 столовой ложке 3-4 раза в сут.
Кровотечение из язвы слизистой облочки останавливают элет- рокоагуляцией или химической коагуляцией. Затем назначают гемостатическую «болтушку» по 1 столовой ложке в 1 ч на фоне вышеуказанной противоязвенной терапии. «Болтушка» содержит аминокапроновую кислоту 100,0; атропин 0,1 %—1,0, гемостатическую губку; яичный белок, плазму крови (любая группа) 100,0 мл.
Таким образом, практически у всех больных с ХПН отмечается поражение органов желудочно-кишечного тракта. Эзофагодуодено- скопию необходимо проводить не реже 1 раза в 3 мес.
Состояние мочеполовой системы. Гладкое течение посттрансплантационного периода во многом определяется состоянием мочеполовой системы реципиента. Так, диспластическая фоновая патология (ап пази я, гипоплазия почек) не вызывает патологических изменений трансплантата. Больным без воспалительного процесса мочевых путей проводят трансплантацию почки без предварительной оперативной и антибактериальной подготовки.
Вместе с тем аутоиммунный или метаболический патологический процесс, приведший к гибели собственных почек, развивается и в почечном трансплантате (возвратный гломерулопефрит, окса- лоз). Некоторые заболевания собственных почек могут привести к гибели трансплантата и даже реципиента (гипертензия и хронический пиелонефрит). Б связи с этим необходимо урологическое обследование при подготовке реципиента к трансплантации почки. Результаты обследования могут существенно влиять на подготови
По клиническому течению различают острую (ОПН) и хроническую (ХПН) почечную недостаточность.
Острая почечная недостаточность. Термином «острая почечная недостаточность» обозначают внезапное нарушение почечных функций с резким снижением или отсутствием образования мочи, задержкой в организме продуктов метаболизма, значительным изменением постоянства внутренней среды. Прекращение или снижение клубочковой фильтрации, вовлечение в патологический процесс канальцев и межуточной ткани сопровождаются гиперволемией, гиперазотемией, дизэлектролитемией и нарушением кислотно-щелочного равновесия.
ОПН в общепедиатрической практике диагностируют у 0,48-1,6% детей (Наумова В.И., 1976). У новорожденных ОПН выявляется в
- 21% случаев, при этом на долю ренальной и постренальпой ОПН приходится 15% (Папаян Л.В., Стяжкина И.С., 2002). Нарушение функции почек выявляется у 92,7% наблюдений. У новорожденных, находящихся в критическом состоянии. Из них у 15,4% больных ол и- гурическийтип ОПН и в 76,9% — иеолигуричеекий (Мельникова Н.И. и др., 1998). ОПН угрожает жизни больных детей и до появления диализа всегда заканчивалась смертью. По данным некоторых авторов и ВОЗ, летальность при ОПН у детей до сих пор остается высокой и составляет 30-60% (FlynnJ.T., 1998, Римарчук Г.В., 1999; Валиев А.Р., Шарипов А.М., 2005; Джеймисон Р.Л., 1995). Развитие ОПН у детей вследствие септического процесса приводит к летальному исходу у 74% больных (Ушакова П.Д., Зыков В.А., 1998, Lombardi R. ct al., 1998).
Этиология и патогенез. ОПН у детей развивается по причинам общего характера или обусловлена непосредственно заболеванием почек. В зависимости от локализации первичного повреждения ОПН подразделяют на прсрсттальную, ренальную и нострсналытуто.
Преренальные причины обусловлены острым нарушением почечного кровотока в результате расстройства системы кровообращения, вызванного шоком (травматическим, геморрагическим, инфекционно-токсическим, анафилактическим), острой дегидратацией, сердечной недостаточностью.
К ренальным причинам ОПН относятся состояния с непосредственным повреждением нефроиа: острое нарушение почечной гемодинамики, повреждение тубулоинтерстициальной ткани, внутрисосудистая блокада почечного кровотока, а также токсическое и аллергическое воздействие лекарственных препаратов, солей тяжелых металлов, ядов.
Пострснальными причинами развития ОПН являются различные патологические процессы, приводящие к нарушению оттока мочи (мочекаменная болезнь, опухоли, аномалии развития мочевой системы).
Основным патогенетическим фактором ОПН у детей является острое расстройство гемодинамики, обусловленное гиповолемией, артериальной гипотензией, компенсаторной централизацией кровообращения и снижением почечного кровотока. Расстройство центральной и внутрипочечной гемодинамики приводит к гипоксии почечной ткани, некрозу наиболее чувствительных к недостатку кислорода эпителиальных клеток почечных канальцев с резким снижением их функции (Игнатова М.С., 1973; Наумова В.И., 1976; Напаян А.В., 1991).
Уменьшение или прекращение клубочковой фильтрации и гипоксическое повреждение базальных мембран канальцев ведут к усилению канальцевой рсабсорбции интралюминарной жидкости. Эта жидкость проникает в интерстициальную ткань, вызывая отек почечной паренхимы и повышение внутрипочечного давления. Необходимо отметить, что в патогенезе ОПН немаловажную роль играют биологически активные вещества, которые выделяют клетки в ответ на повреждение (вазоактивные, просклеротические медиаторы, проста гл а н дины)
Развитию и прогрессированию ОПН способствуют внутрипочеч- ное нарушение гемодинамики, внутрисосудистая блокада кровотока в почке на фоне ДВС-синдрома и первичное повреждение тубулоинтерстициальной ткани почки.
Клиническая картина В клиническом течении ОГ1Н выделяют начальную, олигоанурическую, полиурическую и восстановительную стадии
Симптоматика начальной стадии ОПН разнообразна и в большой степени определяется патологическим процессом как пусковым моментом повреждения почек. Однако уже на этой стадии наблюдается снижение диуреза, что позволяет врачу заподозрить нарушение функции почек и провести соответствующие диагностические и лечебные мероприятия. Начальная стадия может развиваться остро вследствие шока, который сопровождается спазмом периферических сосудов, олигурией и в ближайшие сутки нарушением функции почек. При гнойно-септической интоксикации диурез снижается постепенно, в течение нескольких суток.
Клинические проявления олигоануричсской стадии, обусловлены нарушением азотовыделительной функции, кислотно-щелочного равновесия, электролитного состава крови и анемией. Состояние больного прогрессивно ухудшается, нарастает адинамия, отмечаются сухость кожных покровов, жажда, тошнота, рвота. Из-за развития метаболического ацидоза наблюдается расстройство дыхания, гипергидратация приводит к периферическим отекам, асциту, отеку легких, гидроперикарду, отеку мозга. Ухудшение сердечной деятельности проявляется тахиаритмией, склонностью к сосудистому коллапсу, артериальной гипер-, а затем и гипотензией.
Таким образом, разнообразие клинической картины ОПН в оли- гоанурической стадии обусловлено гипергидратацией и уремической интоксикацией, которые вызваны водно-эле.кгролитными нарушениями, расстройствами кислотно-щелочного равновесия, гиперазотемией и накоплением среднемолекулярных олигопептидов.
Полиурическая стадия сопровождается постепенным увеличением количества выделяемой мочи, состояние больного тяжелое, Азотемия вначале нарастает, в последующие сроки определяется тенденция к стабилизации, возможны тяжелые расстройства водно- электролитного баланса (гипокал и- и гипонатриемия). Нередко поли- урическую стадию называют критической. На период восстановления диуреза приходится 37% летальных исходов ОПН (Папаян В.А., Цыбулькина Г.И., 1991).
Стадия клинического выздоровления обычно продолжается от 25 до 70 дней. Через 2 нед нормализуются диурез, электролитный состав крови, азотовыделительная функция почек и кислотно-щелочное равновесие. Состояние больного стабилизируется и становится удовлетворительным. Однако полное восстановление всех почечных функций продолжается в течение 6-28 мес. Восстановление клубочковой фильтрации и регенерация почечных канальцев происходят медленно. Долго сохраняются низкая относительная плотность мочи, ник- турия. После выздоровления полного структурного восстановления почек не происходит, всегда остаются очаги склеротических изменении (Ольхова Е.Б., 1999).
Диагностика ОПН в начальной стадии затруднена, так как в этот период преобладают клинические симптомы основного заболевания, приведшего к ОПН. В этот период большое значение имеют подробный анамнез, результаты объективного обследования и лабораторные данные. Ультразвуковое допплеровское исследование позволяет определить состояние ренальной гемодинамики, выявить увеличение почек, повышение эхогенности кортикального слоя, что является неспецифическим признаком ОПН (Ольхова Е.Б., 1999).
Диагностика олигоанурической стадии ОПН обычно не вызывает затруднений при внимательном наблюдении за ребенком, анализе лабораторных показателей крови и мочи, объективной оценке функционального состояния жизненно важных органов и систем
Лечение при ОПН заключается в применении консервативных методов и заместительной почечной терапии. Лечение начальной стадии всегда консервативное и направлено на ликвидацию или уменьшение воздействия причины ОПН.
Па ранней стадии наиболее важны противошоковые мероприятия, направленные на устранение гиповолемни и гипоксии, ликвидацию централизации кровообращения, цасстроиств водно-электролитного баланса. Под контролем центрального венозного давления необходима коррекция гипо- и гиперволемии. При ЛД выше 60 мм рт. ст. используют диуретики, артериальная гипотензия является показанием к применению реополиглюкина, альбумина и других кровезаменителей, При гипергидратации наряду с диуретиками вводят гипертонические растворы глюкозы (20-40% раствор глюкозы с добавлением 1 ЕД инсулина на 4 г сухой глюкозы). Применение низкомолекулярного осмотического диуретика — маннитола способствует повышению почечного кровотока, расширяет сосуды коркового слоя почек, способствует улучшению клубочковой фильтрации и снижению сопротивления афферентных и эфферентных артериол в результате освобождения простагландинов.
Петлевой диуретик — фуросемид, способствует расширению сосудов кортикального слоя почек, ингибирует реабсорбцию натрия, приводит к повышению диуреза. Необходимо отмстить, что использование фуросемида дает хороший эффект лишь на ранних стадиях ОПН.
При необходимости воздействия на метаболический ацидоз количество вводимого 4% раствора гидрокарбоната натрия рассчитывают по формуле: дефицит основании X масса тела/3 = количество вводимого внутривенно 4% раствора бикарбоната натрия.
Для стимуляции обменных процессов при ОПН незначают АТФ, ко к ар б оке и лаз у, глутаминовую кислоту, витамины группы В. Снижение распада белков и стимуляция секреторной активности канальцевого эпителия достигаются введение?' анаболических стероидов (неробол, ретаболил, тестостерон и др.).
Олигоаиуривеская стадия с гиперазотемией явлениями гипергидратации и диеэлектролитемией является показанием к проведению заместительной терапии. Применение гемодиализа, перитонеального диализа необходимо начинать при установлении анурической стадии ОПН, не дожидаясь высокой азотемии и клинических проявлений интоксикации. Короткие (2 ч) ежедневные сеансы гемодиализа легче переносятся старшими детьми с ОПН и позволяют предотвратить нарастание азотемии и электролитных нарушений.
У больных с уремической и гнойной интоксикацией более эффективна гемофильтрация или гемодиафильтрация.
Лечение полиуричсской стадии заключается в создании водного режима. Детям не ограничивают прием жидкости, поваренной соли, увеличивают калорийную нагрузку. При нормализации азотемии и скорости клубочковой фильтрации больного выписывают под амбулаторное наблюдение.
Хроническая почечная недостаточность — сложный сим птомоком- плекс, вызванный гибелью нефронов который развивается у больных в результате прогрессирования патологического процесса различной этнологии в почках. Угасание функции почек связано с динамикой потери числа функционирующих нефронов и может продолжаться от нескольких дней до многих месяцев и лет. Почечная недостаточность, продолжавшаяся более б мес, считается хронической.
Распространенность. В мире число детей с терминальной почечной недостаточностью составляет от 5 до 14 на 1 млн населения в год (Fine R.N. et al„ 1984; Loirat C. et al., 1994). В Российском регистре детей с ХИН в 2002 г. зарегистрировано 966 человек (Молчанова Е А., Валов А.Л., 2004). Необходимо заметить, что в регистре в силу разных причин сильно занижено число пациентов.
Распространенность ХПН колеблется в зависимости от возраста пациентов. 5,1% детей сХТТП моложе 5 лет; 25,5% — 6- 10 лет; 69,7% — 5.1-16 лет, т.е. более половины больных составляют дети старшего
возраста. В заместительной терапии нуждаются 32% больных в возрасте до 5 лет, 72% — 6-10 лет и 87% ботьных 11-16 лег (Broyer М. et ad-, 1993).
Больных с ХПН значительно больше, чем получающих заместительную терапию. Следовательно, оценка распространенности ХПН по числу больных, получающих заместительную терапию, неадекватна и нуждается в серьезных коррективах.
Классификация ХПН Существует множество классификаций ХПП. Классификация ХПН, предложенная Международной классификацией болезней (МКБ 10), малопригодна в практической работе, поскольку не учитывает уровень азотемии и клинические проявления уремии.
Наиболее приемлема с клинической точки зрения классификация, предложенная Н. А. Лопаткиным в 1972 г., по которой различают латентную, компенсированную, иптермиттирующую и терминальную стадии почечной недостаточности. Традиционные биохимические методы исследования крови и мочи позволяют определить суммарное нарушение функции почек и стадию почечной недостаточности при отсутствии нарушения пассажа мочи и остром воспалительном процессе в почках.
Этиология и патогенез. Многие авторы считают большую часть заболеваний наследственными (Chavers R.M et aL., 1994; Hardy А.М., 1995; Johnson R.W.C., 1996; Matas A.J., 1996).
Этиология ХПН у детей различна в различных возрастных группах. D. Potter и соавт. (1980) выделяет три возрастные группы детей с терминальной почечной недостаточностью. Большинство детей с обструктивной уропатией относятся к младшей возрастной группе, а опухоль Вильмса наблюдается исключительно у детей до 5-летнего возраста. Более трети заболеваний, приводящих к терминальной почечной недостаточности у детей, являются урологическими; у 36% пациентов обнаруживается обструктивная уропатия, дис- и гипоплазии почек и пиелонефрит, и только у 4,6% детей — гломерулонефрит,
Представленные сведения существенно отличаются от причин развития ХПН у взрослых, у которых до 30% занимает гломерулонефрит.
Этиологические факторы, характерные для ХПН у детей, secbivfa четко акцентируют некоторые стороны патогенеза, что позволяет говорить о характерных его особенностях.
Несмотря на многообразие этиологичсских факторов, морфологические изменения в почках при выраженной ХПН однотипны И сводятся к преобладанию фибробластических процессов с замещением функционирующих нефронов соединительной тканью, гипертрофией оставшихся (ремнантных) нефронов и утратой морфологического своеобразия исходного процесса. Повышенная нагрузка на функционирующие иефроны усугубляет их структурные изменения и является, по современным представлениям, основным неиммунным механизмом прогрессирования ХИН. При уремии наблюдается ряд приспособительных феноменов, облегчающих работу почек. Например, хорошо известна ретенция уратов у больных с ХИН, что приводит не только к повышению содержания мочевой кислоты в сыворотке крови, по и к выпадению ее кристаллов в мягких тканях, Параллельно задержке уратов в сыворотке крови больных накапливаются гиппуровая кислота и индоксил сульфат, ингибирующие транспорт уратов в канальцах и способствующие увеличению фракционной экскреции мочевой кислоты. Сказанное справедливо и в отношении ряда других веществ. Так, повышение в крови количества азотистых шлаков увеличивает осмотическую нагрузку на почки, что приводит к повышению экскреции воды, мочевины, креатинина и т д. Не случайно после первых процедур гемодиализа у большинства больных одновременно со снижением концентрации в крови мочевины сокращается и диурез (Тареева И.Е., 2000),
Клиническая каритина. Течение болезни и ход лечения терминальной почечной недостаточности у детей, в отличие от взрослых, имеет целый ряд существенных особенностей, связанных с ростом и массой тела, этиологией, клиническими проявлениями, гормональными изменениями, половой зрелостью и другими факторами (Holliday М.А. et al., 1994; Schaefer 1 et ah, 1996). К ним относятся; задержка психомоторного развития, анемия, артериальная гипертензия, сердечно-сосудистые осложнения, гипергидратация.
Для латентной стадии (клубочковая фильтрация 50-60 мл/мин) характерно типично течение с полиурией, никтурией, гипертензией, умеренно выраженной анемией в результате снижения почечного синтеза эритропоэ ги на.
Компенсированная и интермиттирующая стадии (клубочковая фильтрация 15-49 мл/мин) сопровождаются полиурией с никтури- ей, слабостью, снижением трудоспособности, похуданием. У большинства больных выявляют гипертензию и анемию. На этих стадиях эффективна консервативная терапия
При терминальной стадии (клубочковая фильтрация ниже 15 мл/мин) полиурия часто сменяется олигурией. Больные вялы,
апатичны. У них резко снижен аппетит (вплоть до анорексии), во рту сухость и неприятный вкус, отмечается тошнота. Типичны резкая слабость, зябкость, инверсия сна, кожный зуд, тонические судороги икроножных мышц. Гипертензия часто становится трудно контролируемой, приводит к резкому снижению зрения, острой левожелудочковой недостаточности с отеком легких. Кожа сухая, бледная или желтушная с серым оттенком (вследствие анемии и «прокрашивания» урохромами), геморрагиями и следами расчесов. Нередко развиваются моноартриты вследствие вторичной подагры, больные жалуются на боли в костях и позвоночнике (гиперпаратиреоя), парестезии и резкую слабость в нижних конечностях (нолинейропа- тия), носовые кровотечения.
При далеко зашедшей уремии обнаруживаются запах аммиака изо рта, периодичес кое дыхание (декомпснеированный метаболический ацидоз), перикардит, уремическая прекома,
В тер мин ильной стадии ХПИ спасти жизнь больному может только заместительная почечная терапия.
Задержка психомоторного развития, С увеличением продолжительности диализотсрапии возрастает количество неврологических осложнений (Chan С M.J., 1979). 11о мнению R.S. Fennell et al. (1990), ]
главная причина задержки психомоторного развития заключается не в уремии самой по себе: многие дети с врожденными заболеваниями почек имеют пороки развития других органов и систем, включая ЦНС, которые являются причинами задержки развития ребенка и 1 могут проявляться через длительный промежуток времени уже на : стадии заместительной терапии (Polinsky M.S. et al., 1987).
В качестве одной из существенных причин, способствующих задержке развития, можно назвать недостаточность питания (Evans D, et al., 1980; Arnold W.C., 1983). Кроме того, дети с ХПИ испытывают отрицательное психологическое воздействие родителей и медперсонала, связанное с длительным пребыванием в стационаре, многократными болезненными процедурами, общим истощением, ограничением подвижности и отсутствием нормального социального окружения. Так, установлена.зависимость между числом дней, проведенных в больнице, и показателями роста пациентов (Kleinknecht S. et al., 1983).
Остеодистрофия. В сыворотке крови низкий уровень гормона роста, повреждения появляются прежде всего в метафизарпых зонах. Заболевания зубов отмечены только при ХГП I с младенческого возраста (Bublitz Л. et. al., 1981), что требует специального внимания.
Анемия Патогенез анемии при почечной недостаточности довольно хорошо изучен В норме 90% эритропоэтина синтезируется в проксимальных канальцах почки или в интерстнции (Ермоленко В.М., 1997; Шейман Д.А., 1997; Shaw R., 1967; Ahern M.J., 1989).
Кроме уменьшения синтеза эритропоэтина в пораженных почках, на снижение его уровня в кровь влияет дефицит железа, витаминов группы В и фолиевой кислоты (Юданова Л.С. и др., 1992; Шостка Г.Д., 1995; Geerling W., 1993). Кроме того, азотемивеская интоксикация ингибирует активность эритропоэтина (Radtke H.W., 1981). Достоверно установлено, что у детей с ХГ1Н происходит значительное снижение уровня гемоглобина в крови при уменьшении клиренса эндогенного креатинина ниже 35 мл/мин (Schrcr К., 1987). При одном и том же уровне креатинина у взрослых содержание гемоглобина выше на 20 ЕД, чем у детей.
Анемия является одной из главных причин сердечной недостаточности, в частности гипертрофии левого желудочка. S. Berweck (2000) отмечает уменьшение гипертрофии левого желудочка через некоторое время после уменьшении анемии и повышении уровня гемоглобина до 100-110 мг/л и гематокрита до 40%. Коррекция анемии вызывает повышение аппетита, увеличение двигательной активности и нормализацию гормонального статуса.
Артериальная гипертензия отмечается тогда, когда систолическое давление превышает 150 мм рт.ст. По данным К. Schrer (1981) 79% пациентов из 119 детей с терминальной почечной недостаточностью нуждались в назначении гипотензивной терапии. Частота и тяжесть гипертензии у детей зависят от первичного заболевания, продолжительности болезни и способа лечения.
Чаще всего артериальная гипертензия вызывается нарушениями водно-солевого баланса. В 65% наблюдений при гипертензии удается добиться устойчивого снижения артериального давления (АД) с помощью диеты с ограничением поваренной соли и жидкости, и проведением ультрафильтрации с достижением «сухого веса» (Brennan B.L., 1980).В ряде случаев повышение артериального давления связано с гемодинамическими нарушениями, которые вызваны увеличением общего периферического сопротивления. По данным M.S. Neff (1971), диастолическое давление и общее периферическое сопротивление повышались при увеличении гематокрита до 40% в случаях назначения больным эритропоэтина. Снижение дозы эритропоэтина и назначение вазодилататоров позволяют коптротировать артериальное давление,
Активация системы ренин-ангиотензин-алъдостерон вызывает артериальную гипертензию, наиболее плохо поддающуюся лечению, В большинстве случаев удается снизить артериальное давление с помощью каптоприла. Если диета и медикаментозная терапия ие приносят успеха, выполняют билатеральную нефрэктомию.
По разным данным артериальная гипертензия наблюдается у 80-95% больных с терминальной почечной недостаточностью.
В.В Сафонов (2003) проанализировал результаты обследования 128 пациентов, находившихся на программном гемодиализе. Артериальное давление было повышено у 86,4% взрослых пациентов и у 78,7% детей. Это свидетельствует о том, что артериальная гипертензия в детском возрасте не менее актуальна, как и у взрослых.
Артериальная гипертензия у больных на гемодиализе имела несколько вариантов развития.
При первом варианте в процессе введения больных в диализную программу после удаления избыточной жидкости, достижения «сухого веса», регуляции питьевого режима у 30% детей и 26% взрослых пациентов артериальное давление нормализовалось без дополнительных усилий и медикаментозной терапии.
При втором варианте у 62% детей и 66% взрослых пациентоз, несмотря на устранение гиперволемии, артериальное давление оставалось повышенным и достигало 180-220/140-160 мм рт.ст. несмотря на гипотензивную терапию. Назначение гипотензивных препаратов позволило поддерживать АД на уровне 140-160/100 мм рт.ст. Такое артериальное давление приемлемо для проведения пересадки почки.
При третьем варианте у 8% дегей и 8% взрослых пациентоь артериальное давление достигало 180-240/120-140 мм рт.ст. и не поддавалось консервативной терапии. Такая «злокачественная гипертензия» исключает трансплантацию почки. Единственным способом корригировать «злокачественную гипертензию» у этих больных является билатеральная нсфрэктомия и перевод в рснопривное состояние. Эта дополнительная операция (как минимум одна) лишает больного остаточной функции почек, что усугубляет его и без того тяжелое состояние. Реиопривное состояние подразумевает и выключение эндокринной функции почек.
Таким образом, проблема артериальной гипертензии одинаково остро стоит как у детей, так и у взрослых пациентов с терминальной почечной недостаточностью. В.В. Сафонов и соавт. (2003) не выявили заметной разницы ни в час готе, ни в эффективности того или иного вида коррекции артериального давления у детей и взрослых пациентов.
Анатомо-функциональное состояние сердечно-сосудистой системы. Тяжелые изменения функции сердечно-сосудистой системы являются главной причиной смерти детей с ХИН. Течение и прогноз сердечно-сосудистых осложнений у детей с герминальной почечной недостаточностью существенно отличаются от таковых у взрослых. Атеросклероз, ишемическая болезнь сердца, эндокардит, обычные у взрослых, у детей встречаются чрезвычайно редко. Напротив, гипер- калиемическая остановка сердца и перикардит остаются наиболее распространенными осложнениями у детей (Schrer К. et al., 1987). У 2/3 детей па гемодиализе выявлена кардиомегалия как компенсация недостаточности сократительной функции желудочков, у 1/3 детей — левожелудочковая недостаточность, особенно при гипертензии (Bosch A. ct al., 1990). Сосудистые осложнения, такие, как атеросклероз и инфаркт миокарда, у детей встречаются крайне редко (O’Regan S., 1984).
По данным В.В. Сафонова (2003), у всех обследованных детей выявлена гипертрофия левого желудочка и межжелудочковой перегородки. Ее выраженность прямо зависит от сроков диализотерапии: чем дольше диализотералия, тем больше выражена гипертрофия левого желудочка. У детей, которые находятся на диализе больше 1 года, отмечается дилатация сначала левого желудочка, а затем и других полостей сердца.
Дисфункция клапанов сердца свидетельствует о недостаточности клапанного аппарата. Она выявлена у детей, которые находились на программном гемодиализе больше 15 мес. По-видимому, дисфункция клапанов обусловлена нарушением пропорции сердца в результате расширения его камер, с одной стороны, и потери свойств эластичных и мышечных компонентов клапанов из-за хронической интоксикации и нарушения трофики — с другой.
На сериях ЭЮ' у детей отмечается отрицательная динамика. Глубина изменений прямо зависит от продолжительности диализотерапии. К типичным следует отнести проявление электролитных нарушений. Заостренный зубец Г в отведениях V^-Vg (рис. 28,1). Форма зубца 7'свидетельствует о гиперкалиемии (содержание калия gt; 5,5 ммоль/л), с одной стороны, и о гипоксическом поражении миокарда — с другой.
Удлинение комплекса QRST более 0,38 с, т.е. увеличение его продолжительности, является признаком гипокал ьциемии (рис. 28.2). Эта особенность ЭКГ по мере продолжения гемодиализа проявляется у всех детей.

Рис. 28.1. Заостренный зубец Т — электрокардиографический признак I инеркалиемии и гипоксии миокарда

Рис. 28.2. Удлинение интервала QRST — электрокардиографический признак гипокальциемии
При продолжении диад изотерапии на сериях ЭКГ появляются признаки перегрузки правого предсердия в виде высокоамплитудного зубца Р в отведениях I, И, aVF (рис. 28.3), а также трофические изменения миокарда.
Динамические изменения ЭКГ соответствуют данным других методов исследования и указывают на то, что у детей при проведении программною гемодиализа довольно быстро развивается сердечная недостаточность.
Шйш _
Рис. 28.3. Перегрузка правого предсердия — высокий зубец Р
Рентгенография грудной клетки полностью подтверждает результаты всех предыдущих методов исследования; расширение границ сердца как влево, так и вправо, увеличение КТИ свыше 0,4 и углубление «талии» сердца (рис. 28.4).

При длительной диализотерапии (более 17 мес) в результате развития дистрофических процессов в миокарде на рентгенограмме нередко определяется «каплевидное» сердщ (рис. 28.5). Такой рентгенологический признак (в сочетании с данными других методов исследования) является предвестником декомпенсации сердечной недостаточ ности,

Рис, 28.5. Рентгенограмма грудной клетки. Дистрофия миокарда - «каплевидное» сердце
Тяжелые анагомо-функциональные нарушения выявлены у всех без исключения детей с терминальной почечной недостаточностью, находившихся на программном гемодиализе, У взрослых эти нарушения развиваются в 2 раза реже и выражены гораздо меньше, чем у детей. Кроме того, у взрослых пациентов сердечная недостаточность при проведении гемодиализа развивается в несколько раз медленнее, чем у детей.
Довольно быстрое развитие сердечной недостаточности в детском возрасте обусловлены несколькими факторами, среди которых, помимо азотемической интоксикации, наиболее важными считаются:
- анемия, которая приводит к хронической гипоксии;
- электролитные нарушения (гиперкалиемия, гипокальциемия);
- постоянный артериовенозный сброс, который обедняет периферическое кровообращение и увеличивает нагрузку на правое предсердие;
¦ гиперволемия;
- нарушение водно-электролитного баланса организма во время гемодиализа и ультрафильтрации.
В связи с этим всем детям, находящимся на программном гемодиализе, проводится кардиотропная терапия. Помимо диеты с исключением продуктов, содержащих калий, и регуляции «сухого веса», который достигается жестким ограничением жидкости и ультрафильтрацией, она включает в себя назначение сердечных гликовидов (дигоксин), препаратов, улучшающих трофику миокарда (рибоксин по 100 мг 2 раза в сутки в течение 3-4 иед, цитохром С по 50,0 мг внутривенно капелвно в течение 10 днем), ингибитора ангиотен- зинпревращающего фермента (каптоприл по 25-50-100 мг/сут в зависимости от величины артериального давления) После курса кардиотропной терапии состояние миокарда необходимо контролировать путем систематического проведения ЭКГ и эхокардиографии. При появлении отрицательной динамики курс проводимой терапии необходимо повторить.
Никакая терпия не может компенсировать перечисленных отрицательных факторов иафуикциюмиокарда. Развитие сердечной недостаточности не удается предотвратить и компенсировать ( Данилков А. И 1996).
Поэтому для детей с терминальной почечной недостаточностью единственным способом предотвратить развитие сердечной недостаточности и продлить жизнь является трансплантация почки.
У взрослых пациентов, в отличие от детей, любой вид диализа и трансплантация почки служат альтернативными методами лечения.
Иммунный статус. Традиционно считается, что дети с почечной недостаточностью страдают иммунодефицитом (Наумова В.И., 1991). В литературе много работ, свидетельствующих о предрасположенности детей с ХПН к инфекционным заболеваниям, о снижении их способности к полноценной реакции на бактериальную и вирусную инфекцию, о склонности к генерализации инфекционного процесса и развитию сепсиса (Игнатова М.С., 1986). В пользу этого вывода говорят и работы А.К. Цыбышевой (1983), М.В. Brenner (1987), которые сообщают об уменьшении у детей с ХПН продукции IgM, лимфопении, дефиците Т- и В-лимфоцитов, снижении фагоцитарной активности гранулоцитов, т.е. о снижении главных показателей гуморального и клеточного иммунитета. S М. Friedman (1981),
S. Mezzano (1984) и М.С. Игнатова (1986) объясняют это уремической и песпецифической интоксикацией, нарушением продукции лейко- поэтинов, подавлением ферментной системы лимфоцитов.
Приведенные сведения предполагают менее агрессивный иммунный ответ после трансплантации почки у детей по сравнению со вipoc- лыми пациентами. Между тем положительные результаты трансплантации почки у взрослых пациентов, по сведениям большинства авторов, как правило, несколько лучше, чем у детей (Сутыко А.Д., 1995, 1996; Ettenger R.B., 1989; Tejani А., 1994, 1995; Hardy А.М., 1995). Только усиленная иммуиосупрессивпая терапия позволяет увеличить 3-лст- inofo выживаемость больных с 89% в 1980-1985 г. до 94% в 1986-1991 г.
Увеличение выживаемости наблюдалось во всех возрастных группах (Loirat С et al., 1994). Годичная выживаемость трансплантата составила у детей от живого родственного донора и после трупной трансплантации почки — 84% и 59% соответственно и в младшей возрастной группе — 77% и 65% соответственно (Loirat С. et al, 1994).
На выживаемость больных и трансплантата влияет множество различных факторов. Наибольшее значение имеют иммунная совместимость и исходное состояние иммунитета у реципиента (Василенко И.А., 1998; Цветков Д.В., 1998; Gjertson D.W., 1996; Giral- Classe М. et al., 1998; Tanabe К., 1998).
В.В. Сафонов (2003) провел сравнительный анализ исходного состояния иммунитета у детей и взрослых. Для оценки состояния клеточного иммунитета было определено общее число лейкоцитов в периферической крови реципиентов, ожидающих трансплантации почки. Определили также относительное содержание лимфоцитов и их субпопуляций в крови. Оказалось, что у детей и взрослых, находящихся на программном гемодиализе, поддерживается удовлетворительное напряжение клеточного иммунитета. Число лимфоцитов и их субпопу тяций соответствеует норме. Однако у детей число Т- хелперов (CD4) в 1,4 раза достоверно превышает анало1 ичный показатель у взрослых. В связи с этим соотношение CD4/CD8 тоже выше у детей. Более того, напряжение иммунитета у детей, находящихся на программном гемодиализе, выше, чем у группы взрослых больных.
Все авторы единодушны в том, что для достижения аналогичных результатов дети после трансплантации почки требуют более активной индукционной и базовой иммуносупрессии, чем взрослые пациенты.
Состояние желудочно-кишечного тракта. Для контроля за состоянием желудочно-кишечного тракта применяют эзофагогастродуо- деиоскопию. П.Л. Щербаков (1998) пришел к выводу, что и у детей (83%), и у взрослых (81%), больных с ХПН, встречаются гастриты разной формы (рис. 28.6).
Это может быть диффузная или звездная гиперемия слизистой оболочки, утолщение складок, гиперплазия слизистой оболочки различной выраженности.
Вторыми по частоте заболеваемости являются бульбит и дуоденит у детей (60 и 70% соответственно) и у взрослых (77 и 84%).
Дуоденит выражается в виде утолщенных складок, гиперемии, лимфапгиэктазий в постбульбарных отделах двенадцатиперстной кишки.

Рис. 28.6. Гастроскопия.
а — гастрит «булыжная мостовая»; б — геморрагический гастрит
Эрозии слизистой облочки пищевода и желудка (рис. 28.7) встречаются у 30% детей и 22% взрослых пациентов.

Рис. 28.7. Гастроскопия. Эрозии желудка (а) и двенадцатиперстной кишки (б)
Язвы желудка бывают единичными, различной глубины, округлой формы, с ровными краями, размером 0,4-1,2 см (рис. 28.8).
Отметим, у взрослых пациентов не встречаются язвенные поражения слизистой оболочки желудка.
Косвенные эндоскопические признаки панкреатита в виде инт- рамукозных точечных кровоизлияний различной давности, преимущественно в кардиальном отделе и теле желудка, и папиллит выявляются у 17% детей.
Всем больным необходимо проводить соответствующую терапию, в частности, при незначительных воспалительных изменениях

Рис- 28.8. Гастроскопия. Язвы желудка (а) и луковицы двенадцатиперстной кишки (б)
назначают: спазмолитики (но-шпа, никошпан) и ферменты (мезим форте, панзшюрм, фестал) в обычных дозах.
Эрозивные и язвенные поражения слизистой оболочки требуют болееактивпого лечения. Например, применяютранитидинилиомез— по 1 капсуле 2-3 раза в сутки; метронидазол (трихопол) — по 250 мг 2 раза в сутки; фосфалюгель — по 1 столовой ложке 3-4 раза в сут.
Кровотечение из язвы слизистой облочки останавливают элет- рокоагуляцией или химической коагуляцией. Затем назначают гемостатическую «болтушку» по 1 столовой ложке в 1 ч на фоне вышеуказанной противоязвенной терапии. «Болтушка» содержит аминокапроновую кислоту 100,0; атропин 0,1 %—1,0, гемостатическую губку; яичный белок, плазму крови (любая группа) 100,0 мл.
Таким образом, практически у всех больных с ХПН отмечается поражение органов желудочно-кишечного тракта. Эзофагодуодено- скопию необходимо проводить не реже 1 раза в 3 мес.
Состояние мочеполовой системы. Гладкое течение посттрансплантационного периода во многом определяется состоянием мочеполовой системы реципиента. Так, диспластическая фоновая патология (ап пази я, гипоплазия почек) не вызывает патологических изменений трансплантата. Больным без воспалительного процесса мочевых путей проводят трансплантацию почки без предварительной оперативной и антибактериальной подготовки.
Вместе с тем аутоиммунный или метаболический патологический процесс, приведший к гибели собственных почек, развивается и в почечном трансплантате (возвратный гломерулопефрит, окса- лоз). Некоторые заболевания собственных почек могут привести к гибели трансплантата и даже реципиента (гипертензия и хронический пиелонефрит). Б связи с этим необходимо урологическое обследование при подготовке реципиента к трансплантации почки. Результаты обследования могут существенно влиять на подготови
