Стресс представляет стандартную адаптационную реакцию на необычные ситуации, потенциально угрожающие организму. В основе реакции лежит повышенная выработка АКТГ и индуцированная ею гиперпродукция стероидных гормонов коры надпочечников, а также катехоламинов. К основным мишеням этих гормонов, особенно глюкокортикоидов, относят лимфоциты (см. раздел 3.6.6.2), что и определяет реакцию иммунной системы при стрессе.
Реакция лимфоцитов зависит от концентрации глюкокортикоидов, а следовательно, от интенсивности стресса. Воздействия умеренной интенсивности вызывают преимущественно перераспределение лимфоцитов. Незрелые кортикальные тимоциты эмигрируют из тимуса и поступают в основном в костный мозг. Сюда же мигрирует часть зрелых Т-клеток. При слабом стрессе массовая гибель лимфоцитов отсутствует. Функциональная активность лимфоцитов изменяется незначительно, отчасти в связи их пространственным перераспределением. Уровень иммунного ответа, особенно гуморального, при этом снижается, хотя тоже незначительно. В целом же действие малых и умеренных доз гормонов надпочечников, оказывающих слабое и преходящее влияние на иммунную систему, нельзя рассматривать как причину развития иммунодефицитного состояния.
Иная ситуация создается при интенсивных и длительных или повторяющихся стрессорных воздействиях. При этом концентрация глюкокортикоидов может превысить пороговые уровни для индукции апоптоза лимфоцитов. Соотношение чувствительности различных разновидностей лимфоцитов к действию глюкокортикоидов такова же, как к действию радиации, что обусловлено одинаковой причиной гибели — развитием апоптоза при условии низкой экспрессии внутриклеточных антиапоптотических факторов (Bcl-2 и др.). Долгое время чувствительность к действию глюкор- тикоидов рассматривалась как главный показатель степени зрелости тимо- цитов: кортизончувствительность свойствена незрелым кортикальным, а кортизонрезистентность — зрелым медуллярным тимоцитам. Макрофаги под влиянием глюкокортикоидов не погибают, но их функция ослабляется— в основном вследствие повышения внутриклеточной концентрации цАМФ. В результате интенсивный стресс может вызвать подавление всех форм иммунного ответа, особенно гуморального. Течение уже развившегося иммунного ответа при этом не изменяется.
Обычно последствия стресса, даже сильного, быстро ликвидируются. Однако при длительном и повторном действии стресс может выступать в качестве кофактора формирования иммунодефицита, а также ускоренного старения иммунной системы. Этому способствуют изменения, индуцируемые стрессом в микроокружении лимфоцитов, например, в эпителиальных клетках тимуса.
Возрастные иммунодефициты
Известно 2 типа физиологических иммунодефицитов, ассоциированных с возрастом — иммунодефицит раннего постнатального возраста и иммунодефицит при старении.
Иммунодефицит раннего постнатального периода связан с тем, что формирование иммунной системы к моменту рождения еще не завершено (см. раздел 3.4.1.2).
Особенно четко основы возрастного иммунодефицита удается продемонстрировать при анализе возрастной динамики концентрации сывороточных иммуноглобулинов у детей, отраженной на рис. 4.51. Первый пик концентрации IgG на графике отражает поступление IgG из организма матери в результате Fc-зависимого транспорта через плаценту. Иммуноглобулины других классов не преодолевают плацентарный барьер в связи с отсутствием на клетках трофобласта соответствующих Fc-рецепторов. У животных с различным строением плаценты условия проникновения материнских иммуноглобулинов в циркуляцию плода существенно варьируют. В связи с тем, что время полужизни в циркуляции молекул IgG большинства изотипов составляет около 20 сут, этот белок некоторое время сохраняется в организме новорожденного. В период кормления с молоком матери поступает секреторный IgA, защищающий слизистую оболочку кишечника и частично
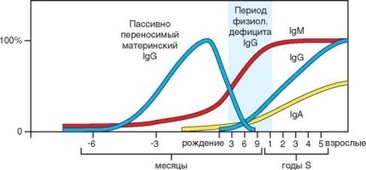
Рис. 4.51. Изменение концентраций иммуноглобулинов основных классов в крови детей в онтогенезе
всасывающийся в неизменном виде. Из собственных иммуноглобулинов в организме новорожденных образуется только IgM, причем в количествах, значительно меньших, чем у взрослых. Уровень синтеза IgM, свойственный взрослым, достигается лишь к концу первого года жизни. Синтез собственных IgG начинается примерно в то же время, когда исчезают материнские IgG — в возрасте около 6 мес. Полного развития он достигает к 5—6 годам жизни. Еще медленнее формируется способность к образованию IgA и IgE, которая достигает уровня, характерного для взрослых, к 10 годам.
В результате сочетания описанных выше процессов оказывается, что у детей первых лет жизни проявляется естественный гуморальный иммунодефицит, затрагивающий синтез антител всех классов. В возрасте 6 мес выраженность этого дефицита достигает максимума в связи с исчерпанием запасов материнских иммуноглобулинов без должной компенсации собственными иммуноглоубинами. После года гуморальный дефицит снижается, а к 10 годам полностью ликвидируется. Наличие этого возрастного иммунодефицита проявляется в повышенной восприимчивости детей к инфекционным заболеваниям.
Данные относительно проявлений возрастного дефицита факторов клеточного иммунитета более ограничены. Наиболее определенные сведения на это счет получены для тимуса. К моменту рождения из тимуса эмигрируют почти исключительно у5Т-клетки с ограниченной способностью распознавать антиген. Непосредственно после рождения у мышей тимус вновь покидают у5Т-клетки, и лишь позже на протяжении нескольких дней периферические органы иммунной системы заселяется арТ-клетками. В течение всего периода колонизации лимфоидных органов Т-лимфоцита- ми функция тимусзависимого звена иммунной системы остается сниженной. Это проявляется не только в слабости ответа Т-клеток на митогены и антигены, но еще в большей степени — в недостаточности контроля за гуморальным иммунитетом и функцией макрофагов, который осуществляют CD4+ Т-клетки, позже других лифмоцитов завершающие свое развитие.
О том же свидетельствует низкий уровень выработки Т-клеточных цитокинов, влючая IL-2, IFNy и ^2-цитокины.
Из анатомических отделов иммунной системы позже всего завершается формирование иммунной системы слизистых оболочек. Так, уже после рождения происходит морфогенез лимфоидной ткани, ассоциированной с носоглоткой и бронхами, при существенном влиянии микрофлоры. Развитие пейеровых бляшек также завершается после рождения. Все это не может не сказываться на эффективности иммунной защиты слизистых оболочек, основную роль в которой в раннем постнатальном периоде играют только факторы первой линии защиты.
Способность отвечать на различные группы антигенов приобретается в постнатальном онтогенезе в определенной последовательности. Так, у крыс иммунный ответ на антигены бордетелл проявляется уже в первые дни после рождения, тогда как ответ на пневмококковый полисахарид (тимуснезависимый антиген) — только в последнюю декаду первого месяца жизни. Это может служить причиной неодинаковой чувствительности детей раннего возраста к различным инфекционным агентам.
Таким образом, у детей раннего возраста проявляются признаки иммунодефицита, обусловленного естественной задержкой формирования в онтогенезе некоторых звеньев иммунитета и его незавершенностью к моменту рождения.
Старение иммунной системы и связанный с ней иммунодефицит
Точные критерии оценки возникновения старческого иммунодефицита отсутствуют. О его возникновении можно судить в большей степени по клиническим проявлениям, чем по лабораторным показателям. Хотя возрастные изменения структуры и функции иммунной системы сомнения не вызывают, говорить о наличии старческого иммунодефицита можно лишь в единичных случаях. При этом у очень старых людей (более 90 лет) состояние иммунитета в целом более удовлетворительное, чем в более молодой возрастной группе (следствие отрицательного отбора лиц с дефектами иммунитета).
Наиболее ранние проявления старения иммунной системы связаны с возрастной инволюцией тимуса. Она проходит несколько этапов и имеет ряд последствий не только для тимусзависимой защиты, но и для всей иммунной системы. Раньше всего проявляются изменения, затрагивающие непосредственно тимус. Ослабляется способность стромы тимуса привлекать клетки-предшественники. Это обусловлено снижением секреции хемокинов, привлекающих лимфоидных предшественников. Уже на 1-й неделе после рождения резко снижается способность стромы тимуса заселяться сингенными тимоцитами. Снижение секреторной способности стромы (особенно эпителия) тимуса проявляется также в значительном ослаблении выработки пептидного гормона тимулина и снижении его концентрации в сыворотке крови. После 60 лет его удается выявить только высокочувствительными методами. Значительно ослабляется способность стромы тимуса поддерживать пролиферацию и дифференцировку Т-клеток. В опытах с трансплантацией стромы тимуса мышам с варьированием возраста донора и реципиента установлено, что снижение эффективности образования зрелых Т-клеток определяется возрастом тимуса, а не клеток-предшественников. Темп потери стромой тимуса способности поддерживать развитие Т-клеток составляет сначала 3%, а в старости — 1% в год. У 2-летних мышей число Т-клеток, образующихся в тимусе, составляет 0,7% от их количества, продуцируемого тимусом новорожденных. На основе экстраполяции данных о темпе инволюции тимуса сделан вывод, что полная утрата способности тимуса поддерживать развитие Т-лимфоцитов должна произойти в возрасте 120 лет.
Потеря активности тимуса сопровождается перифериализацией его функций, т.е. передачей некоторых его функций популяции периферических Т-клеток. Одно из проявлений этого феномена состоит в способности к самоподдержанию численности клеток и субпопуляционного состава с помощью механизмов гомеостатического контроля (см. раздел 3.4.2.6). При действии повреждающих факторов восстановление исходной численности Т-клеток с помощью гомеостатической пролиферации происходит быстрее, чем за счет довольно медленно реализуемого процесса диффе- ренцировки из костномозговых клеток-предшественников. Другой аспект перифериализации функций тимуса состоит во вкладе периферического отдела иммунной системы в совершенствование антигенраспознающего репертуара: помимо репертуара, формируемого в тимусе и не учитывающего реальные потребности организма, на периферии иммунной системы формируются клетки памяти, которые распознают антигены, реально присутствующие в окружении организма и уже проникавшие в его внутреннюю среду. С возрастом компартмент Т-клеток памяти постепенно расширяется и параллельно сужается компартмент наивных Т-клеток.
Параллельно усилению независимости Т-клеток от тимуса их функциональная активность, а затем и численность, с возрастом снижаются. Это обусловлено снижением продукции стромой тимуса гуморальных факторов (гормонов тимуса), поддерживающих должный уровень функциональной активности Т-лимфоцитов. Снижение функциональной активности долгое время не проявляется на уровне организма и может быть выявлено только с помощью функциональных тестов in vitro. Затем выявляют ослабление реакции Т-клеток в тестах in vivo на динитрохлорбензол и распространенные антигены, а у экспериментальных животных — в реакции «трансплантат против хозяина». Снижение численности Т-клеток может происходить в возрасте больше 70 лет и сильнее затрагивает CD4+, чем CD8+ Т-клетки, а среди Т-хелперов — TW-клетки — сильнее, чем ^2-клетки. Ни численность, ни функциональная активность В-лимфоцитов и NK-клеток при этом не изменяются. В ослаблении Т-клеточного надзора видят одну из причин возрастного учащения развития опухолей.
С возрастом происходит ослабление тимусзависимого иммунного ответа с одновременным снижением аффинитета образующихся антител (следствие ослабления тимусзависимого процесса созревания аффинитета). В то же время концентрация сывороточных IgG и IgA возрастает, как полагают, за счет усиления с возрастом поликлональных процессов. Один из результатов поликлональной активации — накопление аутоантител к ДНК, коллагену, IgG, органоспецифическим антигенам (например, антигенам щитовидной железы), которые, однако, не связаны с клиническими проявлениями аутоиммунных процессов. У аутоиммунных мышей линии NZB есть возрастной порог проявления аутоиммунных процессов, которые прогрессируют по мере старения. Усиление аутоиммунизации традиционно связывают с ослаблением контроля ответа на «свое» со стороны регуляторных Т-клеток.
Таким образом, возрастные изменения иммунной системы в большинстве случаев проявляются нарушениями, затрагивающими популяцию Т-лимфоцитов, и инициируются процессами, связанными с возрастной инволюцией тимуса. Хотя удается выявить ослабление с возрастом функций и даже численности Т-лимфоцитов, клинические проявления возрастного иммунодефицита редки. Основное отличие роли старения в функционировании иммунной системы от влияния на нее стресса — необратимость и однонаправленность возрастных изменений. В то же время хронические стрессы могут ускорить развитие возрастных изменений иммунной системы.
Действие факторов внешней среды и иммунитет. Экологическая иммунология
Условия жизни человека в современном мире могут существенно отличаться от тех условий, в которых проходило его формирование как биологического вида. Это несоответствие влечет за собой неадкватные реакции на воздействия, которые не были предусмотрены эволюцией. В такие реакции вовлекаются интегративные системы организма, к которым относят и иммунную систему.
Среди факторов, обусловливающих экологическое неблагополучие, можно выделить естественные (наблагоприятные климатические условия, дефицит природных факторов, например, микроэлементов, или наоборот, их повышенное содержание, повышенный естественный фон радиации) и искусственные, антропогенные. Наиболее распространенный вариант последних — загрязнение среды обитания химическими веществами, в том числе радионуклидами, формирование разного рода физических полей в результате использования в быту и технике источников ионизирующих и неионизирующих излучений. К вариантам экологического неблагополучия с особенно сильным и сконцентрированным влиянием неблагоприятных факторов относят действие профессиональных вредностей.
Неблагоприятные факторы среды влияют на человека в низких дозах, которые сами по себе чаще всего не вызывают патологий, но выступают в качестве кофакторов (т.е. способствующих факторов) заболеваний или проявляют свое неблагоприятное действие при накоплении эффектов. Они способны снижать качество жизни человека.
Поскольку изучение эффектов неблагоприятных экологических факторов чрезвычайно затруднено в связи с их слабостью и «растворением» в массе других воздействий, проведение исследований в области экологической медицины, в частности иммунологии, требует особой научной идеологии и методологии, которые в настоящее время сформированы не полностью.
В конце 80-х годов ХХ века по инициативе Р.В. Петрова была создана «Программа иммуноэкологического обследования населения России», которая реализовалась в широком масштабе по единому плану. В основе этой деятельности лежала экспедиционная работа, в процессе которой проводили массовые иммунологические обследования больших контингентов в местах экологического неблагополучия — природного (регионы Крайнего Севера и др.) и антропогенного (индустриальные регионы, территории, загрязненные в результате радиационных аварий и т.д.).
Перед началом реализаии проекта была проведена масштабная работа по созданию региональных иммунологических нормативов. На основании оценки ключевых иммунологических показателей были построены иммунограммы, или (в графическом варианте) «иммунологические образы». Они отражали региональные особенности иммунного статуса здоровых людей, которые были сгруппированы в 8 основных типов: нормограмма, варианты с подавлением Т-, В-клеточного звена или обоих звеньев, с повышением или понижением уровня иммуноглобулинов, показателей врожденного иммунитета, равномерного повышения всех показателей. Закономерности распределения названных вариантов иммунограмм по географическим зонам пока неясны.
На этой основе было развернуто более детальное иммунологическое обследование населения экологически неблагополучных регионов. Комплекс методов клинико-иммунологического и лабораторно-иммунологического обследования позволяет сформировать группу риска развития иммунодефицитов, группу повышенного риска и, наконец, поставить клинический диагноз иммунопатологии с выделением четырех ведущих синдромов:
- инфекционного (критерий — наличие хронических рецидивирующих или повторяющихся острых инфекционных заболеваний);
- аллергического;
- аутоиммунного;
- иммунопролиферативного.
Наиболее достоверную информацию об иммунном статусе обследуемых удается получить в результате проведения иммунологического мониторинга — динамического слежения за состоянием иммунной системы выбранных групп населения обследованных контингентов с заданными интервалами (обычно от 1 до 5 лет). Опыт обследования населения десятков городов и регионов показал, что величина групп риска по иммунопатологии обычно колеблется от 2 до 8%, а групп повышенного риска — от 0 до 1,5%. При этом на долю иммунодефицита с инфекционным синдромом приходится 70—85%, аллергическим — 7—20%, аутоиммунным — 0—15% и иммунопролиферативным — 0—5%. Подобные обследования, помимо их непосредственно практического значения, служат основным способом выявления широкомасштабных закономерностей иммунотропного действия природных и антропогенных факторов, в частности, неблагоприятных для здоровья человека.
