ГИПЕРПЛАСТИЧЕСКИЕ ПРОЦЕССЫ ЭНДОМЕТРИЯ
Гиперпластические процессы эндометрия как возможная основа для формирования злокачественных опухолей в течение многих десятилетий представляют важную медикосоциальную проблему. Частота озлокачествления гиперпластических процессов эндометрия колеблется в достаточно широких пределах (0,25 — 50%) и определяется морфологическими особенностями заболевания, длительностью его рецидивирования, а также возрастом пациенток.
В соответствии с классификацией ВОЗ (1984) к гиперпластическим процессам эндометрия относятся гиперплазия, полипы и атипические изменения слизистой тела матки. Атипические процессы подразделяются на три степени в зависимости от выраженности патологической трансформации эндометрия: при I и II степенях наблюдаются структурные аномалии слизистой, при III степени — помимо структурных аномалий обнаруживаются изменения в строении клеточных элементов. В отечественной литературе атипические изменения в слизистой тела матки классифицируются на легкие, средние и тяжелые аденоматозные процессы, а также собственно атипические изменения в эндометрии. Выделение терминов «аденоматозные» и «атипические» процессы объясняется различием степеней риска злокачественной трансформации в очагах усиленной пролиферации и структурной перестройки эпителия.
Ведущее значение в патогенезе гиперпластических процессов в эндометрии отводится воздействию повышенных концентраций эстрогенов. Так, формирование гиперпластических процессов эндометрия в позднем репродуктивном и переходном возрасте происходит в условиях стойкой ги- перэстрогении на фоне пониженной продукции прогестерона. Известны несколько причин гиперэстрогении: дисфункция яичников (персистенция фолликула, атрезия фолликулов); фолликулярные кисты; стромальная гипер-
плазия; опухоли тека-клеток; гиперплазия коры надпочечников; нарушение гонадотропной функции гипофиза; некорректное применение эстрогенов; изменение в метаболизме гормонов (ожирение, цирроз печени, гипотиреоз); гиперплазия коркового слоя надпочечников. Таким образом, формирование гиперпластических процессов в эндометрии может быть обусловлено нарушением овуляции любой этиологии, приводящей к развитию абсолютной или относительной гиперэстрогении на фоне отсутствия или недостаточного антиэстрогенного влияния прогестерона. С учетом изложенного, можно выделить следующие механизмы гиперэстрогении: ановуляция в репродуктивном периоде и пременопаузе, гиперплазия тека-ткани яичников, ожирение и обусловленное нм повышенное превращение андростендиона в эстрон в жировой ткани.
Существует точка зрения о развитии гиперпластических процессов в эндометрии на фоне выраженной гипоэстро- гении. Известно, что для полноценной пролиферации и клеточного метаболизма необходимо воздействие определенных концентраций как эстрадиола, так и прогестерона. При этом условиями для развития секреторных преобразований в неизмененном пролиферирующем эндометрии являются: а) циклическое возрастание уровня прогестерона и б) сохранение уровня эстрадиола в маточном кровотоке не ниже 100 нг/мл. Нарушение баланса в «системе» эстрогены-прогестерон приводит к торможению процессов структурной подготовки клеток эндометрия к воздействию гес- тагенов. В подобной ситуации даже низкие концентрации эстрадиола способны поддерживать постоянную пролиферацию эпителия и обеспечить формирование гиперплазии эндометрия.
Кроме этого не исключается возможность развития гиперпластических процессов эндометрия в рамках сохраненных гормональных соотношений, особенно у пациенток репродуктивного возраста. В серии исследований обнаружено закономерное существование очаговой гиперплазии и железисто-фиброзных полипов на полноценном функционирующем эндометрии у женщин репродуктивного возраста с неизмененным гормональным статусом.
Среди дисгормональных состояний, обусловливающих развитие гиперпластических процессов, выделяют также нарушения физиологической секреции тиреоидных гормонов, являющихся модулятором действия эстрогенов на клеточном уровне. Дисбаланс этих гормонов может способствовать прогрессированию нарушений гисто- и органогенеза гормональнозависимых структур и формированию гиперпластических процессов эндометрия.
Безусловно, эндометрий, как гормональнозависимый орган-мишень, тонко реагирует на любые изменения гормонального статуса на уровне целого организма. В последние годы с помощью гистохимических, иммунохимических и электронно-микроскопических методов исследования были уточнены и расширены представления о тканевом гомеостазе эндометрия как органа-мишени. Установлено, что в регуляции процессов клеточной пролиферации принимают участие не только эстрогены, но и биологические амины (норадреналин, меланотонин, серотонин, брадики- нин, гистамин, инсулин, простагландины, паратгормон, глюкагон, гастрин), хориогонин и прочие пептиды, вырабатываемые клетками так называемой диффузной эндокринной системы — АПУД-системы (Amino Prekursor Uptake and Dekarboxylation). В норме апудоциты встречаются во многих органах, что обусловлено необходимостью контроля над процессами пролиферации клеток. В злокачественных нейроэндокринных опухолях различной локализации, в том числе в эндометрии, обнаружено многократное увеличение их концентрации, что создает условия для гиперсекреции биологически активных веществ в общий кровоток и воздействия последних на организм больной в целом. В неизмененной и атрофичной слизистой тела матки апудоциты или отсутствуют или содержатся в низких концентрациях, в то время как при диффузной гиперплазии и аденокарциноме их уровень возрастает в 5 и 20 раз соответственно. При этом у больных с повышенным содержанием эндокринных клеток в эндометрии выявляются сопутствующие экстрагенитальные заболевания — ожирение, артериальная гипертензия, гипергликемия и др.
В литературе имеются сообщения о «воспалительном» генезе гиперпластических процессов в эндометрии (Табак-
ман Ю. Ю. и соавт., 1987). В соответствии с этой теорией, каждый атрофичный орган легко подвержен влиянию неспецифических раздражителей, так как является тканью со сниженной или отсутствующей функцией. При этом неспецифический раздражитель может вызвать формирование как очаговой пролиферации, так и диффузной гиперплазии эпителия и стромы. Таким раздражителем является любой фактор, способный возбудить воспалительную реакцию, тем более что для инфекционного фактора тонкий атрофичный эндометрий является хорошей питательной средой. При длительно текущем воспалении развивается фиброз стромы и гиалинизация волокон, из-за блокады выводных протоков в железах эпителия образуется кистозное расширение. Более того, длительные морфологические и функциональные изменения в слизистой оболочке тела матки при хроническом эндометрите обусловливают возможность патологической афферентации в структуры центральной нервной системы, регулирующие деятельность гипоталамо-ги- пофизарно-яичниковой системы. Нарушения в этой системе приводят к развитию вторичной гипофункции яичников, формированию ановуляции по типу абсолютной или относительной гиперэстрогении и, следовательно, гиперпластических процессов в эндометрии.
Таким образом, современные представления о патогенезе гиперпластических процессов в эндометрии не ограничиваются «традиционными» концепциями «гиперэстроге- нии». По-видимому, патологическую трансформацию слизистой тела матки необходимо рассматривать как сложный биологический процесс, затрагивающий все звенья нейрогуморальной регуляции организма женщины.
Как правило, гиперпластическим изменениям подвергаются функциональный слой слизистой тела матки, значительно реже — базальный. При железистой гиперплазии эндометрий резко утолщен, железы имеют удлиненную форму, извилистые, пило- или штопорообразные. Отличия между железистой и железисто-кистозной гиперплазией не принципиальны и в основном сводятся к наличию или отсутствию кистозно расширенных желез (при железистокистозной гиперплазии наблюдается картина «швейцарского сыра»). Дифференцирование функционального слоя на
компактный и спонгиозный отсутствует. В большинстве случаев имеет место нечеткое отграничение функционального слоя от базального. Железистый эпителий цилиндрический, находится в состоянии оживленной пролиферации, наблюдается большое количество митозов. В кистозно расширенных железах эпителий кубический или резко уплощенный. Строма эндометрия густая, местами отечная, состоящая из округлых клеток с признаками оживленной пролиферации и повышенной активностью митозов. Между клетками беспорядочно расположена густая сеть арген- тофильных волокон, более плотных и грубых, чем в нормальном эндометрии.
На фоне гиперэстрогении формируется застойное полнокровие ткани эндометрия с резким расширением капилляров, нарушается кровообращение (престаз, стаз) с образованием гиалиновых тромбов. Расстройство местного кровообращения и изменение проницаемости сосудистых стенок обусловливают гипоксию и нарушение обмена веществ в ткани эндометрия. Морфологическим субстратом кровотечения, возникающего в ответ на падение уровня эстрогенов, являются участки слизистой тела матки с нарушенным кровообращением: резко расширенные тонкостенные кровеносные сосуды типа синусоид, расположенные в поверхностном слое эндометрия; участки с выраженными дистрофическими изменениями и тромбированными сосудами при наличии или отсутствии очагов некроза.
Реже, в сравнении с гиперплазией функционального слоя эндометрия, развивается гиперплазия базального слоя слизистой. Патологическое утолщение базального слоя распространяется на всю слизистую или имеет очаговый характер. Именно последняя форма базалыюй гиперплазии является исходным местом образования полипов эндометрия. По мере утолщения базального слоя происходит истончение функционального, циклические процессы в последнем протекают недостаточно интенсивно. Железы базального слоя узкие, прямые. Железистый эпителий в глубоких слоях базального слоя всегда нефункционирующий. Строма густая, нередко фиброзная. Резко выделяются сосуды с утолщенными склерозированными стенками, расположенные в виде клубков.
Полипы эндометрия возникают из патологически измененного базального слоя слизистой тела матки. Утолщенные очаги этого слоя вытягиваются, удлиняются и принимают форму полипов, вначале расположенных на широком основании, а впоследствии, благодаря сократительной деятельности матки, — на тонком («ножке»). Формирование полипов обусловлено, по-видимому, патологическим состоянием сосудов базального слоя и местным изменением рецепторного аппарата слизистой матки, проявляющимся увеличением концентрации рецепторов к эстрогенам. Наиболее частой локализацией полипов эндометрия является слизистая дна и углов матки. Полипы могут быть единичными или множественными. Принимая во внимание, что патогномоничным анатомическим признаком полипов является тонкое основание («ножка»), наличие которого отличает полипы от полиповидной формы железистой гиперплазии эндометрия, считается необоснованным употребление термина «полипоз эндометрия».
Морфологически полипы эндометрия характеризуются наличием стромального и железистого компонентов, а также расширенных кровеносных сосудов с утолщенными склерозированными стенками, расположенными в их основании или ножке. В клинической практике выделяют следующие их виды:
Полипы, покрытые функциональным слоем, встречаются только у больных репродуктивного периода с сохраненным двухфазным менструальным циклом и располагаются на фоне секреторного эндометрия. В железисто-фиброзных полипах преобладает стромальный компонент над железистым, причем для последнего не характерны фазные преобразования. Железистые полипы отличаются преобладанием железистого компонента над стромальным, железы полипов данного вида циклически неактивны. В фиброзных полипах железы отсутствуют или имеются единичные,
эпителий их нефункционирующий. Интенсивная пролиферация желез и их эпителия характерна для полипов с очаговым аденоматозом. Эпителий железистого компонента вне очагового аденоматоза нефункционирующий или с признаками слабо выраженной пролиферации. Особенностью аденоматозных полипов является обилие желез, их эпителий находится в состоянии интенсивной пролиферации с относительно высокой митотической активностью. В аденоматозных полипах повышено содержание РНК в цитоплазме, а также увеличена площадь ядер и концентрация ДНК в них. В клинико-патогенетическом аспекте полипы эндометрия целесообразно выделять в самостоятельное заболевание (при развитии их на фоне секреторной или атрофической слизистой тела матки) или трактовать как сопутствующий патологический процесс (в сочетании с дисфункцией яичников, миомой и/или внутренним эндометриозом тела матки).
С морфологических позиций к предраку эндометрия относят: атипическую гиперплазию, очаговый аденоматоз и аде
номатозные полипы. Б. И. Железнов предраковые состояния эндометрия рассматривает шире, а также выделяет различные формы атипической гиперплазии эндометрия:
а) нерезкая форма предраковых изменений;
б) выраженная форма предраковых изменений.
а) нерезкая форма предраковых изменений;
б) выраженная форма предраковых изменений.
Гистологическая картина атипической гиперплазии характеризуется структурной перестройкой и более интенсивной пролиферацией желез. При нерезкой форме предраковых изменений происходит обильное разрастание извитых желез, имеющих причудливую форму (на косых срезах напоминают картину «железа в железе»). Железистый эпителий с признаками повышенной митотической активности.
Выраженная форма предрака эндометрия отличается интенсивной пролиферацией желез с отчетливой атипией эпителия. Железистый эпителий многорядный, с признаками полиморфизма. Цитоплазма эпителиальных клеток увеличена в размерах, эозинофильна; ядра клеток также увеличены, бледные. Отчетливо идентифицируются глыб- ки хроматина и крупные ядрышки. Подобная картина вызывает определенные затруднения в дифференциальной диагностике с аденокарциномой эндометрия, в связи с чем некоторые авторы предлагают использовать термины «нулевая стадия рака эндометрия», «преинвазивная карцинома». При выраженной форме атипической гиперплазии увеличивается митотическая активность и возрастает количество и спектр патологических митозов.
Морфологический предрак трансформируется в аденокарциному приблизительно в 10% случаев; нередко длительно и неоднократно выявляется у одной и той же больной (несмотря на проводимую консервативную терапию), крайне редко подвергается обратному развитию.
Клинический опыт убеждает, что вероятность перехода в рак не только атипической гиперплазии (аденоматоза), но и других гиперпластических процессов эндометрия, не относящихся к морфологическому предраку, достаточно высока (при соответствующих условиях). Таковыми условиями являются нарушения эндокринной системы (нейрообменноэндокринный синдром), возраст (пре- и постменопауза) и характер течения гиперпластического процесса (рецидиви- рование).
В связи с этим предраковые изменения эндометрия целесообразно оценивать в соответствии с возрастом больной, клиническим течением патологического процесса, нарушениями гормонального и обменного характера. В частности, к предраковым состояниям в постменопаузальном периоде относят атрофию эндометрия, сопровождающуюся кровотечением. Классификация предрака эндометрия, предложенная Г. М. Савельевой и В. Н. Серовым, учитывает не только морфоструктурные нарушения, но и клинические проявления заболевания:
I. Аденоматоз и аденоматозные полипы в любом возрасте женщины.
В клинике больных гиперпластическими процессами эндометрия преобладают нарушения менструальной функции — ациклические маточные кровотечения, контактные кровотечения, реже — меноррагии по типу полименореи. Учитывая, что патогенетическую основу гиперпластических процессов слизистой тела матки составляет ановуляция, ведущим симптомом больных репродуктивного возраста является бесплодие, как правило, первичное, реже — вторичное.
Не вызывает сомнений, что решающим методом диагностики патологических состояний эндометрия является гистологическое изучение полного его соскоба, позволяющее определить характер морфоструктурных изменений. Однако применение современных высокоинформативных методов исследования в ряде наблюдений позволяет пересмотреть клинический диагноз и скорректировать тактику лечения больных. В широкой клинической практике для этих целей используют трансвагинальное ультразвуковое сканирование и гистероскопию.
Трансвагинальное ультразвуковое сканирование. При подозрении на гиперпластический процесс и рак слизистой тела матки особое внимание уделяется изучению так называемого срединного маточного эха (М-эха) — отражения от эндометрия и стенок полости матки. При этом оценивают его форму, контуры и внутреннее строение. Ведущее значение придают определению величины переднезаднего размера (ПЗР) М-эха, учитывая наибольшую прогностическую ценность данного критерия при патологической трансформации эндометрия. В репродуктивном периоде максимальные значения ПЗР неизмененного М-эха наблюдаются в период расцвета желтого тела (секреторная фаза менструального цикла) и варьируют в пределах 10—16 мм. Поэтому увеличение переднезаднего размера М-эха свыше ука-
занных значений необходимо рассматривать как возможное проявление патологического процесса.
Несомненно, трансвагинальное ультразвуковое сканирование представляет высокоинформативный метод диагностики патологической трансформации слизистой тела матки. Тем не менее, эхография не может и не должна применяться для установления морфологической структуры неопластического процесса:
Акустической особенностью полипов эндометрия является появление внутри расширенной полости матки округлой или овальной формы образования с ровными контурами и высокой эхоплотностыо. Ультразвуковая картина срединной структуры матки при полипах эндометрия отличается выраженным полиморфизмом и зависит от размеров, локализации и формы полипа. Вместе с тем, лишь идентификация четких границ между патологическим образованием и стенками полости матки является убедительным признаком данной формы гиперпластических процессов эндометрия. При наличии маточного кровотечения граница между контурами эндометрия и полипом усиливается и определяется на сканограммах в виде эхонегативного ободка акустической тени, отражающей скопление крови (рис. 6). Один из дифференциально-диагностических критериев полипов эндометрия — отсутствие деформации М-эха, так как полипы, в отличие от подслизистых узлов миомы, не изменяют форму полости матки. Однако в редких случаях (при фиброзных полипах сравнительно больших размеров) мы наблюдали деформацию срединной структуры матки полипами эндометрия сравнительно больших размеров (средний диаметр их достигал 20—25 мм, при гистологическом изучении обнаружены фиброзные полипы).
Ультразвуковая диагностика гиперплазии эндометрия основывается на выявлении в зоне расположения срединного маточного эха овальной формы образования, увеличенного в переднезаднем направлении с однородной структурой и повышенной эхоплотностью — тип 1. Для второго типа эхограмм характерно появление ровных утолщенных (до 4—7 мм) контуров эндометрия с низким уровнем звукопроводимости, ограничивающих гомогенную зону с меньшим волновым импедансом (рис. 7).
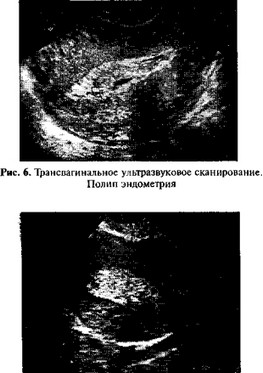
Рис. 7. Трансвагинальное ультразвуковое сканирование. Гиперплазия эндометрия
До настоящего времени дискутируется вопрос о возможности и целесообразности ультразвуковой диагностики рака эндометрия. Результаты исследований, проведенных в нашей клинике, а также данные литературы убеждают, что эхографическая диагностика рака эндометрия представляет определенные трудности, обусловленные, главным образом, двумя причинами:
Таким образом, вопрос о диагностической ценности ультразвукового сканирования при раке эндометрия остается открытым. Вместе с тем, не вызывает сомнений, что ценность любого дополнительного метода исследования определяет возможность диагностировать патологический процесс до появления его клинической симптоматики. Как известно, основным клиническим признаком рака эндометрия является маточное кровотечение в постменопаузе. Данный симптом наблюдается почти у 50% больных раком матки. Кроме этого в генезе злокачественной трансформации эндометрия немаловажная роль отводится нарушениям менструальной функции по типу ановуляции в различных возрастных периодах. Наличие изложенных выше клинических признаков в большинстве случаев является показанием для биопсии эндометрия с целью изучения его морфоструктуры. Следовательно, в подобных наблюдениях применение ультразвукового сканирования для диагностики гиперпластических процессов и рака эндометрия не имеет практического значения. В то же время эхография представляет оптимальный метод выявления патологических состояний эндометрия при массовых обследованиях населения и в ряде случаев способствует обнаружению доклинических форм злокачественной трансформации эндометрия, главным образом, при 0 и 1а стадиях заболевания (классификация Министерства здравоохранения СССР, 1985 г.).
Гистероскопия. Гистероскопическая картина гиперплазии эндометрия характеризуется широкой вариабельностью и зависит от формы патологического процесса (простая или полиповидная), распространенности (очаговая или диффузная), длительности маточного кровотечения. При простои гиперплазии эндометрий неравномерно утолщен, имеет складчатое строение; основание складок широкое, вершина — тонкая, с неровными краями, оттенок складок варьирует от бледно-розового до ярко-красного цвета. Изменение давления в полости матки при ее растяжении жидкими средами позволяет визуализировать волнообразные движения слизистой оболочки — признак «подводных растений». Высота слизистой определяется продолжительностью маточного кровотечения. При отсутствии последнего может достигать 20 мм; в основном — варьирует в пределах 10— 15 мм. Сосудистый рисунок резко выражен, однако какие- либо его особенности, патогномоничные для гиперплазии, обнаружить не удается. Выводные протоки трубчатых желез четко визуализируются, расположены равномерно. Устья маточных труб, как правило, свободны; реже — не выявляются из-за резкого отека слизистой.
Отличительной особенностью кистозной формы железистой гиперплазии является наличие множественных кистозных полостей, расположенных в проекции поверхностных сосудов слизистой, имеющих различную толщину (так называемый феномен «ловушки», поскольку эти полости идентифицируются как бы в «сетях» сосудистого сплетения). Диаметр кистозных структур не превышает 2—3 мм, иногда они принимают бурый оттенок вследствие очагового кровоизлияния в кисту.
Полиповидная форма гиперплазии эндометрия характеризуется появлением множества полиповидньгх разрастаний (шарообразной формы структуры на широком основании) бледно-розового или сине-багрового цвета, свисающих в просвет полости матки. Величина полиповидньгх разрастаний колеблется от нескольких миллиметров до 1,0—1,5 см. При данной форме гиперплазии устья маточных труб обычно не идентифицируются, так как полиповидные разрастания, локализованные преимущественно в области дна матки и трубных углов, перекрывают их просвет.
Полипы эндометрия отличает признак органоидности — наличие «ножки» (тонкого основания). Конфигурация их различная: округлая, овальная, продолговатая, конусовидная; размеры колеблются в пределах 0,3—4,0 см. Полипы, покрытые функциональным слоем, имеют гладкую поверхность и бледно-розовый оттенок (реже — ярко-красный). Наиболее часто располагаются в области дна и трубных углов матки. В тех наблюдениях, когда полипы, покрытые функциональным слоем, выявляются на фоне секреторного эндометрия, поверхность их бархатистая, с множественными складками, имеющими плоскую вершину. Эндоскопически железистые и железисто-фиброзные полипы
практически не отличаются от полипов, покрытых функциональным слоем. Цвет их бледно-розовый или бледно-серый, наиболее частой локализацией (также, как и полипов, покрытых функциональным слоем) являются дно и проекция углов матки. В ряде случаев железисто-фиброзные полипы характеризуются выраженным сосудистым рисунком (гистологически — расширенные периферические кровеносные сосуды).
Фиброзные полипы определяются в виде образований округлой или овальной формы, бледно-розового или бледножелтого цвета, с гладкой поверхностью и более широким основанием, чем у железистых или смешанных полипов. Сосудистый рисунок на поверхности фиброзных полипов не идентифицируется. Размеры их редко превышают 15 мм, как правило, фиброзные полипы единичные.
Эндоскопическая картина полипов с очаговым аденома- тозом идентична таковой железистых или железисто-фиброзных полипов, поскольку в последних при гистологическом исследовании могут выявляться очаги аденоматоза. Аденоматозные полипы определяются в виде образований тускло-серого цвета с неровной поверхностью. Величина этих полипов варьирует от 5 до 30 мм, иногда поверхность аденоматозных полипов отличает багрово-синюшный оттенок (гистологически — локальное нарушение кровообращения) или выраженный сосудистый рисунок (гистологически — многочисленные расширенные капилляры). Необходимо уточнить, что обнаружение во время гистероскопии образований тускло-серого цвета с неровной по-
верхностью позволяет лишь заподозрить аденоматозные полипы, так как установление морфотипа полипа и его пролиферативной активности — приоритет гистологического исследования микропрепаратов.
В ряде наблюдений определенные трудности вызывает дифференциальная диагностика фиброзных полипов эндометрия и подслизистых узлов миомы небольших размеров. Следует отметить, что полипы слизистой тела матки под давлением потока жидкой среды совершают колебательные движения, которые нехарактерны для подслизистых опухолей миометрия.
При раке эндометрия в полости дна матки (на отдельных участках ее стенок или на всем протяжении) выявляются папилломатозные разрастания серого или грязно-серого цвета с фрагментами кровоизлияния и некроза, а также усиленный сосудистый рисунок слизистой матки. В целом гистероскопическая картина злокачественной трансформации слизистой зависит от стадии неопластического процесса и, как правило, достаточно однотипна. Более того, при изменении объема вводимой жидкости раковая ткань легко распадается, крошится и кровоточит, что позволяет в 100% наблюдений установить правильный диагноз (безусловно, за исключением преинвазивной карциномы и 1а стадии рака).
Итак, кратко основные концепции особенностей гистероскопической картины неопластических процессов в эндометрии можно изложить следующим образом:
1—3 пункты идентичны одноименным простой гиперплазии;
Необходимо еще раз подчеркнуть, что решающим методом диагностики гиперпластических процессов эндометрия является гистологическое исследование полного соскоба слизистой. Выскабливание эндометрия следует производить накануне ожидаемой менструации или в ее первые часы. Особенно тщательно удаляют слизистую в области дна матки и ее трубных углов — наиболее частой локализа-
ции полипов и очаговых форм гиперплазии. Гистероскопию следует применять как до выскабливания — для уточнения характера патологической трансформации эндометрия, так и после него — с целью контроля над тщательностью выполняемой операции. Полученный соскоб направляют в патоморфологическую лабораторию, в сопроводительном бланке кратко указывают основные сведения о больной: возраст, жалобы, клиническую картину, длительность заболевания, характер менструальной функции, дату последней менструации или начала кровянистых выделений, клинический диагноз.
Гиперпластический процесс эндометрия — сложный патологический комплекс, включающий не только повреждения непосредственно в слизистой тела матки, но и нарушения важнейших функций всего организма. Поэтому при выборе метода терапии гиперпластических процессов учитывают как морфологические изменения в слизистой, так и возраст пациентки, ее соматический статус, длительность заболевания, наличие или отсутствие сопутствующей патологии, тяжесть ее течения.
Традиционно одним из первых методов лечения гиперпластических процессов эндометрия является лечебно-диагностическое выскабливание слизистой матки с последующей гормонотерапией. Назначение гормонотерапии в репродуктивном периоде предполагает устранение ановуля- ции, установление циклической секреторной трансформации эндометрия и восстановление репродуктивной функции. В пре- и постменопаузе стремятся к достижению стойкой аменореи и атрофии эндометрия.
В целом лечение гиперпластических процессов эндометрия предусматривает соблюдение трех основных принципов:
В настоящее время для гормонального воздействия на гиперплазированный эндометрий применяются, главным
образом, прогестагены, комбинированные эстроген-геста- генные препараты, антиэстрогены и антигонадотропины.
Прогестагены подавляют продукцию лютеинизирующе- го гормона, не влияя на уровень фолликулостимулирующего гонадотропина. В то же время считается, что синтетические гестагены действуют не непосредственно на аденогипофиз, а управляют выработкой гипоталамусом ри- лизинг-факторов. В отношении эндометрия следует отметить, что влияние синтетических прогестагенов на эти структуры определяется типом химического вещества. В частности, дериваты 19-нортестостерона (норэтистерон, ли- нестренол, дидрогестерон) оказывают неодинаковое воздействие на различные компоненты эндометриальной ткани: строма резко васкуляризируется, становится отечной и приобретает признаки децидуальной трансформации; напротив, железы атрофируются и теряют секреторную способность. Прогестагены активно связываются с эстроген- и прогестерон-связывающими рецепторами в тканях-мишенях, высвобождая при этом рецепторы к андрогенам, т. е. обладают прямым антиэстрогенным и антипрогестероновым действием.
Особое место среди искусственных прогестинов занимает гестринон — 19-норстероид, по химической структуре идентичный природным стероидам. Гестринон — норстеро- ид «третьего поколения» — обладает не только антигеста- генным, но и антиэстрогенным, антигонадотропным и антиандрогенным действием. Антипрогестероновый эффект гестринона заключается в блокаде взаимосвязей между эндогенным прогестероном и прогестерон-связывающими рецепторами в тканях, так как воздействие его осуществляется преимущественно через рецепторы к прогестерону, в которых и осуществляется блокада, т. е. гестринон обладает прямым антипрогестероновым эффектом. На периферическом уровне гестринон подавляет рост фолликулов, что, естественно, приводит к угнетению синтеза эстрогенов. В отношении андроген-связывающих рецепторов гестринон выступает как агонист, нарушая взаимодействие в системе андрогены — рецепторы. Как антигонадотропин гестринон подавляет пиковые выбросы фолликулостимулирующего и лютеинизирующего гормонов, однако их базальная секре-
ция на протяжении менструального цикла не изменяется. Таким образом, гестринон полностью блокирует стимуляцию эндометрия, вызывая в них атрофические процессы и, как их следствие, псевдоменопаузу.
Если «чистые» гестагены — прогестагены — главным образом применяют для лечения гиперпластических процессо
В соответствии с классификацией ВОЗ (1984) к гиперпластическим процессам эндометрия относятся гиперплазия, полипы и атипические изменения слизистой тела матки. Атипические процессы подразделяются на три степени в зависимости от выраженности патологической трансформации эндометрия: при I и II степенях наблюдаются структурные аномалии слизистой, при III степени — помимо структурных аномалий обнаруживаются изменения в строении клеточных элементов. В отечественной литературе атипические изменения в слизистой тела матки классифицируются на легкие, средние и тяжелые аденоматозные процессы, а также собственно атипические изменения в эндометрии. Выделение терминов «аденоматозные» и «атипические» процессы объясняется различием степеней риска злокачественной трансформации в очагах усиленной пролиферации и структурной перестройки эпителия.
Ведущее значение в патогенезе гиперпластических процессов в эндометрии отводится воздействию повышенных концентраций эстрогенов. Так, формирование гиперпластических процессов эндометрия в позднем репродуктивном и переходном возрасте происходит в условиях стойкой ги- перэстрогении на фоне пониженной продукции прогестерона. Известны несколько причин гиперэстрогении: дисфункция яичников (персистенция фолликула, атрезия фолликулов); фолликулярные кисты; стромальная гипер-
плазия; опухоли тека-клеток; гиперплазия коры надпочечников; нарушение гонадотропной функции гипофиза; некорректное применение эстрогенов; изменение в метаболизме гормонов (ожирение, цирроз печени, гипотиреоз); гиперплазия коркового слоя надпочечников. Таким образом, формирование гиперпластических процессов в эндометрии может быть обусловлено нарушением овуляции любой этиологии, приводящей к развитию абсолютной или относительной гиперэстрогении на фоне отсутствия или недостаточного антиэстрогенного влияния прогестерона. С учетом изложенного, можно выделить следующие механизмы гиперэстрогении: ановуляция в репродуктивном периоде и пременопаузе, гиперплазия тека-ткани яичников, ожирение и обусловленное нм повышенное превращение андростендиона в эстрон в жировой ткани.
Существует точка зрения о развитии гиперпластических процессов в эндометрии на фоне выраженной гипоэстро- гении. Известно, что для полноценной пролиферации и клеточного метаболизма необходимо воздействие определенных концентраций как эстрадиола, так и прогестерона. При этом условиями для развития секреторных преобразований в неизмененном пролиферирующем эндометрии являются: а) циклическое возрастание уровня прогестерона и б) сохранение уровня эстрадиола в маточном кровотоке не ниже 100 нг/мл. Нарушение баланса в «системе» эстрогены-прогестерон приводит к торможению процессов структурной подготовки клеток эндометрия к воздействию гес- тагенов. В подобной ситуации даже низкие концентрации эстрадиола способны поддерживать постоянную пролиферацию эпителия и обеспечить формирование гиперплазии эндометрия.
Кроме этого не исключается возможность развития гиперпластических процессов эндометрия в рамках сохраненных гормональных соотношений, особенно у пациенток репродуктивного возраста. В серии исследований обнаружено закономерное существование очаговой гиперплазии и железисто-фиброзных полипов на полноценном функционирующем эндометрии у женщин репродуктивного возраста с неизмененным гормональным статусом.
Среди дисгормональных состояний, обусловливающих развитие гиперпластических процессов, выделяют также нарушения физиологической секреции тиреоидных гормонов, являющихся модулятором действия эстрогенов на клеточном уровне. Дисбаланс этих гормонов может способствовать прогрессированию нарушений гисто- и органогенеза гормональнозависимых структур и формированию гиперпластических процессов эндометрия.
Безусловно, эндометрий, как гормональнозависимый орган-мишень, тонко реагирует на любые изменения гормонального статуса на уровне целого организма. В последние годы с помощью гистохимических, иммунохимических и электронно-микроскопических методов исследования были уточнены и расширены представления о тканевом гомеостазе эндометрия как органа-мишени. Установлено, что в регуляции процессов клеточной пролиферации принимают участие не только эстрогены, но и биологические амины (норадреналин, меланотонин, серотонин, брадики- нин, гистамин, инсулин, простагландины, паратгормон, глюкагон, гастрин), хориогонин и прочие пептиды, вырабатываемые клетками так называемой диффузной эндокринной системы — АПУД-системы (Amino Prekursor Uptake and Dekarboxylation). В норме апудоциты встречаются во многих органах, что обусловлено необходимостью контроля над процессами пролиферации клеток. В злокачественных нейроэндокринных опухолях различной локализации, в том числе в эндометрии, обнаружено многократное увеличение их концентрации, что создает условия для гиперсекреции биологически активных веществ в общий кровоток и воздействия последних на организм больной в целом. В неизмененной и атрофичной слизистой тела матки апудоциты или отсутствуют или содержатся в низких концентрациях, в то время как при диффузной гиперплазии и аденокарциноме их уровень возрастает в 5 и 20 раз соответственно. При этом у больных с повышенным содержанием эндокринных клеток в эндометрии выявляются сопутствующие экстрагенитальные заболевания — ожирение, артериальная гипертензия, гипергликемия и др.
В литературе имеются сообщения о «воспалительном» генезе гиперпластических процессов в эндометрии (Табак-
ман Ю. Ю. и соавт., 1987). В соответствии с этой теорией, каждый атрофичный орган легко подвержен влиянию неспецифических раздражителей, так как является тканью со сниженной или отсутствующей функцией. При этом неспецифический раздражитель может вызвать формирование как очаговой пролиферации, так и диффузной гиперплазии эпителия и стромы. Таким раздражителем является любой фактор, способный возбудить воспалительную реакцию, тем более что для инфекционного фактора тонкий атрофичный эндометрий является хорошей питательной средой. При длительно текущем воспалении развивается фиброз стромы и гиалинизация волокон, из-за блокады выводных протоков в железах эпителия образуется кистозное расширение. Более того, длительные морфологические и функциональные изменения в слизистой оболочке тела матки при хроническом эндометрите обусловливают возможность патологической афферентации в структуры центральной нервной системы, регулирующие деятельность гипоталамо-ги- пофизарно-яичниковой системы. Нарушения в этой системе приводят к развитию вторичной гипофункции яичников, формированию ановуляции по типу абсолютной или относительной гиперэстрогении и, следовательно, гиперпластических процессов в эндометрии.
Таким образом, современные представления о патогенезе гиперпластических процессов в эндометрии не ограничиваются «традиционными» концепциями «гиперэстроге- нии». По-видимому, патологическую трансформацию слизистой тела матки необходимо рассматривать как сложный биологический процесс, затрагивающий все звенья нейрогуморальной регуляции организма женщины.
Как правило, гиперпластическим изменениям подвергаются функциональный слой слизистой тела матки, значительно реже — базальный. При железистой гиперплазии эндометрий резко утолщен, железы имеют удлиненную форму, извилистые, пило- или штопорообразные. Отличия между железистой и железисто-кистозной гиперплазией не принципиальны и в основном сводятся к наличию или отсутствию кистозно расширенных желез (при железистокистозной гиперплазии наблюдается картина «швейцарского сыра»). Дифференцирование функционального слоя на
компактный и спонгиозный отсутствует. В большинстве случаев имеет место нечеткое отграничение функционального слоя от базального. Железистый эпителий цилиндрический, находится в состоянии оживленной пролиферации, наблюдается большое количество митозов. В кистозно расширенных железах эпителий кубический или резко уплощенный. Строма эндометрия густая, местами отечная, состоящая из округлых клеток с признаками оживленной пролиферации и повышенной активностью митозов. Между клетками беспорядочно расположена густая сеть арген- тофильных волокон, более плотных и грубых, чем в нормальном эндометрии.
На фоне гиперэстрогении формируется застойное полнокровие ткани эндометрия с резким расширением капилляров, нарушается кровообращение (престаз, стаз) с образованием гиалиновых тромбов. Расстройство местного кровообращения и изменение проницаемости сосудистых стенок обусловливают гипоксию и нарушение обмена веществ в ткани эндометрия. Морфологическим субстратом кровотечения, возникающего в ответ на падение уровня эстрогенов, являются участки слизистой тела матки с нарушенным кровообращением: резко расширенные тонкостенные кровеносные сосуды типа синусоид, расположенные в поверхностном слое эндометрия; участки с выраженными дистрофическими изменениями и тромбированными сосудами при наличии или отсутствии очагов некроза.
Реже, в сравнении с гиперплазией функционального слоя эндометрия, развивается гиперплазия базального слоя слизистой. Патологическое утолщение базального слоя распространяется на всю слизистую или имеет очаговый характер. Именно последняя форма базалыюй гиперплазии является исходным местом образования полипов эндометрия. По мере утолщения базального слоя происходит истончение функционального, циклические процессы в последнем протекают недостаточно интенсивно. Железы базального слоя узкие, прямые. Железистый эпителий в глубоких слоях базального слоя всегда нефункционирующий. Строма густая, нередко фиброзная. Резко выделяются сосуды с утолщенными склерозированными стенками, расположенные в виде клубков.
Полипы эндометрия возникают из патологически измененного базального слоя слизистой тела матки. Утолщенные очаги этого слоя вытягиваются, удлиняются и принимают форму полипов, вначале расположенных на широком основании, а впоследствии, благодаря сократительной деятельности матки, — на тонком («ножке»). Формирование полипов обусловлено, по-видимому, патологическим состоянием сосудов базального слоя и местным изменением рецепторного аппарата слизистой матки, проявляющимся увеличением концентрации рецепторов к эстрогенам. Наиболее частой локализацией полипов эндометрия является слизистая дна и углов матки. Полипы могут быть единичными или множественными. Принимая во внимание, что патогномоничным анатомическим признаком полипов является тонкое основание («ножка»), наличие которого отличает полипы от полиповидной формы железистой гиперплазии эндометрия, считается необоснованным употребление термина «полипоз эндометрия».
Морфологически полипы эндометрия характеризуются наличием стромального и железистого компонентов, а также расширенных кровеносных сосудов с утолщенными склерозированными стенками, расположенными в их основании или ножке. В клинической практике выделяют следующие их виды:
- полипы, покрытые функциональным слоем;
- железистые (железисто-кистозные) полипы;
- фиброзные полипы;
- железисто-фиброзные полипы;
- аденоматозные полипы;
- полипы с очаговым аденоматозом.
Полипы, покрытые функциональным слоем, встречаются только у больных репродуктивного периода с сохраненным двухфазным менструальным циклом и располагаются на фоне секреторного эндометрия. В железисто-фиброзных полипах преобладает стромальный компонент над железистым, причем для последнего не характерны фазные преобразования. Железистые полипы отличаются преобладанием железистого компонента над стромальным, железы полипов данного вида циклически неактивны. В фиброзных полипах железы отсутствуют или имеются единичные,
эпителий их нефункционирующий. Интенсивная пролиферация желез и их эпителия характерна для полипов с очаговым аденоматозом. Эпителий железистого компонента вне очагового аденоматоза нефункционирующий или с признаками слабо выраженной пролиферации. Особенностью аденоматозных полипов является обилие желез, их эпителий находится в состоянии интенсивной пролиферации с относительно высокой митотической активностью. В аденоматозных полипах повышено содержание РНК в цитоплазме, а также увеличена площадь ядер и концентрация ДНК в них. В клинико-патогенетическом аспекте полипы эндометрия целесообразно выделять в самостоятельное заболевание (при развитии их на фоне секреторной или атрофической слизистой тела матки) или трактовать как сопутствующий патологический процесс (в сочетании с дисфункцией яичников, миомой и/или внутренним эндометриозом тела матки).
С морфологических позиций к предраку эндометрия относят: атипическую гиперплазию, очаговый аденоматоз и аде
номатозные полипы. Б. И. Железнов предраковые состояния эндометрия рассматривает шире, а также выделяет различные формы атипической гиперплазии эндометрия:
- Атипическая гиперплазия функционального и (или) базального слоев:
а) нерезкая форма предраковых изменений;
б) выраженная форма предраковых изменений.
- Очаговый аденоматоз в железистой (железисто-кистозной) и базальной гиперплазии, полипах, диспластичес- ком, гипопластическом, атрофическом и малоизмененном функциональном и (или) базальном слоях эндометрия.
- Аденоматозные полипы:
а) нерезкая форма предраковых изменений;
б) выраженная форма предраковых изменений.
Гистологическая картина атипической гиперплазии характеризуется структурной перестройкой и более интенсивной пролиферацией желез. При нерезкой форме предраковых изменений происходит обильное разрастание извитых желез, имеющих причудливую форму (на косых срезах напоминают картину «железа в железе»). Железистый эпителий с признаками повышенной митотической активности.
Выраженная форма предрака эндометрия отличается интенсивной пролиферацией желез с отчетливой атипией эпителия. Железистый эпителий многорядный, с признаками полиморфизма. Цитоплазма эпителиальных клеток увеличена в размерах, эозинофильна; ядра клеток также увеличены, бледные. Отчетливо идентифицируются глыб- ки хроматина и крупные ядрышки. Подобная картина вызывает определенные затруднения в дифференциальной диагностике с аденокарциномой эндометрия, в связи с чем некоторые авторы предлагают использовать термины «нулевая стадия рака эндометрия», «преинвазивная карцинома». При выраженной форме атипической гиперплазии увеличивается митотическая активность и возрастает количество и спектр патологических митозов.
Морфологический предрак трансформируется в аденокарциному приблизительно в 10% случаев; нередко длительно и неоднократно выявляется у одной и той же больной (несмотря на проводимую консервативную терапию), крайне редко подвергается обратному развитию.
Клинический опыт убеждает, что вероятность перехода в рак не только атипической гиперплазии (аденоматоза), но и других гиперпластических процессов эндометрия, не относящихся к морфологическому предраку, достаточно высока (при соответствующих условиях). Таковыми условиями являются нарушения эндокринной системы (нейрообменноэндокринный синдром), возраст (пре- и постменопауза) и характер течения гиперпластического процесса (рецидиви- рование).
В связи с этим предраковые изменения эндометрия целесообразно оценивать в соответствии с возрастом больной, клиническим течением патологического процесса, нарушениями гормонального и обменного характера. В частности, к предраковым состояниям в постменопаузальном периоде относят атрофию эндометрия, сопровождающуюся кровотечением. Классификация предрака эндометрия, предложенная Г. М. Савельевой и В. Н. Серовым, учитывает не только морфоструктурные нарушения, но и клинические проявления заболевания:
I. Аденоматоз и аденоматозные полипы в любом возрасте женщины.
- Железистая гиперплазия эндометрия в сочетании с гипоталамическим нейрообменно-эндокринным синдромом (гипоталамическим синдромом, протекающим по типу болезни Иценко —Кушинга) в любом возрасте женщины.
- Железистая гиперплазия эндометрия, особенно рецидивирующая в период менопаузы.
В клинике больных гиперпластическими процессами эндометрия преобладают нарушения менструальной функции — ациклические маточные кровотечения, контактные кровотечения, реже — меноррагии по типу полименореи. Учитывая, что патогенетическую основу гиперпластических процессов слизистой тела матки составляет ановуляция, ведущим симптомом больных репродуктивного возраста является бесплодие, как правило, первичное, реже — вторичное.
Не вызывает сомнений, что решающим методом диагностики патологических состояний эндометрия является гистологическое изучение полного его соскоба, позволяющее определить характер морфоструктурных изменений. Однако применение современных высокоинформативных методов исследования в ряде наблюдений позволяет пересмотреть клинический диагноз и скорректировать тактику лечения больных. В широкой клинической практике для этих целей используют трансвагинальное ультразвуковое сканирование и гистероскопию.
Трансвагинальное ультразвуковое сканирование. При подозрении на гиперпластический процесс и рак слизистой тела матки особое внимание уделяется изучению так называемого срединного маточного эха (М-эха) — отражения от эндометрия и стенок полости матки. При этом оценивают его форму, контуры и внутреннее строение. Ведущее значение придают определению величины переднезаднего размера (ПЗР) М-эха, учитывая наибольшую прогностическую ценность данного критерия при патологической трансформации эндометрия. В репродуктивном периоде максимальные значения ПЗР неизмененного М-эха наблюдаются в период расцвета желтого тела (секреторная фаза менструального цикла) и варьируют в пределах 10—16 мм. Поэтому увеличение переднезаднего размера М-эха свыше ука-
занных значений необходимо рассматривать как возможное проявление патологического процесса.
Несомненно, трансвагинальное ультразвуковое сканирование представляет высокоинформативный метод диагностики патологической трансформации слизистой тела матки. Тем не менее, эхография не может и не должна применяться для установления морфологической структуры неопластического процесса:
- во-первых, диагностировать тип морфоструктурных преобразований в слизистой тела матки с высокой степенью точности с помощью ультразвукового сканирования не представляется возможным;
- во-вторых, определение морфотипа патологической трансформации эндометрия не имеет клинического значения, так как лечение больных проводят только с учетом данных гистологического исследования био- птата эндометрия.
Акустической особенностью полипов эндометрия является появление внутри расширенной полости матки округлой или овальной формы образования с ровными контурами и высокой эхоплотностыо. Ультразвуковая картина срединной структуры матки при полипах эндометрия отличается выраженным полиморфизмом и зависит от размеров, локализации и формы полипа. Вместе с тем, лишь идентификация четких границ между патологическим образованием и стенками полости матки является убедительным признаком данной формы гиперпластических процессов эндометрия. При наличии маточного кровотечения граница между контурами эндометрия и полипом усиливается и определяется на сканограммах в виде эхонегативного ободка акустической тени, отражающей скопление крови (рис. 6). Один из дифференциально-диагностических критериев полипов эндометрия — отсутствие деформации М-эха, так как полипы, в отличие от подслизистых узлов миомы, не изменяют форму полости матки. Однако в редких случаях (при фиброзных полипах сравнительно больших размеров) мы наблюдали деформацию срединной структуры матки полипами эндометрия сравнительно больших размеров (средний диаметр их достигал 20—25 мм, при гистологическом изучении обнаружены фиброзные полипы).
Ультразвуковая диагностика гиперплазии эндометрия основывается на выявлении в зоне расположения срединного маточного эха овальной формы образования, увеличенного в переднезаднем направлении с однородной структурой и повышенной эхоплотностью — тип 1. Для второго типа эхограмм характерно появление ровных утолщенных (до 4—7 мм) контуров эндометрия с низким уровнем звукопроводимости, ограничивающих гомогенную зону с меньшим волновым импедансом (рис. 7).

Рис. 7. Трансвагинальное ультразвуковое сканирование. Гиперплазия эндометрия
До настоящего времени дискутируется вопрос о возможности и целесообразности ультразвуковой диагностики рака эндометрия. Результаты исследований, проведенных в нашей клинике, а также данные литературы убеждают, что эхографическая диагностика рака эндометрия представляет определенные трудности, обусловленные, главным образом, двумя причинами:
- на начальных этапах формирования злокачественной трансформации эндометрия отсутствуют какие-либо специфические акустические критерии заболевания;
- образование при длительном маточном кровотечении фибрина симулирует ультразвуковую картину рака эндометрия, что значительно усложняет интерпретацию эхограмм.
Таким образом, вопрос о диагностической ценности ультразвукового сканирования при раке эндометрия остается открытым. Вместе с тем, не вызывает сомнений, что ценность любого дополнительного метода исследования определяет возможность диагностировать патологический процесс до появления его клинической симптоматики. Как известно, основным клиническим признаком рака эндометрия является маточное кровотечение в постменопаузе. Данный симптом наблюдается почти у 50% больных раком матки. Кроме этого в генезе злокачественной трансформации эндометрия немаловажная роль отводится нарушениям менструальной функции по типу ановуляции в различных возрастных периодах. Наличие изложенных выше клинических признаков в большинстве случаев является показанием для биопсии эндометрия с целью изучения его морфоструктуры. Следовательно, в подобных наблюдениях применение ультразвукового сканирования для диагностики гиперпластических процессов и рака эндометрия не имеет практического значения. В то же время эхография представляет оптимальный метод выявления патологических состояний эндометрия при массовых обследованиях населения и в ряде случаев способствует обнаружению доклинических форм злокачественной трансформации эндометрия, главным образом, при 0 и 1а стадиях заболевания (классификация Министерства здравоохранения СССР, 1985 г.).
Гистероскопия. Гистероскопическая картина гиперплазии эндометрия характеризуется широкой вариабельностью и зависит от формы патологического процесса (простая или полиповидная), распространенности (очаговая или диффузная), длительности маточного кровотечения. При простои гиперплазии эндометрий неравномерно утолщен, имеет складчатое строение; основание складок широкое, вершина — тонкая, с неровными краями, оттенок складок варьирует от бледно-розового до ярко-красного цвета. Изменение давления в полости матки при ее растяжении жидкими средами позволяет визуализировать волнообразные движения слизистой оболочки — признак «подводных растений». Высота слизистой определяется продолжительностью маточного кровотечения. При отсутствии последнего может достигать 20 мм; в основном — варьирует в пределах 10— 15 мм. Сосудистый рисунок резко выражен, однако какие- либо его особенности, патогномоничные для гиперплазии, обнаружить не удается. Выводные протоки трубчатых желез четко визуализируются, расположены равномерно. Устья маточных труб, как правило, свободны; реже — не выявляются из-за резкого отека слизистой.
Отличительной особенностью кистозной формы железистой гиперплазии является наличие множественных кистозных полостей, расположенных в проекции поверхностных сосудов слизистой, имеющих различную толщину (так называемый феномен «ловушки», поскольку эти полости идентифицируются как бы в «сетях» сосудистого сплетения). Диаметр кистозных структур не превышает 2—3 мм, иногда они принимают бурый оттенок вследствие очагового кровоизлияния в кисту.
Полиповидная форма гиперплазии эндометрия характеризуется появлением множества полиповидньгх разрастаний (шарообразной формы структуры на широком основании) бледно-розового или сине-багрового цвета, свисающих в просвет полости матки. Величина полиповидньгх разрастаний колеблется от нескольких миллиметров до 1,0—1,5 см. При данной форме гиперплазии устья маточных труб обычно не идентифицируются, так как полиповидные разрастания, локализованные преимущественно в области дна матки и трубных углов, перекрывают их просвет.
Полипы эндометрия отличает признак органоидности — наличие «ножки» (тонкого основания). Конфигурация их различная: округлая, овальная, продолговатая, конусовидная; размеры колеблются в пределах 0,3—4,0 см. Полипы, покрытые функциональным слоем, имеют гладкую поверхность и бледно-розовый оттенок (реже — ярко-красный). Наиболее часто располагаются в области дна и трубных углов матки. В тех наблюдениях, когда полипы, покрытые функциональным слоем, выявляются на фоне секреторного эндометрия, поверхность их бархатистая, с множественными складками, имеющими плоскую вершину. Эндоскопически железистые и железисто-фиброзные полипы
практически не отличаются от полипов, покрытых функциональным слоем. Цвет их бледно-розовый или бледно-серый, наиболее частой локализацией (также, как и полипов, покрытых функциональным слоем) являются дно и проекция углов матки. В ряде случаев железисто-фиброзные полипы характеризуются выраженным сосудистым рисунком (гистологически — расширенные периферические кровеносные сосуды).
Фиброзные полипы определяются в виде образований округлой или овальной формы, бледно-розового или бледножелтого цвета, с гладкой поверхностью и более широким основанием, чем у железистых или смешанных полипов. Сосудистый рисунок на поверхности фиброзных полипов не идентифицируется. Размеры их редко превышают 15 мм, как правило, фиброзные полипы единичные.
Эндоскопическая картина полипов с очаговым аденома- тозом идентична таковой железистых или железисто-фиброзных полипов, поскольку в последних при гистологическом исследовании могут выявляться очаги аденоматоза. Аденоматозные полипы определяются в виде образований тускло-серого цвета с неровной поверхностью. Величина этих полипов варьирует от 5 до 30 мм, иногда поверхность аденоматозных полипов отличает багрово-синюшный оттенок (гистологически — локальное нарушение кровообращения) или выраженный сосудистый рисунок (гистологически — многочисленные расширенные капилляры). Необходимо уточнить, что обнаружение во время гистероскопии образований тускло-серого цвета с неровной по-
верхностью позволяет лишь заподозрить аденоматозные полипы, так как установление морфотипа полипа и его пролиферативной активности — приоритет гистологического исследования микропрепаратов.
В ряде наблюдений определенные трудности вызывает дифференциальная диагностика фиброзных полипов эндометрия и подслизистых узлов миомы небольших размеров. Следует отметить, что полипы слизистой тела матки под давлением потока жидкой среды совершают колебательные движения, которые нехарактерны для подслизистых опухолей миометрия.
При раке эндометрия в полости дна матки (на отдельных участках ее стенок или на всем протяжении) выявляются папилломатозные разрастания серого или грязно-серого цвета с фрагментами кровоизлияния и некроза, а также усиленный сосудистый рисунок слизистой матки. В целом гистероскопическая картина злокачественной трансформации слизистой зависит от стадии неопластического процесса и, как правило, достаточно однотипна. Более того, при изменении объема вводимой жидкости раковая ткань легко распадается, крошится и кровоточит, что позволяет в 100% наблюдений установить правильный диагноз (безусловно, за исключением преинвазивной карциномы и 1а стадии рака).
Итак, кратко основные концепции особенностей гистероскопической картины неопластических процессов в эндометрии можно изложить следующим образом:
- простая гиперплазия эндометрия:
- поверхность слизистой неровная с многочисленными складками; цвет — бледно-розовый, реже — яркокрасный;
- высота эндометрия в пределах 10—15 мм;
- выводные протоки желез визуализируются, расположены равномерно;
- сосудистый рисунок резко выражен;
- устья маточных труб, как правило, свободны;
- кистозная гиперплазия эндометрия:
1—3 пункты идентичны одноименным простой гиперплазии;
- сосудистая сеть резко выражена, причем сосуды имеют неодинаковую толщину;
- визуализируются множественные кистозные полости расположенных в проекции поверхностных сосудов слизистой — феномен «ловушки»;
- устья маточных труб свободны;
- полиповидная гиперплазия эндометрия:
- поверхность слизистой неровная с множественными полиповидными разрастаниями;
- высота эндометрия до 15 мм;
- выводные протоки желез не определяются;
- сосудистый рисунок резко выражен;
- устья маточных труб не идентифицируются;
- полипы эндометрия (покрытые функциональным слоем, железистые, железисто-фиброзные, в том числе с очаговым аденоматозом):
- поверхность гладкая, цвет — бледно-розовый, реже — ярко-красный;
- имеется тонкое основание — «ножка»;
- преимущественная локализация — дно матки и трубные углы;
- аденоматозные полипы эндометрия:
- поверхность неровная, цвет — тускло-серый;
- имеется тонкое основание — «ножка»;
- преимущественная локализация — дно матки и трубные углы;
- рак эндометрия:
- поверхность неровная с папилломатозными разрастаниями, цвет — серый или грязно-серый;
- сосудистый рисунок резко усилен с фрагментами некроза и кровоизлияния;
- при изменении объема вводимой жидкости ткань легко распадается, крошится и кровоточит.
Необходимо еще раз подчеркнуть, что решающим методом диагностики гиперпластических процессов эндометрия является гистологическое исследование полного соскоба слизистой. Выскабливание эндометрия следует производить накануне ожидаемой менструации или в ее первые часы. Особенно тщательно удаляют слизистую в области дна матки и ее трубных углов — наиболее частой локализа-
ции полипов и очаговых форм гиперплазии. Гистероскопию следует применять как до выскабливания — для уточнения характера патологической трансформации эндометрия, так и после него — с целью контроля над тщательностью выполняемой операции. Полученный соскоб направляют в патоморфологическую лабораторию, в сопроводительном бланке кратко указывают основные сведения о больной: возраст, жалобы, клиническую картину, длительность заболевания, характер менструальной функции, дату последней менструации или начала кровянистых выделений, клинический диагноз.
Гиперпластический процесс эндометрия — сложный патологический комплекс, включающий не только повреждения непосредственно в слизистой тела матки, но и нарушения важнейших функций всего организма. Поэтому при выборе метода терапии гиперпластических процессов учитывают как морфологические изменения в слизистой, так и возраст пациентки, ее соматический статус, длительность заболевания, наличие или отсутствие сопутствующей патологии, тяжесть ее течения.
Традиционно одним из первых методов лечения гиперпластических процессов эндометрия является лечебно-диагностическое выскабливание слизистой матки с последующей гормонотерапией. Назначение гормонотерапии в репродуктивном периоде предполагает устранение ановуля- ции, установление циклической секреторной трансформации эндометрия и восстановление репродуктивной функции. В пре- и постменопаузе стремятся к достижению стойкой аменореи и атрофии эндометрия.
В целом лечение гиперпластических процессов эндометрия предусматривает соблюдение трех основных принципов:
- остановка кровотечения;
- восстановление менструальной функции в репродуктивном периоде или стойкой менопаузы в более старшем возрасте;
- профилактика рецидивов заболевания.
В настоящее время для гормонального воздействия на гиперплазированный эндометрий применяются, главным
образом, прогестагены, комбинированные эстроген-геста- генные препараты, антиэстрогены и антигонадотропины.
Прогестагены подавляют продукцию лютеинизирующе- го гормона, не влияя на уровень фолликулостимулирующего гонадотропина. В то же время считается, что синтетические гестагены действуют не непосредственно на аденогипофиз, а управляют выработкой гипоталамусом ри- лизинг-факторов. В отношении эндометрия следует отметить, что влияние синтетических прогестагенов на эти структуры определяется типом химического вещества. В частности, дериваты 19-нортестостерона (норэтистерон, ли- нестренол, дидрогестерон) оказывают неодинаковое воздействие на различные компоненты эндометриальной ткани: строма резко васкуляризируется, становится отечной и приобретает признаки децидуальной трансформации; напротив, железы атрофируются и теряют секреторную способность. Прогестагены активно связываются с эстроген- и прогестерон-связывающими рецепторами в тканях-мишенях, высвобождая при этом рецепторы к андрогенам, т. е. обладают прямым антиэстрогенным и антипрогестероновым действием.
Особое место среди искусственных прогестинов занимает гестринон — 19-норстероид, по химической структуре идентичный природным стероидам. Гестринон — норстеро- ид «третьего поколения» — обладает не только антигеста- генным, но и антиэстрогенным, антигонадотропным и антиандрогенным действием. Антипрогестероновый эффект гестринона заключается в блокаде взаимосвязей между эндогенным прогестероном и прогестерон-связывающими рецепторами в тканях, так как воздействие его осуществляется преимущественно через рецепторы к прогестерону, в которых и осуществляется блокада, т. е. гестринон обладает прямым антипрогестероновым эффектом. На периферическом уровне гестринон подавляет рост фолликулов, что, естественно, приводит к угнетению синтеза эстрогенов. В отношении андроген-связывающих рецепторов гестринон выступает как агонист, нарушая взаимодействие в системе андрогены — рецепторы. Как антигонадотропин гестринон подавляет пиковые выбросы фолликулостимулирующего и лютеинизирующего гормонов, однако их базальная секре-
ция на протяжении менструального цикла не изменяется. Таким образом, гестринон полностью блокирует стимуляцию эндометрия, вызывая в них атрофические процессы и, как их следствие, псевдоменопаузу.
Если «чистые» гестагены — прогестагены — главным образом применяют для лечения гиперпластических процессо
А так же в разделе « ГИПЕРПЛАСТИЧЕСКИЕ ПРОЦЕССЫ ЭНДОМЕТРИЯ »
- Методы оценки сердечной деятельности плода
- Определение биофизического профиля плода.
- Инвазивные методы пренатальной диагностики.
- ГЕСТОЗЫ
- ДЕКОМПЕНСИРОВАННАЯ ФОРМА ПЛАЦЕНТАРНОЙ НЕДОСТАТОЧНОСТИ
- ВРОЖДЕННЫЕ ПОРОКИ РАЗВИТИЯ ПЛОДА
- КЛИНИЧЕСКИ УЗКИЙ ТАЗ
- АКУШЕРСКАЯ ТАКТИКА, ИНТЕНСИВНАЯ ТЕРАПИЯ И ПРОФИЛАКТИКА КРОВОТЕЧЕНИЯ В ПОСЛЕДОВОМ И РАННЕМ ПОСЛЕРОДОВОМ ПЕРИОДАХ
- ЭФФЕРЕНТНЫЕ МЕТОДЫ ЛЕЧЕНИЯ В АКУШЕРСТВЕ
- Эфферентные методы в лечении гестозов у беременных
- Эфферентные методы в лечении гнойных септических заболеваний
- Эфферентные методы лечения при вирусных инфекциях у беременных
- Эфферентные методы лечения при иммунологическом конфликте
- Эфферентные методы при антифосфолипидном синдроме в акушерстве
- ВНУТРИУТРОБНЫЕ ИНФЕКЦИИ
- Особенности отдельных нозологических форм внутриутробных инфекций
- КЕСАРЕВО СЕЧЕНИЕ В СОВРЕМЕННОМ АКУШЕРСТВЕ
- СЕПТИЧЕСКИЕ ОСЛОЖНЕНИЯ КЕСАРЕВА СЕЧЕНИЯ
- НЕЙРОГУМОРАЛЬНАЯ РЕГУЛЯЦИЯ МЕНСТРУАЛЬНОГО ЦИКЛА
- ФИЗИОЛОГИЯ репродуктивной системы
- Нейрогуморальная регуляция менструального цикла
- Роль простагландинов в регуляции репродуктивной системы
- ГНОЙНЫЕ ВОСПАЛИТЕЛЬНЫЕ ЗАБОЛЕВАНИЯ ПРИДАТКОВ МАТКИ
- Патогенетические механизмы инфицирования внутренних половых органов.
- Этиологическая структура гнойных воспалительных заболеваний придатков матки.
- Патогенез гнойных воспалительных заболеваний придатков матки.
- Принципы и методы лечения гнойных воспалительных заболеваний придатков матки.
- Иммунокорригирующая терапия.
- ЗАБОЛЕВАНИЯ, ПЕРЕДАВАЕМЫЕ ПОЛОВЫМ ПУТЕМ (ЗППП)
- МИОМА МАТКИ
- Патогенез миомы матки
- Классификация.
- Клиника.
- Осложнения.
- Онкологическая настороженность.
- Основные критерии.
- Дифференциальная диагностика.
- ГЕНИТАЛЬНЫЙ ЭНДОМЕТРИОЗ