ВРОЖДЕННЫЕ ПОРОКИ РАЗВИТИЯ ПЛОДА
Врожденные пороки развития плода занимают 2—3 место в структуре причин перинатальной смертности, причем частота их за последние годы существенно увеличилась. В связи с этим, особую актуальность приобретает ранняя диагностика пороков развития, способствующая своевременному решению вопроса о возможности дальнейшего пролонгирования беременности, которая, в свою очередь, определяется видом аномалии, совместимостью с жизнью и прогнозом в отношении постнатального развития.
Пороки центральной нервной системы. Классификация часто встречающихся пороков развития центральной нервной системы (ЦНС) может быть представлена следующим образом:
а) стеноз водопровода мозга;
б) открытая гидроцефалия;
в) синдром Денди—Уокера.
а) spina bifida;
б) анэнцефалия;
в) цефалоцеле.
Гидроцефалия встречается с частотой 0,3 — 0,8 на 1000 Живорожденных. В большинстве наблюдений врожденная гидроцефалия обусловлена обструкцией на одном из участков пути циркуляции спинномозговой жидкости (СМЖ). Нередко гидроцефалия сочетается с другими аномалиями: в 37% наблюдений ей сопутствует иная внутричерепная патология — гипоплазия мозолистого тела, цефалоцеле, артерио-венозные аномалии, арахноидальные кисты; внечерепные аномалии — в 63%. Среди последних следует отметить пороки развития почек (одно- и двусторонняя are-
незия и дисплазия), пороки сердца (дефект межжелудочковой перегородки, тетрада Фалло), менингомиелоцеле, расщепление верхней губы, твердого и мягкого нёба, агенезию ануса и толстой кишки, дисгенезию гонад, синдром Мек- келе. У 11% плодов обнаруживают хромосомные аномалии — трисомия по 21 паре, сбалансированные транслокации, мозаицизм.
Гидроцефалия представлена тремя основными формами:
Стеноз водопровода мозга (СВМ) — форма обструктивной гидроцефалии, обусловленная сужением сильвиева водопровода. Удельная частота СВМ достигает 43%, соотношение детей мужского и женского пола составляет 1:8. Аномалия имеет полиэтиологический характер: генетические, инфекционные, тератогенные и опухолевые факторы, среди которых преобладают инфекционные (50%). В экспериментальных исследованиях подтверждена роль токсо- плазмоза, сифилиса, цитомегаловирусной инфекции, эпидемического паротита и гриппа.
В определенной части наблюдений причиной стеноза водопровода мозга является генетическая патология, которая может наследоваться по рецессивному типу, сцепленному с Х-хромосомой. Сцепленное с полом наследование относят к редким причинам СВМ, так как оно встречается с частотой 1 случай на 200 сибсов пробандов с гидроцефалией. Однако возможно, что такой тип наследования составляет 25% среди детей мужского пола. Предполагают, что глиома, менингиома, нейрофиброматоз и туберозный склероз приводят к стенозу водопровода за счет компрессионного механизма, а открытая гидроцефалия — в результате отека белого вещества и внешнего сдавления. Сочетанные аномалии встречаются у 16% детей.
Диагностика данной формы гидроцефалии основывается на обнаружении при ультразвуковом исследовании расширения боковых и III желудочков при неизмененных размерах IV желудочка. Необходимо проводить тщательное сканирование позвоночника плода для исключения сочетанных с полом аномалий (рис. 2).
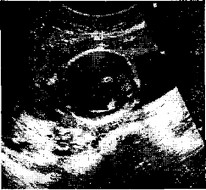
Рис. 2. Беременность 21 нед.
Обструктивная гидроцефалия
Прогноз: смертность в детском возрасте колеблется в пределах 11 — 30%; интеллектуальное развитие может быть нормальным.
Акушерская тактика: до достижения плодом жизнеспособности показано прерывание беременности; при установлении диагноза в поздние сроки метод родоразрешения определяется исключительно акушерскими показаниями.
Открытая гидроцефалия (ОГ) — расширение желудочков мозга и его субарахноидальной системы в результате обструкции внежелудочковой системы путей оттока спинномозговой жидкости.
Открытая гидроцефалия является второй по частоте, на ее долю приходится 38% всех наблюдений гидроцефалии.- Этиология ОГ не уточнена. ОГ выявляется у детей со спинальными дефектами и облитерацией переднего сагиталь- ного синуса, субарахноидальными кровоизлияниями, папилломой сосудистого сплетения и отсутствием грануляций Паччиони. Субарахноидальное кровоизлияние служит наиболее частой причиной открытой гидроцефалии у новорожденных; в пренатальном периоде встречается крайне редко. Наследуется также редко, хотя частота повторяемости достигает 1—2%, что существенно выше, чем в общей популяции.
Патогенез: механическая обструкция внежелудочковой системы мозга и нарушение реабсорбции СМЖ приводят к расширению субарахноидального пространства, а затем и мозговых желудочков; внутренняя гидроцефалия развивается на фоне обструкции водопровода мозга, вследствие повышения внутричерепного давления.
Пренатальная диагностика ОГ осуществляется с помощью динамического ультразвукового сканирования. При этом патогномоничным признаком является расширение субарахноидальной цистерны.
Прогноз: уровень смертности достигает 11 %. У большинства выживших детей сохраняется нормальный интеллект. При сочетании ОГ с дефектами нервной трубки или папилломой сосудистого сплетения прогноз более неблагоприятный.
Акушерская тактика: в ранние сроки выявления ОГ показано прерывание беременности, при доношенной беременности роды ведут через естественные родовые пути.
Для синдрома Денди—Уокера типично сочетание следующих аномалий:
Синдром встречается у 12% детей с врожденной гидроцефалией. Этиология неизвестна. Этот синдром может быть одним из проявлений генетических заболеваний (синдромы Меккеля и Варбурга), а также выявляться и при хромосомных абберациях (синдром Тернера, 6р-, 9§Г1+, трисо- мия 9, триплоидия). В редких наблюдениях возможно наследование по аутосомно-рецессивному типу с риском повторения до 25%.
Патоэмбриогенез. Согласно теории Денди—Уокера, к расширению желудочковой системы обычно приводит атрезия отверстий Лушки и Мажанди. Синдром представляет сложную аномалию развития срединных структур головного мозга в области ромбовидной ямки. Гипоплазия червя мозжечка и кисты заднечерепной ямки возникают вторично, вследствие сдавления его резко расширенным IV желудочком. Имеет место и дисбаланс продукции спинно-
мозговой жидкости в боковых, III и IV желудочках. Дефект червя мозга варьирует от полной аплазии до небольшого расщепления. Несмотря на то, что гидроцефалия является основным диагностическим признаком синдрома Денди — Уокера, у большинства детей в момент рождения она отсутствует однако, проявляется в первые месяцы жизни ребенка.
Синдром нередко (более чем в 50% наблюдений) сочетается с другими пороками развития ЦНС (агенезия мозолистого тела, энцефалоцеле), пороками почек (поликистоз) и сердца (дефект межжелудочковой перегородки).
Диагностика: на данную аномалию указывает обнаружение во время эхографии кистозных образований в задней черепной ямке; патогномоничным акустическим признаком синдрома является дефект червя мозга, через который киста сообщается с IV желудочком.
Прогноз неблагоприятный: смертность достигает 50%, у 50—60% выживших детей отмечается отставание интеллектуального развития.
Акушерская тактика: в любом сроке производят прерывание беременности.
Папиллома сосудистого сплетения (ПСС). Внутричерепное новообразование встречается с частотой 0,6% от всех опухолей мозга, выявляемых у взрослых и 3% — у детей. Папиллома может локализоваться в любом отделе желудочковой системы, но чаще обнаруживается на уровне преддверия боковых желудочков. Характерна односторонняя локализация опухоли, хотя не исключается двусторонний процесс. Наиболее часто ПСС представлена тканью ворсин, гистологически сходной с тканью интактного сосудистого сплетения, и носит доброкачественный характер. Тем не менее, возможна малигнизация опухоли с прорастанием в смежную нервную ткань. Папиллома сосудистого сплетения обычно сочетается с гидроцефалией.
Этиология неизвестна. В мировой практике известны единичные наблюдения ПСС у больные •" синдромом Аикарди (данное заболевании сцеплено с Л фомосомой и характеризуется агенезией мозолистого тела, хориоретинальными лакунами, аномалиями позвоночника, эпилепсией и умственной отсталостью).
ПСС диагностируется у детей с гидроцефалией во время нейросонографии или рентгенологического исследова-
ния. В детском возрасте методом выбора следует считать контрастную компьютерную томографию. В качестве метода пренатальной диагностики наиболее информативным является ультразвуковое сканирование. Эхографическими критериями ПСС являются асимметрия формы и размеров контралатеральных желудочков, визуализация в преддверии боковых желудочков слабоэхогенных образований, примыкающих к нормальному сосудистому сплетению. Пренатально ПСС III и IV желудочков не выявляется.
Методом выбора терапии ПСС является хирургическое удаление опухоли. При доброкачественном характере процесса оперативное лечение может иметь благоприятный исход, однако операция технически сложна и сопровождается большой кровопотерей. При злокачественном поражении (более чем в 20% наблюдений) прогноз неблагоприятный. Смертность при ПСС достигает 35%, а у 72% выживших детей отмечаются различной степени выраженности дефекты психического и умственного развития.
Акушерская тактика: роды ведут через естественные родовые пути; применение влагалищных родоразрешающих операций противопоказано. Рекомендуется родоразрешение в крупных перинатальных центрах, где может быть оказана экстренная неонатологическая и детская нейрохирургическая помощь. Вопрос об использовании кесарева сечения с целью снижения риска родовой травмы с внутричерепным кровоизлиянием окончательно не решен.
. Дефекты нервной трубки объединяют группу пороков развития, включающую анэнцефалию, цефалоцеле и spina bifida.
Spina bifida (SB) (син. рахишиз, менингоцеле, миеломенингоцеле) — срединный дефект позвонков, сопровождающийся обнажением содержимого спинномозгового канала. В большинстве случаев дефекты затрагивают дорсальные дуги позвонков и не распространяются на их тела.
Spina bifida является наиболее частым пороком развития ЦН С и встречается в зависимости от географических, этнических и сезонных факторов с максимальной частотой 4,1 на 1000 родившихся. Спинальные дефекты редко встречаются в восточных странах и наиболее распространены среди лиц европейской популяции. Эта зависимость сохраняется, несмотря на миграцию, что свидетельствует в пользу генетических причин аномалии, а не факторов внешней среды.
SB наследуется по многофакторному типу и может быть частью:
а) многофакторным наследованием;
б) изолированным мутантным геном:
Как причину SB нельзя исключать тератогенное воздействие на плод в период органогенеза (в том числе вальпро- евая кислота, толидамид). Предрасполагающим фактором к развитию SB со стороны матери является сахарный диабет. Кроме того, spina bifida может составлять часть специфических фенотипов, причина которых не установлена (эк- строфия ануса и крестцово-копчиковая тератома).
Существует две теории происхождения дефектов нервной трубки. Согласно первой, основу аномалии составляет первичное нарушение процесса закрытия каудальной нейропоры. Вторая теория объясняет возникновение дефектов нервной трубки следующим образом: в результате дисбаланса между продукцией и реабсорбцией СМЖ происходит ее избыточное накопление в закрытой нервной трубке (гидромиелия) и вторичное расщепление дорсальной стенки. Отсутствие кожного и мышечного слоев непосредственно над дефектом обусловлено нарушением развития эктодермальной и мезодермальной тканей на этом участке.
К основным порокам развития, сочетающимся со БВ, относят другие аномалии ЦНС и деформацию стоп. Почти во всех случаях открытой БВ обнаруживается типичная патология задней черепной ямки — синдром Арнольда-Киари (червь мозжечка выбухает через большое затылочное отверстие, IV желудочек смещен внутрь нервного канала, задняя черепная ямка уменьшена в размерах, мозжечковый намет смещен книзу, дистопируется и перекручивается продолговатый мозг, что почти всегда сопровождается обструктивной гидроцефалией).
Пренатальная диагностика БВ сопряжена с определенными сложностями. Чувствительность ультразвуковой диагностики в группах риска составляет 80—94%, а специфичность — 98%.
Прогноз: частота мертворождения при БВ составляет 25%; большинство нелеченных новорожденных погибают в первые месяцы жизни; выживаемость пролеченных в раннем неонатальном периоде детей не превышает 40%, причем 25% из них остаются полностью парализованными, 25% — парализованными частично, 25% — нуждаются в интенсивной реабилитации и только 25% — не отмечают существенной дисфункции нижних конечностей. В целом прогноз зависит от уровня и степени поражения, наличия сопутствующих аномалий; наиболее благоприятен при сакральных поражениях, хотя последние встречаются лишь в 4% случаев.
Акушерская тактика. При выявлении патологии во II триместре необходимо ее прерывание. При поздней диагностике родоразрешение проводят в доношенном сроке. Показанием к досрочному родоразрешению является быстрое нарастание вентрикуломегалии и макрокрании. При родоразрешении через естественные родовые пути следует учитывать риск возможного инфицирования нервной ткани и травматизации дефекта.
Анэнцефалия (псевдоцефалия, экстракраниальная дисэн- цефалия) характеризуется отсутствием полушарий мозга и большей части свода черепа; имеется дефект лобной кости выше супраорбитальной области, височная и часть затылочной кости отсутствуют. Верхняя часть головы покрыта сосудистой мембраной, под которой можно обнаружить остатки полушарий. Структуры среднего и промежуточного мозга частично или полностью разрушены. Гипофиз и ромбовидная ямка в основном сохранены. К типичным проявлениям можно отнести и выпученные глаза, большой язык и очень короткую шею.
Эпидемиология анэнцефалии (АЭ) сходна с эпидемиологией spina bifida. Максимальная частота АЭ — 3,6 на 1000 родившихся. Чаще АЭ обнаруживается у новорожденных девочек.
АЭ относится к состояниям с многофакторной этиологией: мультифакторное и аутосомно-рецессивное (синдром Меккеле) наследование, хромосомные аномалии. К факторам риска со стороны матери относят сахарный диабет. В экспериментах на животных установлена тератогенность радиации, трипанового синего, салицилатов, сульфаниламидов, повышенного содержания углекислоты.
Происхождение анэнцефалии объясняется двумя теориями: 1) нарушением процесса закрытия передней нейропо- ры; 2) избыточным накоплением СМЖ, обусловливающим разрушение нормально сформированных полушарий мозга.
Анэнцефалия сочетается со spina bifida (17%), расщеплением твердого и мягкого нёба (2%) и косолапостью (1,7%). В ряде случаев АЭ сочетается с омфалоцеле.
Диагностика АЭ не представляет значительных трудностей: на эхограммах идентифицируют отсутствие контуров свода черепа. Причем вероятный диагноз может быть установлен уже в 12—13 недель беременности. Анэнцефалия сопровождается многоводием, что объясняется нарушением процесса глотания вследствие поражения ствола мозга, избыточным диурезом и нарушением процесса реабсорбЦИи СМЖ. Часто отмечается повышенная двигательная активность плода вследствие раздражения мягких мозговых оболочек и нервной ткани СМЖ.
Прогноз: смерть новорожденного в первые часы или дни жизни.
Акушерская тактика: беременность прерывают в любом
сроке.
Цефалоцеле (энцефалоцеле, краниальное или окципитальное менингоцеле, расщепление черепа) представляет выбухание содержимого черепной коробки через костный дефект. Термин «краниальное менингоцеле» правомочен при выпячивали через дефект только менингиальных оболочек. При нахождении в грыжевом мешке ткани мозга используют термин «энцефалоцеле».
Цефалоцеле встречается редко. Предполагается семейное наследование, так как аномалия часто сочетается с другими дефектами нервной трубки и нередко является компонентом многих генетических (синдромы Меккеле, срединного расщепления лица, Роберта) и негенетических (синдром амниотических перетяжек — множественные передние цефалоцеле, ампутация пальцев и конечностей, расщепление нёба) синдромов.
Основной механизм развития этого порока неизвестен. Предполагается, что избыточный рост ростральной порции нервной трубки нарушает процесс закрытия черепа. Кроме этого дефектможет быть результатом нарушения закрытия черепа мезодермой.
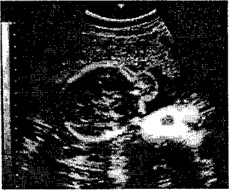
Рис. 3.' Беременность 21 нед. Обструктивная гидроцефалия
Цефалоцеле сочетается с другими пороками развития ЦНС- гидроцефалией (15 — 80%), spina bifida (5 — 17%), микроцефалией (20%).
Пренатальная диагностика цефалоцеле основана на визуализации в ходе эхографии паракраниального образования (рис. 3). Исследование амниотической жидкости позволяет обнаружить высокий уровень альфа-фетопротеина.
Прогноз при цефалоцеле зависит от присутствия ткани мозга в грыжевом мешке, наличия сопутствующих гидро- или микроцефалии. При энцефалоцеле смертность достигает 44%, при менингоцеле — не наблюдается. Нормальное интеллектуальное развитие регистрируется только у 9% детей с энцефалоцеле и у 60% — с менингоцеле. При сопутствующей микроцефалии большинство детей погибают, а у выживших — резко нарушен интеллект.
Акушерская тактика: при дефектах, несовместимых с
жизнью (например, синдром Меккеле), показано прерывание беременности в любом сроке.
Микроцефалия (микроэнцефалия) — клинический синдром, для которого типично уменьшение окружности головки на фоне неврологической симптоматики и умственной отсталости.
Микроцефалия встречается с частотой 1,6 на 1000 новорожденных. Только у 14% детей первого года жизни микроцефалия диагностируется при рождении.
Микроцефалия является полиэтиологическим заболеванием, в развитии которого определенная роль принадлежит как генетическим факторам (хромосомные аберрации, моногенные дефекты), так и факторам окружающей среды (пренатальные инфекции, химические и лекарственные вещества, фенилкетонурия у матери).
Диагностика микроцефалии в ранние сроки беременности в группах риска (отягощенный семейный анамнез) основывается на проведении кариотипирования плода (биопсия ворсин хориона, кордоцентез). Ультразвуковое сканирование позволяет обнаружить несоответствие величины окружности головки гестационному сроку и, тем самым, углубить поиск сочетанных аномалий.
Прогноз определяется тяжестью сочетанных аномалий. Трисомии 13 и 18, синдром Меккеле относят к фатальным
поражениям. При отсутствии сопутствующих аномалий прогноз зависит от размеров головки. Чем они меньше, тем ниже индекс интеллектуального развития. Микроцефалия относится к неизлечимым заболеваниям.
Акушерская тактика: показано прерывание беременно
сти.
Пороки развития почек и мочевыводящих путей. Поликистозная болезнь почек инфантильного типа (поликистозная болезнь почек I типа синдрома Поттер, аутосомно-рецес- сивное поликистозное заболевание почек) — двустороннее симметричное увеличение почек вследствие замещения паренхимы вторично расширенными собирательными канальцами без пролиферации соединительной ткани.
Заболевание встречается с частотой 2:110 000 новорожденных и наследуется по аутосомно-рецессивному типу. 0снову его составляет первичный дефект собирательных протоков. Почечная лоханка, чашечки и сосочки остаются при этом интактными, так как отсутствует дефект в мочеточниковом зачатке. Сочетанные аномалии встречаются редко.
Диагностика: при ультразвуковом исследовании обнаруживаются двустороннее увеличения почек на фоне малово- дия и отсутствие эхотени мочевого пузыря. Типичная гиперэхогенность почек сопровождается повышенной звукопроводимостью вследствие множественных микроскопических кистозных структур в почечной паренхиме.
Прогноз неблагоприятен. Смерть новорожденных наступает от почечной недостаточности.
Акушерская тактика: прерывание беременности в лю
бом сроке.
Поликистозная болезнь почек взрослого типа (аутосомно- доминантная болезнь, гепаторенальная поликистозная болезнь взрослого типа, III тип синдрома Поттер) характеризуется замещением паренхимы почки многочисленными кистами разных размеров, которые образуются вследствие расширения собирательных канальцев и других канальцевых сегментов нефрона. Кисты сосуществуют с интактной почечной тканью. Почки поражены с двух сторон и увеличены, но односторонний процесс может быть первым проявлением заболевания. Вовлечение в процесс печени наблюдается реже и выражается в перипортальном фиброзе, который носит очаговый характер.
Этиология неизвестна. Тип наследования обусловливает 50% риск развития болезни. Ее генетический фокус расположен в 16 паре хромосом.
Частота: один из 1000 человек носит мутантный ген; пенетрация гена происходит в 100% случаев, однако его экспрессивность может варьировать от тяжелых форм, приводящих к смерти в неонатальном периоде, до бессимптомных, обнаруживаемых на аутопсии.
Клинически поликистоз взрослого типа сочетается с кистозными изменениями печени, поджелудочной железы, селезенки, легких, яичников и придатков яичек.
Пренатальная диагностика может быть осуществлена путем биопсии ворсин хориона и исследования биоптата с использованием специального генетического зонда для обнаружения локуса мутантного гена. Описаны единичные наблюдения ультразвуковой диагностики данной патологии.
Прогноз: поликистоз почек относится к хроническим заболеваниям, первые симптомы его могут появиться в любом возрасте. Средний возраст начала клинических проявлений (боли в поясничной области, увеличение почек, почечная недостаточность и уремия) — 35 лет. Гипертензия регистрируется у 50—70% больных.
Акушерская тактика: родители из группы риска должны быть проинформированы о возможности диагностики патологии в I триместре беременности и прерывания беременности в ранние сроки; после достижения плодом жизнеспособности общепринята стандартная акушерская тактика .
Мультикистоз почек (мультикистозная болезнь почек, кистозное заболевание почек II тип синдрома Поттер, дис- пластическая болезнь почек) — врожденная почечная аномалия, проявляющаяся кистозным перерождением почечной паренхимы вследствие первичного расширения почечных канальцев. Процесс может носить двусторонний, односторонний и сегментарный характер.
Заболевание встречается в основном спорадически и может быть вторичным проявлением в составе других синдромов:
Двусторонний процесс встречается у одного их 10 ООО новорожденных. Односторонний процесс наблюдается в 2 раза чаще у новорожденных мужского пола.
Патогенетические механизмы болезни неизвестны. Предполагают, что эта сложная аномалия может быть результатом двух типов повреждений: недостаточности развития метанефральной бластемы, ответственной за формирование нефронов, и ранней обструктивной уропатии.
Односторонние поражения могут сочетаться с дефектами нервной трубки, диафрагмальной грыжей, расщеплением нёба, аномалиями ЖКТ.
Пренатальная диагностика основана на обнаружении при эхографии кистозно-измененных почек, недостаточной визуализации мочевого пузыря, даже после проведения теста с фуросемидом.
Прогноз: двусторонний процесс, в большинстве наблюдений, приводит к летальному исходу.
Акушерская тактика: при двустороннем процессе, диагностированном в ранние сроки беременности, рекомендуется прерывание беременности; односторонний процесс при нормальном кариотипе и без сочетанных аномалий не влияет на акушерскую тактику. Родоразрешение рекомендуется проводить в перинатальном центре.
Гидронефроз является результатом обструкции мочевыводящих путей в месте соединения почечной лоханки и мочеточника.
Частота его не установлена, так как аномалия представляет спорадический феномен. После рождения в 5 раз чаще диагностируется у лиц мужского пола.
У детей с обструкцией лоханочно-мочеточникового соединения в 27% случаев выявляются сочетанные аномалии мочевыводящих путей, в том числе пузырно-мочеточниковый рефлюкс, двустороннее удвоение мочеточников, двусторонний обструктивный мегауретер, нефункционирующая контралатеральная почка, агенезия контралатеральной
почки. В 19% — отмечаются аномалии других органов и систем.
Обструкцию лоханочно-мочеточникового соустья диагностируют с помощью эхографии, основываясь на обнаружении расширения почечной лоханки.
При одностороннем процессе прогноз благоприятный. Акушерская тактика зависит от времени обнаружения патологического процесса и степени нарушение функции почек.
Врожденные пороки сердца (ВПС). Частота врожденных пороков сердца составляет от 1—2 до 8—9 случаев на 1000 живорожденных.
ВПС в 90% являются результатом многофакторного повреждения (генетическая предрасположенность и средовые факторы). Риск повторения порока составляет 2 — 5% после рождения одного ребенка и 10—15% после рождения двух больных детей.
Моногенетическое наследование встречается не более чем у 1—2% детей. У 5% детей выявляются хромосомные аномалии, из которых ведущее место принадлежит трисо- миям. При различных типах трисомий ВПС (дефекты межжелудочковой и межпредсердной перегородок, открытый артериальный проток, стеноз легочной артерии) диагностируются с частотой от 40 до 99%. У 1—2% новорожденных отмечено влияние различных тератогенов.
Эхокардиографическое исследование плода представляет высокоинформативный метод пренатальной диагностики врожденных пороков сердца. Общепринятыми показаниями к эхокардиографическому исследованию плода являются:
1) со стороны матери:
2) со стороны плода:
Прогноз зависит от вида порока, наличия сопутствующих аномалий развития, в том числе хромосомных.
Акушерская тактика: после тщательного эхографическо
го изучения особенностей анатомии и топографии плода проводят хромосомный анализ амниотической жидкости; при выявлении ВПС до достижения плодом жизнеспособности показано прерывание беременности; в случае поздней диагностики (III триместр беременности) родоразре- шают при доношенном сроке в специализированных перинатальных центрах; сочетанные пороки сердца, сопутствующие экстракардиальные и генетические аномалии диктуют необходимость прерывания беременности в любом сроке.
Аномалии стенок брюшной полости и пороки развития желудочно-кишечного тракта. Диафрагмальная грыжа — перемещение органов брюшной полости в грудную полость через дефект диафрагмы. Выделяют заднелатеральную грыжу (тип Бохдалека), позадигрудинную грыжу (тип Морганьи) и релаксацию диафрагмы.
Тип Бохдалека встречается наиболее часто (85 — 90%), как правило, слева, что объясняется более ранним закрытием правого плевроперитонеального канала. Грыжевой мешок определяется только в 5—10% наблюдений. Содержимым грыжевого мешка в 90% случаев является тонкий кишечник, в 60% — желудок, в 54% — селезенка, в 56% — толстая кишка. Редко в нем обнаруживаются поджелудочная железа, печень, надпочечники и почки.
Грыжа Морганьи составляет только 1 —2% от всех диафрагмальных дефектов. Этот тип грыжи считают следствием недостаточности мышц в ходе образования поперечной перегородки. Обычно грыжевым содержимым является печень. Всегда присутствует перитонеальный мешок. Сердце может перемещаться в эпигастральную область.
Релаксация диафрагмы наблюдается у 5%. В патологический процесс вовлекается вся половина диафрагмы или ее часть. Нарушения могут быть объяснены недостаточностью мышц диафрагмы.
Частота диафрагмальной грыжи варьирует в пределах 0,033—0,05%, чаще встречается у девочек.
Врожденная диафрагмальная грыжа возникает спорадически или наследуется. Причины спорадических случаев неизвестны. Предполагается тератогенное воздействие следующих факторов: прием хинина, противоэпилептических препаратов, гиповитаминоз А. Семейные случаи имеют более высокую частоту среди лиц мужского пола, высокий процент двусторонних дефектов и низкую частоту сопутствующих пороков развития, угрожающих жизни.
Механизмы, приводящие к образованию диафрагмальной грыжи, остаются неуточненными. Существуют две основные гипотезы:
Врожденные диафрагмальные грыжи (ВДГ) с высокой
частотой сочетаются с другими аномалиями, исключая гипоплазию легких и незавершенный поворот кишечника, являющихся следствием самой грыжи. ВДГ следует рассматривать как часть врожденных аномалий с расщеплением, включая дефекты нервной трубки (анэнцефалия, цефа- лоцеле, spina bifida), расщепление губы и нёба, омфалоцеле, так как именно с ними диафрагмальная грыжа сочетается чаще всего. Из пороков сердечно-сосудистой системы ВДГ наиболее часто сопутствуют дефекты межжелудочковой перегородки и тетрада Фалло. Все типы ВДГ, за исключением релаксации диафрагмы, могут сопровождаться хромосомными аберрациями (как правило, трисомии).
Диагностика основана на визуализации во время эхографии грыжевых органов в грудной полости и смещения сердца в грудной клетке.
Прогноз неблагоприятный, частота мертворождения достигает 35%, причем у 90% из них выявляются летальные сочетанные аномалии ЦНС и сердечно-сосудистой системы. Подавляющее большинство детей умирает в первые часы жизни, из них 35% в течение первого часа после рож-
дения. У выживших до оперативного лечения детей уровень смертности колеблется от 29 до 53%. Выживаемость детей, оперированных в первые 24 часа жизни, приближается к 100%.
Акушерская тактика: при выявлении порока до дости
жения плодом жизнеспособности следует прервать беременность; родоразрешение при доношенной беременности проводят в крупных перинатальных центрах, где ребенку оказывают хирургическую помощь (в стадии экспериментальных исследований находится операция внутриутробной коррекции диафрагмальной грыжи).
Омфалоцеле (пупочная грыжа) — дефект передней брюшной стенки в области пупочного кольца с образованием грыжевого мешка с внутрибрюшным содержимым и покрытым амниоперитонеальной мембраной. Встречается изолированно и в составе пентады Кантрелла (срединный надпупочный дефект передней брюшной стенки, дефект нижней части грудины, недостаточность диафрагмальной части перикарда, недостаточность передней части диафрагмы и внутрисердечные аномалии) или синдрома Беквита— Видеманна (макроглоссия, висцеромегалия, омфалоцеле).
Омфалоцеле встречается с частотой 1:5130—5800 и является следствием недостаточности одного из четырех листков эктомезодермы при их слиянии на 3—4 неделе эмбриогенеза.
Трисомии сопутствуют омфалоцеле в 35 — 58% наблюдений, врожденные пороки сердца — в 47%, аномалии развития мочеполовой системы — в 40%, дефекты нервной трубки—в 39%. Аномалии ЖКТ могут носить как первичный, так и вторичный характер. Задержка внутриутробного развития диагностируется в 20% случаев.
Ультразвуковое сканирование позволяет диагностировать объемное образование, примыкающее к передней брюшной стенке и содержащее органы брюшной полости (петли кишечника, желудок и печень). Образование покрыто мембраной, которая связана с пуповиной, входящей в состав грыжевого мешка. Чувствительность определения альфа-фетопротеина в сыворотке крови беременной составляет 42%.
Прогноз зависит от типа сопутствующих аномалий. Перинатальные потери чаще связаны с ВПС, хромосомными аберрациями и недоношенностью. Небольшой дефект устраняется путем одноэтапной операции, при большом дефекте требуется многоэтапное хирургическое вмешательство, сопряженное с закрытием отверстия в передней брюшной стенке силиконовой или тефлоновой мембраной.
Акушерская тактика определяется сроком обнаружения порока, наличием сочетанных аномалий и хромосомных нарушений. При выявлении порока на ранних этапах беременности следует ее прервать. Выявление сопутствующих несовместимых с жизнью аномалий диктует необходимость прерывания беременности любого срока. При позднем выявлении изолированного омфалоцеле проводят динамическую эхографию и родоразрешение через естественные родовые пути.
Гастрошизис — дефект передней брюшной стенки в околопупочной области с эвентерацией петель кишечника, покрытых воспалительным экссудатом. У большинства новорожденных снижен уровень сывороточных белков, что указывает на хронический склерозирующий перитонит.
Частота гастрошизиса составляет 1:10 000—15 ООО. Аномалия встречается спорадически, однако отмечены наблюдения семейного заболевания с аутосомно-доминантным типом наследования.
Гастрошизис является результатом сосудистого компромисса пупочной вены или омфаломезентериальной артерии: преждевременная инволюция правой пупочной вены или разрыв дистального сегмента омфаломезентериальной артерии приводит к ишемии и формированию эктомезодер- мального дефекта.
Сочетанные аномалии редки, но в 25% наблюдений встречаются вторичные изменения в желудочно-кишечном тракте, являющиеся следствием сосудистых нарушений, — незавершенный поворот кишечника, атрезия или стеноз его отделов!
Пренатальная ультразвуковая диагностика гастрошизи- са основана на обнаружении прилежащих снаружи к передней брюшной стенке органов брюшной полости. Дефект обычно локализуется в правой параумбиликальной облас-
та, пуповина нормально соединяется с передней брюшной стенкой, грыжевые органы свободно свисают в амниотическую полость. Специфичность определения альфа-фетопротеина в сыворотке крови беременной составляет 77%.
Прогноз: уровень смертности колеблется в пределах 7— 28%, однако при расположении печени за пределами брюшной полости достигает 50%. Основное место в ст
Пороки центральной нервной системы. Классификация часто встречающихся пороков развития центральной нервной системы (ЦНС) может быть представлена следующим образом:
- Гидроцефалия:
а) стеноз водопровода мозга;
б) открытая гидроцефалия;
в) синдром Денди—Уокера.
- Папиллома сосудистого сплетения.
- Дефекты нервной трубки:
а) spina bifida;
б) анэнцефалия;
в) цефалоцеле.
- Микроцефалия.
Гидроцефалия встречается с частотой 0,3 — 0,8 на 1000 Живорожденных. В большинстве наблюдений врожденная гидроцефалия обусловлена обструкцией на одном из участков пути циркуляции спинномозговой жидкости (СМЖ). Нередко гидроцефалия сочетается с другими аномалиями: в 37% наблюдений ей сопутствует иная внутричерепная патология — гипоплазия мозолистого тела, цефалоцеле, артерио-венозные аномалии, арахноидальные кисты; внечерепные аномалии — в 63%. Среди последних следует отметить пороки развития почек (одно- и двусторонняя are-
незия и дисплазия), пороки сердца (дефект межжелудочковой перегородки, тетрада Фалло), менингомиелоцеле, расщепление верхней губы, твердого и мягкого нёба, агенезию ануса и толстой кишки, дисгенезию гонад, синдром Мек- келе. У 11% плодов обнаруживают хромосомные аномалии — трисомия по 21 паре, сбалансированные транслокации, мозаицизм.
Гидроцефалия представлена тремя основными формами:
- стеноз водопровода мозга;
- открытая гидроцефалия;
- синдром Денди—Уокера.
Стеноз водопровода мозга (СВМ) — форма обструктивной гидроцефалии, обусловленная сужением сильвиева водопровода. Удельная частота СВМ достигает 43%, соотношение детей мужского и женского пола составляет 1:8. Аномалия имеет полиэтиологический характер: генетические, инфекционные, тератогенные и опухолевые факторы, среди которых преобладают инфекционные (50%). В экспериментальных исследованиях подтверждена роль токсо- плазмоза, сифилиса, цитомегаловирусной инфекции, эпидемического паротита и гриппа.
В определенной части наблюдений причиной стеноза водопровода мозга является генетическая патология, которая может наследоваться по рецессивному типу, сцепленному с Х-хромосомой. Сцепленное с полом наследование относят к редким причинам СВМ, так как оно встречается с частотой 1 случай на 200 сибсов пробандов с гидроцефалией. Однако возможно, что такой тип наследования составляет 25% среди детей мужского пола. Предполагают, что глиома, менингиома, нейрофиброматоз и туберозный склероз приводят к стенозу водопровода за счет компрессионного механизма, а открытая гидроцефалия — в результате отека белого вещества и внешнего сдавления. Сочетанные аномалии встречаются у 16% детей.
Диагностика данной формы гидроцефалии основывается на обнаружении при ультразвуковом исследовании расширения боковых и III желудочков при неизмененных размерах IV желудочка. Необходимо проводить тщательное сканирование позвоночника плода для исключения сочетанных с полом аномалий (рис. 2).

Рис. 2. Беременность 21 нед.
Обструктивная гидроцефалия
Прогноз: смертность в детском возрасте колеблется в пределах 11 — 30%; интеллектуальное развитие может быть нормальным.
Акушерская тактика: до достижения плодом жизнеспособности показано прерывание беременности; при установлении диагноза в поздние сроки метод родоразрешения определяется исключительно акушерскими показаниями.
Открытая гидроцефалия (ОГ) — расширение желудочков мозга и его субарахноидальной системы в результате обструкции внежелудочковой системы путей оттока спинномозговой жидкости.
Открытая гидроцефалия является второй по частоте, на ее долю приходится 38% всех наблюдений гидроцефалии.- Этиология ОГ не уточнена. ОГ выявляется у детей со спинальными дефектами и облитерацией переднего сагиталь- ного синуса, субарахноидальными кровоизлияниями, папилломой сосудистого сплетения и отсутствием грануляций Паччиони. Субарахноидальное кровоизлияние служит наиболее частой причиной открытой гидроцефалии у новорожденных; в пренатальном периоде встречается крайне редко. Наследуется также редко, хотя частота повторяемости достигает 1—2%, что существенно выше, чем в общей популяции.
Патогенез: механическая обструкция внежелудочковой системы мозга и нарушение реабсорбции СМЖ приводят к расширению субарахноидального пространства, а затем и мозговых желудочков; внутренняя гидроцефалия развивается на фоне обструкции водопровода мозга, вследствие повышения внутричерепного давления.
Пренатальная диагностика ОГ осуществляется с помощью динамического ультразвукового сканирования. При этом патогномоничным признаком является расширение субарахноидальной цистерны.
Прогноз: уровень смертности достигает 11 %. У большинства выживших детей сохраняется нормальный интеллект. При сочетании ОГ с дефектами нервной трубки или папилломой сосудистого сплетения прогноз более неблагоприятный.
Акушерская тактика: в ранние сроки выявления ОГ показано прерывание беременности, при доношенной беременности роды ведут через естественные родовые пути.
Для синдрома Денди—Уокера типично сочетание следующих аномалий:
- гидроцефалия разной степени;
- кисты задней черепной ямки;
- дефекты червя мозжечка, через которые киста сообщается с полостью IV желудочка.
Синдром встречается у 12% детей с врожденной гидроцефалией. Этиология неизвестна. Этот синдром может быть одним из проявлений генетических заболеваний (синдромы Меккеля и Варбурга), а также выявляться и при хромосомных абберациях (синдром Тернера, 6р-, 9§Г1+, трисо- мия 9, триплоидия). В редких наблюдениях возможно наследование по аутосомно-рецессивному типу с риском повторения до 25%.
Патоэмбриогенез. Согласно теории Денди—Уокера, к расширению желудочковой системы обычно приводит атрезия отверстий Лушки и Мажанди. Синдром представляет сложную аномалию развития срединных структур головного мозга в области ромбовидной ямки. Гипоплазия червя мозжечка и кисты заднечерепной ямки возникают вторично, вследствие сдавления его резко расширенным IV желудочком. Имеет место и дисбаланс продукции спинно-
мозговой жидкости в боковых, III и IV желудочках. Дефект червя мозга варьирует от полной аплазии до небольшого расщепления. Несмотря на то, что гидроцефалия является основным диагностическим признаком синдрома Денди — Уокера, у большинства детей в момент рождения она отсутствует однако, проявляется в первые месяцы жизни ребенка.
Синдром нередко (более чем в 50% наблюдений) сочетается с другими пороками развития ЦНС (агенезия мозолистого тела, энцефалоцеле), пороками почек (поликистоз) и сердца (дефект межжелудочковой перегородки).
Диагностика: на данную аномалию указывает обнаружение во время эхографии кистозных образований в задней черепной ямке; патогномоничным акустическим признаком синдрома является дефект червя мозга, через который киста сообщается с IV желудочком.
Прогноз неблагоприятный: смертность достигает 50%, у 50—60% выживших детей отмечается отставание интеллектуального развития.
Акушерская тактика: в любом сроке производят прерывание беременности.
Папиллома сосудистого сплетения (ПСС). Внутричерепное новообразование встречается с частотой 0,6% от всех опухолей мозга, выявляемых у взрослых и 3% — у детей. Папиллома может локализоваться в любом отделе желудочковой системы, но чаще обнаруживается на уровне преддверия боковых желудочков. Характерна односторонняя локализация опухоли, хотя не исключается двусторонний процесс. Наиболее часто ПСС представлена тканью ворсин, гистологически сходной с тканью интактного сосудистого сплетения, и носит доброкачественный характер. Тем не менее, возможна малигнизация опухоли с прорастанием в смежную нервную ткань. Папиллома сосудистого сплетения обычно сочетается с гидроцефалией.
Этиология неизвестна. В мировой практике известны единичные наблюдения ПСС у больные •" синдромом Аикарди (данное заболевании сцеплено с Л фомосомой и характеризуется агенезией мозолистого тела, хориоретинальными лакунами, аномалиями позвоночника, эпилепсией и умственной отсталостью).
ПСС диагностируется у детей с гидроцефалией во время нейросонографии или рентгенологического исследова-
ния. В детском возрасте методом выбора следует считать контрастную компьютерную томографию. В качестве метода пренатальной диагностики наиболее информативным является ультразвуковое сканирование. Эхографическими критериями ПСС являются асимметрия формы и размеров контралатеральных желудочков, визуализация в преддверии боковых желудочков слабоэхогенных образований, примыкающих к нормальному сосудистому сплетению. Пренатально ПСС III и IV желудочков не выявляется.
Методом выбора терапии ПСС является хирургическое удаление опухоли. При доброкачественном характере процесса оперативное лечение может иметь благоприятный исход, однако операция технически сложна и сопровождается большой кровопотерей. При злокачественном поражении (более чем в 20% наблюдений) прогноз неблагоприятный. Смертность при ПСС достигает 35%, а у 72% выживших детей отмечаются различной степени выраженности дефекты психического и умственного развития.
Акушерская тактика: роды ведут через естественные родовые пути; применение влагалищных родоразрешающих операций противопоказано. Рекомендуется родоразрешение в крупных перинатальных центрах, где может быть оказана экстренная неонатологическая и детская нейрохирургическая помощь. Вопрос об использовании кесарева сечения с целью снижения риска родовой травмы с внутричерепным кровоизлиянием окончательно не решен.
. Дефекты нервной трубки объединяют группу пороков развития, включающую анэнцефалию, цефалоцеле и spina bifida.
Spina bifida (SB) (син. рахишиз, менингоцеле, миеломенингоцеле) — срединный дефект позвонков, сопровождающийся обнажением содержимого спинномозгового канала. В большинстве случаев дефекты затрагивают дорсальные дуги позвонков и не распространяются на их тела.
Spina bifida является наиболее частым пороком развития ЦН С и встречается в зависимости от географических, этнических и сезонных факторов с максимальной частотой 4,1 на 1000 родившихся. Спинальные дефекты редко встречаются в восточных странах и наиболее распространены среди лиц европейской популяции. Эта зависимость сохраняется, несмотря на миграцию, что свидетельствует в пользу генетических причин аномалии, а не факторов внешней среды.
SB наследуется по многофакторному типу и может быть частью:
- генетических синдромов:
а) многофакторным наследованием;
б) изолированным мутантным геном:
- синдром Меккеле (аутосомно-рецессивный тип наследования, в фенотипе затылочное энцефалоцеле, реже анэнцефалия);
- синдром переднего сакрального менингомиелоцеле и анального стеноза (доминантный аутосомный или сцепленный с Х-хромосомой тип наследования);
- синдром Jarco—Levin (аутосомно-рецессивный тип наследования, в фенотипе — энцефалоцеле);
- хромосомных аномалий:
- трисомия 13;
- трисомия 18;
- триплоидия;
- несбалансированная транслокация или кольцевая хромосома.
Как причину SB нельзя исключать тератогенное воздействие на плод в период органогенеза (в том числе вальпро- евая кислота, толидамид). Предрасполагающим фактором к развитию SB со стороны матери является сахарный диабет. Кроме того, spina bifida может составлять часть специфических фенотипов, причина которых не установлена (эк- строфия ануса и крестцово-копчиковая тератома).
Существует две теории происхождения дефектов нервной трубки. Согласно первой, основу аномалии составляет первичное нарушение процесса закрытия каудальной нейропоры. Вторая теория объясняет возникновение дефектов нервной трубки следующим образом: в результате дисбаланса между продукцией и реабсорбцией СМЖ происходит ее избыточное накопление в закрытой нервной трубке (гидромиелия) и вторичное расщепление дорсальной стенки. Отсутствие кожного и мышечного слоев непосредственно над дефектом обусловлено нарушением развития эктодермальной и мезодермальной тканей на этом участке.
К основным порокам развития, сочетающимся со БВ, относят другие аномалии ЦНС и деформацию стоп. Почти во всех случаях открытой БВ обнаруживается типичная патология задней черепной ямки — синдром Арнольда-Киари (червь мозжечка выбухает через большое затылочное отверстие, IV желудочек смещен внутрь нервного канала, задняя черепная ямка уменьшена в размерах, мозжечковый намет смещен книзу, дистопируется и перекручивается продолговатый мозг, что почти всегда сопровождается обструктивной гидроцефалией).
Пренатальная диагностика БВ сопряжена с определенными сложностями. Чувствительность ультразвуковой диагностики в группах риска составляет 80—94%, а специфичность — 98%.
Прогноз: частота мертворождения при БВ составляет 25%; большинство нелеченных новорожденных погибают в первые месяцы жизни; выживаемость пролеченных в раннем неонатальном периоде детей не превышает 40%, причем 25% из них остаются полностью парализованными, 25% — парализованными частично, 25% — нуждаются в интенсивной реабилитации и только 25% — не отмечают существенной дисфункции нижних конечностей. В целом прогноз зависит от уровня и степени поражения, наличия сопутствующих аномалий; наиболее благоприятен при сакральных поражениях, хотя последние встречаются лишь в 4% случаев.
Акушерская тактика. При выявлении патологии во II триместре необходимо ее прерывание. При поздней диагностике родоразрешение проводят в доношенном сроке. Показанием к досрочному родоразрешению является быстрое нарастание вентрикуломегалии и макрокрании. При родоразрешении через естественные родовые пути следует учитывать риск возможного инфицирования нервной ткани и травматизации дефекта.
Анэнцефалия (псевдоцефалия, экстракраниальная дисэн- цефалия) характеризуется отсутствием полушарий мозга и большей части свода черепа; имеется дефект лобной кости выше супраорбитальной области, височная и часть затылочной кости отсутствуют. Верхняя часть головы покрыта сосудистой мембраной, под которой можно обнаружить остатки полушарий. Структуры среднего и промежуточного мозга частично или полностью разрушены. Гипофиз и ромбовидная ямка в основном сохранены. К типичным проявлениям можно отнести и выпученные глаза, большой язык и очень короткую шею.
Эпидемиология анэнцефалии (АЭ) сходна с эпидемиологией spina bifida. Максимальная частота АЭ — 3,6 на 1000 родившихся. Чаще АЭ обнаруживается у новорожденных девочек.
АЭ относится к состояниям с многофакторной этиологией: мультифакторное и аутосомно-рецессивное (синдром Меккеле) наследование, хромосомные аномалии. К факторам риска со стороны матери относят сахарный диабет. В экспериментах на животных установлена тератогенность радиации, трипанового синего, салицилатов, сульфаниламидов, повышенного содержания углекислоты.
Происхождение анэнцефалии объясняется двумя теориями: 1) нарушением процесса закрытия передней нейропо- ры; 2) избыточным накоплением СМЖ, обусловливающим разрушение нормально сформированных полушарий мозга.
Анэнцефалия сочетается со spina bifida (17%), расщеплением твердого и мягкого нёба (2%) и косолапостью (1,7%). В ряде случаев АЭ сочетается с омфалоцеле.
Диагностика АЭ не представляет значительных трудностей: на эхограммах идентифицируют отсутствие контуров свода черепа. Причем вероятный диагноз может быть установлен уже в 12—13 недель беременности. Анэнцефалия сопровождается многоводием, что объясняется нарушением процесса глотания вследствие поражения ствола мозга, избыточным диурезом и нарушением процесса реабсорбЦИи СМЖ. Часто отмечается повышенная двигательная активность плода вследствие раздражения мягких мозговых оболочек и нервной ткани СМЖ.
Прогноз: смерть новорожденного в первые часы или дни жизни.
Акушерская тактика: беременность прерывают в любом
сроке.
Цефалоцеле (энцефалоцеле, краниальное или окципитальное менингоцеле, расщепление черепа) представляет выбухание содержимого черепной коробки через костный дефект. Термин «краниальное менингоцеле» правомочен при выпячивали через дефект только менингиальных оболочек. При нахождении в грыжевом мешке ткани мозга используют термин «энцефалоцеле».
Цефалоцеле встречается редко. Предполагается семейное наследование, так как аномалия часто сочетается с другими дефектами нервной трубки и нередко является компонентом многих генетических (синдромы Меккеле, срединного расщепления лица, Роберта) и негенетических (синдром амниотических перетяжек — множественные передние цефалоцеле, ампутация пальцев и конечностей, расщепление нёба) синдромов.
Основной механизм развития этого порока неизвестен. Предполагается, что избыточный рост ростральной порции нервной трубки нарушает процесс закрытия черепа. Кроме этого дефектможет быть результатом нарушения закрытия черепа мезодермой.

Рис. 3.' Беременность 21 нед. Обструктивная гидроцефалия
Цефалоцеле сочетается с другими пороками развития ЦНС- гидроцефалией (15 — 80%), spina bifida (5 — 17%), микроцефалией (20%).
Пренатальная диагностика цефалоцеле основана на визуализации в ходе эхографии паракраниального образования (рис. 3). Исследование амниотической жидкости позволяет обнаружить высокий уровень альфа-фетопротеина.
Прогноз при цефалоцеле зависит от присутствия ткани мозга в грыжевом мешке, наличия сопутствующих гидро- или микроцефалии. При энцефалоцеле смертность достигает 44%, при менингоцеле — не наблюдается. Нормальное интеллектуальное развитие регистрируется только у 9% детей с энцефалоцеле и у 60% — с менингоцеле. При сопутствующей микроцефалии большинство детей погибают, а у выживших — резко нарушен интеллект.
Акушерская тактика: при дефектах, несовместимых с
жизнью (например, синдром Меккеле), показано прерывание беременности в любом сроке.
Микроцефалия (микроэнцефалия) — клинический синдром, для которого типично уменьшение окружности головки на фоне неврологической симптоматики и умственной отсталости.
Микроцефалия встречается с частотой 1,6 на 1000 новорожденных. Только у 14% детей первого года жизни микроцефалия диагностируется при рождении.
Микроцефалия является полиэтиологическим заболеванием, в развитии которого определенная роль принадлежит как генетическим факторам (хромосомные аберрации, моногенные дефекты), так и факторам окружающей среды (пренатальные инфекции, химические и лекарственные вещества, фенилкетонурия у матери).
Диагностика микроцефалии в ранние сроки беременности в группах риска (отягощенный семейный анамнез) основывается на проведении кариотипирования плода (биопсия ворсин хориона, кордоцентез). Ультразвуковое сканирование позволяет обнаружить несоответствие величины окружности головки гестационному сроку и, тем самым, углубить поиск сочетанных аномалий.
Прогноз определяется тяжестью сочетанных аномалий. Трисомии 13 и 18, синдром Меккеле относят к фатальным
поражениям. При отсутствии сопутствующих аномалий прогноз зависит от размеров головки. Чем они меньше, тем ниже индекс интеллектуального развития. Микроцефалия относится к неизлечимым заболеваниям.
Акушерская тактика: показано прерывание беременно
сти.
Пороки развития почек и мочевыводящих путей. Поликистозная болезнь почек инфантильного типа (поликистозная болезнь почек I типа синдрома Поттер, аутосомно-рецес- сивное поликистозное заболевание почек) — двустороннее симметричное увеличение почек вследствие замещения паренхимы вторично расширенными собирательными канальцами без пролиферации соединительной ткани.
Заболевание встречается с частотой 2:110 000 новорожденных и наследуется по аутосомно-рецессивному типу. 0снову его составляет первичный дефект собирательных протоков. Почечная лоханка, чашечки и сосочки остаются при этом интактными, так как отсутствует дефект в мочеточниковом зачатке. Сочетанные аномалии встречаются редко.
Диагностика: при ультразвуковом исследовании обнаруживаются двустороннее увеличения почек на фоне малово- дия и отсутствие эхотени мочевого пузыря. Типичная гиперэхогенность почек сопровождается повышенной звукопроводимостью вследствие множественных микроскопических кистозных структур в почечной паренхиме.
Прогноз неблагоприятен. Смерть новорожденных наступает от почечной недостаточности.
Акушерская тактика: прерывание беременности в лю
бом сроке.
Поликистозная болезнь почек взрослого типа (аутосомно- доминантная болезнь, гепаторенальная поликистозная болезнь взрослого типа, III тип синдрома Поттер) характеризуется замещением паренхимы почки многочисленными кистами разных размеров, которые образуются вследствие расширения собирательных канальцев и других канальцевых сегментов нефрона. Кисты сосуществуют с интактной почечной тканью. Почки поражены с двух сторон и увеличены, но односторонний процесс может быть первым проявлением заболевания. Вовлечение в процесс печени наблюдается реже и выражается в перипортальном фиброзе, который носит очаговый характер.
Этиология неизвестна. Тип наследования обусловливает 50% риск развития болезни. Ее генетический фокус расположен в 16 паре хромосом.
Частота: один из 1000 человек носит мутантный ген; пенетрация гена происходит в 100% случаев, однако его экспрессивность может варьировать от тяжелых форм, приводящих к смерти в неонатальном периоде, до бессимптомных, обнаруживаемых на аутопсии.
Клинически поликистоз взрослого типа сочетается с кистозными изменениями печени, поджелудочной железы, селезенки, легких, яичников и придатков яичек.
Пренатальная диагностика может быть осуществлена путем биопсии ворсин хориона и исследования биоптата с использованием специального генетического зонда для обнаружения локуса мутантного гена. Описаны единичные наблюдения ультразвуковой диагностики данной патологии.
Прогноз: поликистоз почек относится к хроническим заболеваниям, первые симптомы его могут появиться в любом возрасте. Средний возраст начала клинических проявлений (боли в поясничной области, увеличение почек, почечная недостаточность и уремия) — 35 лет. Гипертензия регистрируется у 50—70% больных.
Акушерская тактика: родители из группы риска должны быть проинформированы о возможности диагностики патологии в I триместре беременности и прерывания беременности в ранние сроки; после достижения плодом жизнеспособности общепринята стандартная акушерская тактика .
Мультикистоз почек (мультикистозная болезнь почек, кистозное заболевание почек II тип синдрома Поттер, дис- пластическая болезнь почек) — врожденная почечная аномалия, проявляющаяся кистозным перерождением почечной паренхимы вследствие первичного расширения почечных канальцев. Процесс может носить двусторонний, односторонний и сегментарный характер.
Заболевание встречается в основном спорадически и может быть вторичным проявлением в составе других синдромов:
- аутосомно-рецессивных (синдром Меккеля, Денди — Уокера, Робертса, Смита—Лемли—Опица и др.);
- аутосомно-доминантных (синдром Апера);
- хромосомных нарушений.
Двусторонний процесс встречается у одного их 10 ООО новорожденных. Односторонний процесс наблюдается в 2 раза чаще у новорожденных мужского пола.
Патогенетические механизмы болезни неизвестны. Предполагают, что эта сложная аномалия может быть результатом двух типов повреждений: недостаточности развития метанефральной бластемы, ответственной за формирование нефронов, и ранней обструктивной уропатии.
Односторонние поражения могут сочетаться с дефектами нервной трубки, диафрагмальной грыжей, расщеплением нёба, аномалиями ЖКТ.
Пренатальная диагностика основана на обнаружении при эхографии кистозно-измененных почек, недостаточной визуализации мочевого пузыря, даже после проведения теста с фуросемидом.
Прогноз: двусторонний процесс, в большинстве наблюдений, приводит к летальному исходу.
Акушерская тактика: при двустороннем процессе, диагностированном в ранние сроки беременности, рекомендуется прерывание беременности; односторонний процесс при нормальном кариотипе и без сочетанных аномалий не влияет на акушерскую тактику. Родоразрешение рекомендуется проводить в перинатальном центре.
Гидронефроз является результатом обструкции мочевыводящих путей в месте соединения почечной лоханки и мочеточника.
Частота его не установлена, так как аномалия представляет спорадический феномен. После рождения в 5 раз чаще диагностируется у лиц мужского пола.
У детей с обструкцией лоханочно-мочеточникового соединения в 27% случаев выявляются сочетанные аномалии мочевыводящих путей, в том числе пузырно-мочеточниковый рефлюкс, двустороннее удвоение мочеточников, двусторонний обструктивный мегауретер, нефункционирующая контралатеральная почка, агенезия контралатеральной
почки. В 19% — отмечаются аномалии других органов и систем.
Обструкцию лоханочно-мочеточникового соустья диагностируют с помощью эхографии, основываясь на обнаружении расширения почечной лоханки.
При одностороннем процессе прогноз благоприятный. Акушерская тактика зависит от времени обнаружения патологического процесса и степени нарушение функции почек.
Врожденные пороки сердца (ВПС). Частота врожденных пороков сердца составляет от 1—2 до 8—9 случаев на 1000 живорожденных.
ВПС в 90% являются результатом многофакторного повреждения (генетическая предрасположенность и средовые факторы). Риск повторения порока составляет 2 — 5% после рождения одного ребенка и 10—15% после рождения двух больных детей.
Моногенетическое наследование встречается не более чем у 1—2% детей. У 5% детей выявляются хромосомные аномалии, из которых ведущее место принадлежит трисо- миям. При различных типах трисомий ВПС (дефекты межжелудочковой и межпредсердной перегородок, открытый артериальный проток, стеноз легочной артерии) диагностируются с частотой от 40 до 99%. У 1—2% новорожденных отмечено влияние различных тератогенов.
Эхокардиографическое исследование плода представляет высокоинформативный метод пренатальной диагностики врожденных пороков сердца. Общепринятыми показаниями к эхокардиографическому исследованию плода являются:
1) со стороны матери:
- наличие врожденных пороков сердца у членов семьи;
- диабет;
- прием лекарственных препаратов в период органот генеза;
- алкоголизм;
- системная красная волчанка;
- фенилкетонурия;
2) со стороны плода:
- многоводие;
- неиммунная водянка;
- дизаритмии;
- экстракардиальные пороки;
- хромосомные нарушения;
- симметричная форма внутриутробной задержки развития.
Прогноз зависит от вида порока, наличия сопутствующих аномалий развития, в том числе хромосомных.
Акушерская тактика: после тщательного эхографическо
го изучения особенностей анатомии и топографии плода проводят хромосомный анализ амниотической жидкости; при выявлении ВПС до достижения плодом жизнеспособности показано прерывание беременности; в случае поздней диагностики (III триместр беременности) родоразре- шают при доношенном сроке в специализированных перинатальных центрах; сочетанные пороки сердца, сопутствующие экстракардиальные и генетические аномалии диктуют необходимость прерывания беременности в любом сроке.
Аномалии стенок брюшной полости и пороки развития желудочно-кишечного тракта. Диафрагмальная грыжа — перемещение органов брюшной полости в грудную полость через дефект диафрагмы. Выделяют заднелатеральную грыжу (тип Бохдалека), позадигрудинную грыжу (тип Морганьи) и релаксацию диафрагмы.
Тип Бохдалека встречается наиболее часто (85 — 90%), как правило, слева, что объясняется более ранним закрытием правого плевроперитонеального канала. Грыжевой мешок определяется только в 5—10% наблюдений. Содержимым грыжевого мешка в 90% случаев является тонкий кишечник, в 60% — желудок, в 54% — селезенка, в 56% — толстая кишка. Редко в нем обнаруживаются поджелудочная железа, печень, надпочечники и почки.
Грыжа Морганьи составляет только 1 —2% от всех диафрагмальных дефектов. Этот тип грыжи считают следствием недостаточности мышц в ходе образования поперечной перегородки. Обычно грыжевым содержимым является печень. Всегда присутствует перитонеальный мешок. Сердце может перемещаться в эпигастральную область.
Релаксация диафрагмы наблюдается у 5%. В патологический процесс вовлекается вся половина диафрагмы или ее часть. Нарушения могут быть объяснены недостаточностью мышц диафрагмы.
Частота диафрагмальной грыжи варьирует в пределах 0,033—0,05%, чаще встречается у девочек.
Врожденная диафрагмальная грыжа возникает спорадически или наследуется. Причины спорадических случаев неизвестны. Предполагается тератогенное воздействие следующих факторов: прием хинина, противоэпилептических препаратов, гиповитаминоз А. Семейные случаи имеют более высокую частоту среди лиц мужского пола, высокий процент двусторонних дефектов и низкую частоту сопутствующих пороков развития, угрожающих жизни.
Механизмы, приводящие к образованию диафрагмальной грыжи, остаются неуточненными. Существуют две основные гипотезы:
- нарушение слияния диафрагмы;
- первичный диафрагмальный дефект.
Врожденные диафрагмальные грыжи (ВДГ) с высокой
частотой сочетаются с другими аномалиями, исключая гипоплазию легких и незавершенный поворот кишечника, являющихся следствием самой грыжи. ВДГ следует рассматривать как часть врожденных аномалий с расщеплением, включая дефекты нервной трубки (анэнцефалия, цефа- лоцеле, spina bifida), расщепление губы и нёба, омфалоцеле, так как именно с ними диафрагмальная грыжа сочетается чаще всего. Из пороков сердечно-сосудистой системы ВДГ наиболее часто сопутствуют дефекты межжелудочковой перегородки и тетрада Фалло. Все типы ВДГ, за исключением релаксации диафрагмы, могут сопровождаться хромосомными аберрациями (как правило, трисомии).
Диагностика основана на визуализации во время эхографии грыжевых органов в грудной полости и смещения сердца в грудной клетке.
Прогноз неблагоприятный, частота мертворождения достигает 35%, причем у 90% из них выявляются летальные сочетанные аномалии ЦНС и сердечно-сосудистой системы. Подавляющее большинство детей умирает в первые часы жизни, из них 35% в течение первого часа после рож-
дения. У выживших до оперативного лечения детей уровень смертности колеблется от 29 до 53%. Выживаемость детей, оперированных в первые 24 часа жизни, приближается к 100%.
Акушерская тактика: при выявлении порока до дости
жения плодом жизнеспособности следует прервать беременность; родоразрешение при доношенной беременности проводят в крупных перинатальных центрах, где ребенку оказывают хирургическую помощь (в стадии экспериментальных исследований находится операция внутриутробной коррекции диафрагмальной грыжи).
Омфалоцеле (пупочная грыжа) — дефект передней брюшной стенки в области пупочного кольца с образованием грыжевого мешка с внутрибрюшным содержимым и покрытым амниоперитонеальной мембраной. Встречается изолированно и в составе пентады Кантрелла (срединный надпупочный дефект передней брюшной стенки, дефект нижней части грудины, недостаточность диафрагмальной части перикарда, недостаточность передней части диафрагмы и внутрисердечные аномалии) или синдрома Беквита— Видеманна (макроглоссия, висцеромегалия, омфалоцеле).
Омфалоцеле встречается с частотой 1:5130—5800 и является следствием недостаточности одного из четырех листков эктомезодермы при их слиянии на 3—4 неделе эмбриогенеза.
Трисомии сопутствуют омфалоцеле в 35 — 58% наблюдений, врожденные пороки сердца — в 47%, аномалии развития мочеполовой системы — в 40%, дефекты нервной трубки—в 39%. Аномалии ЖКТ могут носить как первичный, так и вторичный характер. Задержка внутриутробного развития диагностируется в 20% случаев.
Ультразвуковое сканирование позволяет диагностировать объемное образование, примыкающее к передней брюшной стенке и содержащее органы брюшной полости (петли кишечника, желудок и печень). Образование покрыто мембраной, которая связана с пуповиной, входящей в состав грыжевого мешка. Чувствительность определения альфа-фетопротеина в сыворотке крови беременной составляет 42%.
Прогноз зависит от типа сопутствующих аномалий. Перинатальные потери чаще связаны с ВПС, хромосомными аберрациями и недоношенностью. Небольшой дефект устраняется путем одноэтапной операции, при большом дефекте требуется многоэтапное хирургическое вмешательство, сопряженное с закрытием отверстия в передней брюшной стенке силиконовой или тефлоновой мембраной.
Акушерская тактика определяется сроком обнаружения порока, наличием сочетанных аномалий и хромосомных нарушений. При выявлении порока на ранних этапах беременности следует ее прервать. Выявление сопутствующих несовместимых с жизнью аномалий диктует необходимость прерывания беременности любого срока. При позднем выявлении изолированного омфалоцеле проводят динамическую эхографию и родоразрешение через естественные родовые пути.
Гастрошизис — дефект передней брюшной стенки в околопупочной области с эвентерацией петель кишечника, покрытых воспалительным экссудатом. У большинства новорожденных снижен уровень сывороточных белков, что указывает на хронический склерозирующий перитонит.
Частота гастрошизиса составляет 1:10 000—15 ООО. Аномалия встречается спорадически, однако отмечены наблюдения семейного заболевания с аутосомно-доминантным типом наследования.
Гастрошизис является результатом сосудистого компромисса пупочной вены или омфаломезентериальной артерии: преждевременная инволюция правой пупочной вены или разрыв дистального сегмента омфаломезентериальной артерии приводит к ишемии и формированию эктомезодер- мального дефекта.
Сочетанные аномалии редки, но в 25% наблюдений встречаются вторичные изменения в желудочно-кишечном тракте, являющиеся следствием сосудистых нарушений, — незавершенный поворот кишечника, атрезия или стеноз его отделов!
Пренатальная ультразвуковая диагностика гастрошизи- са основана на обнаружении прилежащих снаружи к передней брюшной стенке органов брюшной полости. Дефект обычно локализуется в правой параумбиликальной облас-
та, пуповина нормально соединяется с передней брюшной стенкой, грыжевые органы свободно свисают в амниотическую полость. Специфичность определения альфа-фетопротеина в сыворотке крови беременной составляет 77%.
Прогноз: уровень смертности колеблется в пределах 7— 28%, однако при расположении печени за пределами брюшной полости достигает 50%. Основное место в ст
А так же в разделе « ВРОЖДЕННЫЕ ПОРОКИ РАЗВИТИЯ ПЛОДА »
- Методы оценки сердечной деятельности плода
- Определение биофизического профиля плода.
- Инвазивные методы пренатальной диагностики.
- ГЕСТОЗЫ
- ДЕКОМПЕНСИРОВАННАЯ ФОРМА ПЛАЦЕНТАРНОЙ НЕДОСТАТОЧНОСТИ
- КЛИНИЧЕСКИ УЗКИЙ ТАЗ
- АКУШЕРСКАЯ ТАКТИКА, ИНТЕНСИВНАЯ ТЕРАПИЯ И ПРОФИЛАКТИКА КРОВОТЕЧЕНИЯ В ПОСЛЕДОВОМ И РАННЕМ ПОСЛЕРОДОВОМ ПЕРИОДАХ
- ЭФФЕРЕНТНЫЕ МЕТОДЫ ЛЕЧЕНИЯ В АКУШЕРСТВЕ
- Эфферентные методы в лечении гестозов у беременных
- Эфферентные методы в лечении гнойных септических заболеваний
- Эфферентные методы лечения при вирусных инфекциях у беременных
- Эфферентные методы лечения при иммунологическом конфликте
- Эфферентные методы при антифосфолипидном синдроме в акушерстве
- ВНУТРИУТРОБНЫЕ ИНФЕКЦИИ
- Особенности отдельных нозологических форм внутриутробных инфекций
- КЕСАРЕВО СЕЧЕНИЕ В СОВРЕМЕННОМ АКУШЕРСТВЕ
- СЕПТИЧЕСКИЕ ОСЛОЖНЕНИЯ КЕСАРЕВА СЕЧЕНИЯ
- НЕЙРОГУМОРАЛЬНАЯ РЕГУЛЯЦИЯ МЕНСТРУАЛЬНОГО ЦИКЛА
- ФИЗИОЛОГИЯ репродуктивной системы
- Нейрогуморальная регуляция менструального цикла
- Роль простагландинов в регуляции репродуктивной системы
- ГНОЙНЫЕ ВОСПАЛИТЕЛЬНЫЕ ЗАБОЛЕВАНИЯ ПРИДАТКОВ МАТКИ
- Патогенетические механизмы инфицирования внутренних половых органов.
- Этиологическая структура гнойных воспалительных заболеваний придатков матки.
- Патогенез гнойных воспалительных заболеваний придатков матки.
- Принципы и методы лечения гнойных воспалительных заболеваний придатков матки.
- Иммунокорригирующая терапия.
- ЗАБОЛЕВАНИЯ, ПЕРЕДАВАЕМЫЕ ПОЛОВЫМ ПУТЕМ (ЗППП)
- ГИПЕРПЛАСТИЧЕСКИЕ ПРОЦЕССЫ ЭНДОМЕТРИЯ
- МИОМА МАТКИ
- Патогенез миомы матки
- Классификация.
- Клиника.
- Осложнения.
- Онкологическая настороженность.
- Основные критерии.
- Дифференциальная диагностика.
- ГЕНИТАЛЬНЫЙ ЭНДОМЕТРИОЗ