Антагонисты стрихниннечувствительного глицинового рецептора
Еще несколько лет назад перспективы применения антагонистов глициновых рецепторов были весьма неопределенными из-за трудностей, связанных с плохим проникновением через гематоэнцефалический барьер. Однако на настоящий момент уже известно несколько глициновых антагонистов, которые имеют улучшенный фармакокинетический профиль, и предварительные данные подтвердили их хороший терапевтический индекс при системном введении (Danysz, Parsons, 1998).
Глициновые антагонисты — гетерогенная по химическому строению группа веществ (рис. 1.5; производные кинуреновои кислоты, хинолоны, хиноксалин-2,3-дио- ны, бензазегшн-2,5-дионы, трициклические соединения).
С точки зрения взаимодействия с подтипами NMDA-рецепторов глициновые антагонисты также не являются однородным классом, так как отдельные представители могут предпочтительно связываться с рецепторами, содержащими ту или иную субъединицу NMDAR2 (Woodward et al, 1995; Priestley et al, 1996 и др.). Особый интерес вызывает тот факт, что большинство известных глициновых антагонистов имеет низкое сродство кNMDAR2D-peuenTopaM, в то время как агонисты лучше всего связываются именно с этим подтипом. Избирательность взаимодействия с подтипами NMDA-рецепторов может в значительной мере определить клиническую эффективность вещества. Например, GV-150256, разрабатываемое фирмой Glaxo Wellcome для применения при инсультах, обладает исключительно благоприятным спектром психотропной активности и не вызывает побочных эффектов, что связывают с селективным воздействием на конкретные (еще не установлены) подтипы NMDA-рецепторов (Parsons et al., 1998, с. 551).

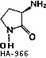
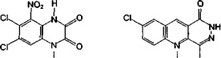
Уже отмечалось (см. гл. 1.6), что кинуреиовая кислота является эндогенным антагонистом стрихниннечувствительного глицинового рецептора. Этот факт лежал в основе многих направлений поиска экспериментального фармакологического воздействия на глициновый участок NMDA-рецепторного комплекса (см., например, табл. 1.7). Во-первых, направленный синтез и исследования связи структура-активность в ряду аналогов кинуреновои кислоты позволили выявить несколько селективных глициновых антагонистов (например 7-хлоркинуреновая кислота). Во-вторых, по-прежнему привлекательной представляется возможность модуляции баланса эндогенных агонистов и антагонистов за счет повышения концентрации кинуреновои кислоты или ее аналогов. Это может быть достигнуто двумя способами: введением пролекарств или посредством вмешательства в метаболизм кинуренинов. Пролекарства представляют собой эфиры или амиды1 производных кинуреновои кислоты, ко-
Таблица 1.7. Антагонисты глицинового участка NMDA-рецепторного комплекса
|
Название вещества |
Предполагаемое применение |
Компания- разработчик |
Этап исследования |
|
|
АСЕА-1021 (ликостинел) |
Инсульт Травма' Боль |
CoCensys |
iii I И |
|
|
D-Циклосерин2 |
Деменции |
Searle |
II- |
-П |
|
GV-150526 |
Инсульт |
Glaxo Wellcome |
III |
|
|
АСРС2 |
Инсульт, депрессия |
Symphony |
I |
|
|
ZD-9379 |
Инсульт, боль |
Zeneca |
II |
|
|
4-Кинуренин3 |
Б-нь Гентингтона |
Университет штата Мериленд |
П |
|
|
7-Хлортиокинуреновая кислота |
Нейропротекция |
Fidia |
П |
|
|
Фелбамат4 |
Эпилепсия |
Carter-Wallace |
И- |
- прекращено |
|
GV-196771A |
Хроническая боль |
Glaxo Wellcome |
I |
|
|
L-701252 |
Эпилепсия |
Merck |
П - |
- прекращено |
|
L-701324 |
Нейропротекция, боль, нейролепсия |
Merck |
П - |
- прекращено |
|
М-244249 |
Инсульт |
Zeneca |
П - |
- прекращено |
|
М-241247 |
Инсульт |
Zeneca |
П - |
- прекращено |
|
MDL-29951 |
Нейропротекция |
Hoechst Marion Roussel |
П |
|
|
MDL-100748 |
Эпилепсия |
Hoechst Marion Roussel |
П |
|
|
SM-18400 |
Инсульт, эпилепсия |
Sumimoto |
П |
|
|
FCE-2883A (PNU-156561A)5 |
Нейропротекция |
Pharmacia amp; Upjohn |
П |
|
|
Индол-3-пируват6 |
Анксиолитик? |
Polifarma |
П |
|
I-III — фазы клинических испытаний; П — доклинические исследования; И — используется в клинической практике
1 Травма головного мозга. 2 Частичный агонист. 3 Пролекарство.
- Последние данные указывают на другой механизм действия — блокаду канала, ассоциированного с NMDA-рецептором (Subramamam eta l., 1995).
- Ингибитор кинуренингидроксилазы.
- Кето-аналог триптофана (смещение баланса кинуренат-хинолинат в сторону кинуреновой кислоты).
торые характеризуются значительно улучшенной липофильностыо, или вещества, продуктом метаболизма которых являются высокоаффинные антагонисты глициновых рецепторов (например 4-хлоркинуренинл7-хлоркинуреновая кислота).
В то же время повышение концентрации эндогенной кинуреновой кислоты может быть вызвано введением ингибиторов синтеза хинолиновой кислоты (фермент —
кинуренин-3-гидроксилаза). Эти ингибиторы снижают концентрацию эндогенного агониста хинолиновой кислоты, повышая при этом концентрацию кинуреновой кислоты за счет облегчения альтернативных путей метаболизма (кинуренинамино- трансферазный путь; см. гл. 1.6).
Другим перспективным направлением, связанным с модуляцией стрихнин- нечувствителыюго глицинового рецептора, является разработка частичных агонистов этих рецепторов. Концепция "частичного агонизма" была разработана более 40 лет назад (см. обзор Jasper, 1992), и возможности применения частичных агонистов основываются на бимодальном действии этих веществ. С одной стороны, частичные агонисты повышают стимуляцию рецепторов в тех регионах мозга, где концентрации эндогенных агонистов снижены. С другой стороны, частичные агонисты защищают рецепторы от избыточной стимуляции в областях с повышенной концентрацией эндогенных агонистов, но при этом сохраняют возможность осуществления физиологических функций. Интересно, что первым обнаруженным относительно селективным антагонистом глициновых рецепторов было вещество НА-966, которое впоследствии оказалось частичным агонистом.
Основным преимуществом полных антагонистов перед агонистами-антагониста- ми является то, что полные антагонисты в большей степени способны "восстанавливать" глицинзависимую форму десенситизации NMDA-рецепторов, запускаемую глутаматом и тормозимую глицином. Например, в условиях ишемии нервной ткани повышается внеклеточная концентрация не только глутамата, но и глицина. Повышение концентрации глицина не столь выражено, как для глутамата, но зато сохраняется в течение значительно большего периода времени (Globus et al., 1991).
Физиологический смысл десенситизации состоит в том, чтобы предотвратить нейротоксические эффекты длительной стимуляции NMDA-рецепторов (вследствие высвобождения глутамата), но при этом не нарушать процессы, запускаемые краткосрочной преходящей стимуляцией. Учитывая тот факт, что глицинзависимая десенситизация — более медленный процесс (300-500 мс), чем синаптическая активация NMDA-рецепторов (100-200 мс; Clements et al., 1992), можно предположить, что глициновые антагонисты будут избирательно угнетать эффекты длительной стимуляции NMDA-рецепторов (например при ишемии) и оказывать меньшее влияние на возбуждающие постсинаптические потенциалы.
Возможно, что благодаря влиянию на глицинзависимую десенситизацию глициновые антагонисты могут различать отдельные формы синаптической пластичности — более быстрые (память и обучение в классическом понимании) и более медленные (например лекарственная толерантность и зависимость, хронические болевые синдромы).
Источник: Беспалов А. Ю., Звартау Э. Э., «Нейропсихофармакология антагонистов NMDA-рецепторов» 2000
А так же в разделе «Антагонисты стрихниннечувствительного глицинового рецептора »
- Кальций
- Протеинкиназы
- Арахидоновая кислота
- Оксид азота (N0)
- Эндогенные лиганды
- Возможные причины патологической активности NMDA-рецепторного комплекса
- Классификация антагонистов NMDA-рецепторов
- Конкурентные антагонисты NMDA-рецепторов
- Блокаторы канала, ассоциированного с NMDA-рецептором
- Антагонисты полиаминового рецептора