Иммунологические взаимоотношения матери и плода
Плод генетически, а следовательно и иммунологически, чужероден организму матери из-за наличия в его геноме отцовских генов. Таким образом, он фактически представляет аллотрансплантат, который в соответствии с законами иммунологии должен быть отторгнут. Однако сам факт существования плацентарных животных свидетельствует о том, что в данном случае непреложные законы иммунологии каким-то образом удается обойти. Более того, судя по осложнениям, возникающим при беременности сингенным плодом (такое возможно в экспериментах с генетически чистыми линиями животных), генетические различия матери и плода даже благоприятствуют нормальному развитию беременности.
Различия между матерью и плодом по генам гистосовместимости играют важную роль, о чем свидетельствуют данные о зависимости размера плаценты от степени таких различий. При развитии сингенного плода плацента имеет минимальный объем, по мере усиления различий по генам гистосовместимости ее размер увеличивается, а при предварительной иммунизации самки антигенами полового партнера размер плаценты плода превышают нормальный.
Предположение о слабой экспрессии в тканях плода антигенов гистосовместимости в силу «иммунологической незрелости» было довольно быстро отвергнуто, поскольку обнаружено, что в тканях плода антигены MHC экспрессируются уже на ранних стадиях эмбриогенеза. В конечном счете общепринятым стало представление о плоде как своеобразном иммунологически привилегированном органе. Природа этой привилегированности до сих пор до конца не раскрыта, но очевидно, что она совершенно уникальна, хотя и полностью вписывается в известные иммунологические закономерности. В значительной степени привилегированное положение плода обусловлено структурой плаценты и наличием или отсутствием в ней иммунологически значимыми факторов (рис. 4.19).
Особенности экспрессии антигенов гистосовместимости в трофобласте
Одним из важнейших механизмов защиты плода от атак со стороны иммунной системы матери признают наличие барьера в виде трофобласта (части плаценты, относящейся к организму плода), не экспрессирующего молекулы MHC. Отсутствие в нем молекул MHC-II не вызывает удивления, поскольку их тканевое распределение ограничено. Однако молекулы MHC-I экспресируются всеми ядросодержащими клетками организма, и их отсутствие на клетках трофобласта привлекает особое внимание.
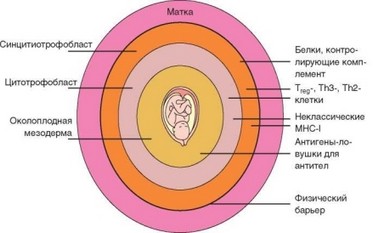
Рис. 4.19. Факторы, противостоящие отторжению плода, в оболочках плаценты. Схематично представлена локализация в различных слоях плаценты факторов, предотвращающих развитие реакции отторжения плода как аллотрансплантата
Молекулы MHC-I — HLA-A и HLA-B отсутствуют на клетках внешней оболочки — синцитиотрофобласта, а также на клетках ворсинчатого цито- тотрофобласта. Молекулы HLA-C на клетках трофобласта экспрессируются. Биологический смысл этого «исключения из правила» пока неясен. В трофобласте выявлены особенности транспорта цитозольных пептидов, препятствующие их встраиванию в молекулы MHC, без чего невозможно формирование стабильной молекулы MHC-I. Таким образом, механизмы, препятствующие экспрессии молекул MHC-I на клетках трофобласта, связаны с посттранскрипционным уровнем формирования макромолекул. Показано, что экспрессия молекул MHC-I на клетках трофобласта блокирована настолько надежно, что не индуцируется даже при действии интер- феронов.
В то же время на клетках цитотрофобласта, особенно ворсинчатого, выявлены «неклассические» молекулы MHC-I, относимые к подклассу Ib — HLA-E и HLA-G, в меньшей степени — HLA-F. Для этих молекул характерен ограниченный полиморфизм и, по-видимому, они не участвуют в презентации антигенов. Зато их распознают ингибиторные молекулы NK-клеток, а также у5Т-клеток и некоторых других лимфоцитов: молекулу HLA-G распознают рецепторы LILRB1, а HLA-E — рецетпоры CD94/NKG. Распознавание обусловливает генерацию сигналов, блокирующих цитолитическую активность лимфоцитов и другие проявления их активности. В результате альтернативного сплайсинга формируется несколько изоформ молекул HLA-G; изоформы 1—4 связаны с мембранами, изоформы 5—7 сек- ретируются в среду и также выявляются в плаценте. Спектр клеток трофобласта, вырабатывающих растворимую форму HLA-G, шире спектра клеток,
экспрессирующих мембранную форму этой молекулы. Как мембранные, так и растворимые (особенно G5) изоформы молекулы HLA-G способны блокировать активность лимфоцитов, несущих соответствующие рецепторы, прежде всего естественных киллеров. Зарегистрировано подавление под влиянием HLA-G способности цитотоксических лимфоцитов секретиро- вать IFNy и усиливать секрецию TGFp.
Таким образом, важный механизм, предотвращающий отторжение плода как аллогенного трансплантата — особый характер экспрессии молекул MHC-I на клетках трофобласта (отсутствие экспрессии классических молекул MHC, представляющих антигенный пептид, и экспрессия или секреция молекул, блокирующих активность естественных киллеров), что предотвращает сенсибилизацию организма матери антигенами плода и обеспечивает блокаду естественных киллеров.
Тем не менее, есть многочисленные свидетельства того, что до иммунной системы матери доходят иммуногенные сигналы от плода, о чем свидетельствует накопление в сыворотке рожавших женщин антител против HLA и других антигенов плодов, причем уровень и разнообразие этих антител возрастает с увеличением числа беременностей. Признаки сенсибилизации к антигенам плода проявляются и на Т-клеточном уровне. Однако эта сенсибилизация в норме не приводит к развитию реакции отторжения. Это обусловливает необходимость рассмотрения состояния различных звеньев иммунной системы матери, а также околоплодных оболочек — как материнских, так и плодных. Нет сомнений, что некоторые особенности иммунологической реактивности матери обусловлены эндокринными перестройками. Прогестерон, хорионический гонадоторопин и другие гормоны, уровень которых повышается при беременности, способствуют сдерживанию реакций, направленных на отторжение плода, однако эффект гормонов явно недостаточен для сохранения беременности MHC-несовместимым плодом, и большинство факторов сдерживания формируется в процессе морфогенеза плаценты в соответствии с законами функционирования и регуляции иммунной системы.
Клетки врожденного иммунитета в плаценте
Макрофаги присутствуют в плодных и материнских компонентах плаценты. На долю этих клеток приходится 10—20% лейкоцитов, содержащихся в децидуальной оболочке, где выявляют активированные формы макрофагов, однако синтез ими провоспалительных цитокинов IL-1, TNFa, IL-6, IL-8 ограничен. Эти цитокины имеют несомненные потенции к повреждению и отторжению плода. Они играют ключевую роль в нарушении беременности, вызванной инфекциями.
Дендритные клетки присутствуют в материнской части плаценты. Они представлены незрелыми и зрелыми миелоидными дендритными клетками. Преобладающий функциональный вариант — клетки DC2-rarn, ответственные за индукцию анергии Т-лимфоцитов. На дендритных клетках, как и на макрофагах, обнаружены молекулы ILT2 и ILT4, выступающие в качестве рецепторов молекул HLA-G. Дендритные клетки и макрофаги плаценты активно поглощают клетки неворсинчатого трофобласта, подвергающиеся апоптозу, что рассматривают как этап индукции иммунологической толерантности матери к антигенам плода, унаследованным от отца. Наконец, для АПК плаценты, прежде всего дендритных, характерен высокий уровень активности индолил-2,3-дезоксигеназы. Как известно, этот фермент катализирует превращение триптофана в N-формилкинуренин, который затем превращается в кинуренин. При этом формируется микроокружение, дефицитное по триптофану, — аминокислоте, лимитирующей биосинтез белка. Такое микроокружение характерно для участков локальной иммуносупрессии.
Содержание NK-клеток в децидуальной оболочке достигает 20—30% от числа клеток костномозгового происхождения. Практически всю популяцию образуют NK-клетки фенотипа CD56bright CD16-. Иногда их выделяют в особую субпопуляцию маточных NK-клеток (uNK). Выше уже было отмечено (см. раздел 2.4.1), что клетки с таким фенотипом активно секретируют цитокины, прежде всего IFNy, но обладают ограниченной цитолитической активностью. Проявлению активности естественных киллеров способствует экспрессия на клетках плода и трофобласта стрессорных молекул MICA и MICB, служащих индукторами активации NK-клеток, при отсутствии на них классических молекул MHC-I. Однако активность NK-клеток в трофобласте блокируется неклассическими молекулами HLA-G и HLA-E, экспрессируемыми клетками трофобласта, а также растворимыми формами этих молекул. Аналогичной, хотя и менее выраженной функцией обладают у5Т-клетки, содержание которых в трофобласте существенно повышено (до 25% против 2—3% в кровотоке). Однако роль у8Т-, как и NKT-клеток, в плаценте связана, скорее всего, со сдерживанием реакции отторжения, поскольку этим клеткам свойственна регуляторная функция, активно проявляемая ими в слизистых оболочках.
Особенности дифференцировки Т-клеток в организме беременных и в плаценте
Содержание Т-лимфоцитов в децидуальной оболочке достаточно высоко в начальный период после ее формирования, но к концу беременности их содержание снижается до 5—8% от числа клеток костномозгового происхождения. Значительная часть этих клеток (до 30%, против 5—8% в нормальной крови) экспрессирует мембранные молекулы HLA-DR, т.е. находится в активированном состоянии. Т-клетки представлены как CD8+, так и CD4+ лимфоцитами. Несмотря на отсутствие экспрессии молекул MHC-I на клетках трофобласта, среди CD8+ Т-лимфоцитов есть клетки, специфичные к антигенам плода, т.е. потенциальные киллеры, способные повредить ткани плода. Их проникновение в плод предотвращается с помощью механизма, проявляющегося при защите иммунологически привилегированных зон (см. выше): клетки трофобласта экспрессируют молекулы семейства TNF, способные индуцировать апоптоз клеток, несущих соответствующие рецепторы. Так, на клетках трофобласта обнаружены молекулы FasL, TRAIL, способные через взаимодействие соответственно с рецепторами Fas- (CD95) и DR-5 вызывать апоптоз эффекторных Т-клеток. Кроме того, активность Т-клеток подавляется в связи с дефицитом триптофана в микроокружении, о формировании которого говорилось выше.
Как известно, субпопуляции хелперных Т-лимфоцитов определяют направление развития иммунного ответа, которое обычно соответствует потребностям организма. При реакции на аллогенный трансплантат (в качестве аналога которого можно рассматривать плод) преобладает их дифференцировка в TM-клетки — продуценты IFNy. При беременности на системном уровне соотношение субпопуляций Т-хелперов изменяется незначительно и при этом выявляют лишь некоторое предпочтение диф- ференцировки в ^2-клетки в ущерб Th1- и ThH-хелперам. В децидуальной оболочке плаценты TW-клеток практически нет (вероятно, вследствие блокады их дифференцировки в региональных лимфатических узлах), тогда как ^2-клетки присутствуют, и их дифференцировка в региональных лимфатических узлах полностью сохранена. О реальной опасности TW-клеток и их продуктов для вынашивания плода свидетельствуют данные экспериментов с введением в плаценту мышей предварительно индуцированных TW-клеток: это приводит к выкидышу. Аналогичное введение ^2-клеток такого эффекта не вызывает. Решающую роль в реализации такого действия TW-клеток играет секретируемый ими IFNy, введение которого само по себе вызывает прерывание беременности.
Уже давно постулировали защитную роль супрессорных клеток, которые должны развиваться или аккумулироваться в плаценте. Данные, напрямую подтверждающие эти представления, получены после открытия естественных регуляторных Т-клеток. Содержание CD4+ CD25 + Foxp3+ клеток (регуляторные Т-лимфоциты) в циркулирующей крови беременных достигает максимума во II триместре беременности. После родов содержание этих клеток уже не отличается от нормы. Содержание функционально активных регуляторных CD4+ CD25+ Foxp3+ Т-клеток возрастает также в децидуальной оболочке, т.е. в зоне непосредственного контакта с тканями плода: на их долю приходится 14% от числа децидуальных CD4+ Т-лимфоцитов (в норме в периферической крови — около 5%). Развитию регуляторных Т-клеток в плаценте способствуют толеро- генные дендритные клетки. При самопроизвольном выкидыше содержание регуляторных T-клеток в плаценте существенно ниже. Накопление в плаценте регуляторных T-лимфоцитов не происходит у мышей, генетически предрасположенных к развитию спонтанных абортов, причем перенос им CD4+ CD25+ Т-клеток от нормальных сингенных животных предотвращает аборты.
Помимо естественных регуляторных клеток иммунопротективную роль в плаценте играют индуцированные (адаптивные) регуляторные Т-лим- фоциты типов Th3 и Tr1. Эти клетки секретируют супрессорные цитокины IL-10 и TGFp, подавляющие активность TM-клеток и их цитокинов. Дополнительную регуляторную роль играют естественные регуляторные Т-клетки типов NKT и у5Т, о которых уже говорилось.
Таким образом, динамика численности субпопуляций Т-лимфоцитов свидетельствует о предотвращении проникновения в плаценту или развития в ней TW-клеток, агрессивных в отношении плода, и накоплении естественных регуляторных клеток, предупреждающих развитие реакции отторжения.
В-клетки, гуморальный иммунитет и система комплемента
Исходное содержание В-клеток в децидуальной оболочке невелико (как и в кровотоке матери). Оно существенно возрастает в процессе беременности, достигая 13% в поздние сроки. Уже упоминалось о разнообразном спектре антител, в том числе направленных против молекул HLA (особенно I класса), — «следа» предшествующих беременностей. Развитию гуморального иммунного ответа, в том числе в зоне контакта матери и плода, способствует наличие ^2-клеток. Полагают, что подобно тому, как это происходит при иммунологических реакциях на аллотрансплантат или опухоль, антитела не только не играют существенной деструктивной роли, но даже предохраняют клетки плода от повреждения факторами клеточного иммунитета.
Широко известный и, возможно, единственный пример повреждающей роли антител, синтезируемых в организме матери и направленных против антигенов плода, — анти^^антитела, вызывающие гемолитическую болезнь новорожденных (см. раздел 4.5.2.1). Пока трудно сказать, почему среди огромного множества антигенов, различных у плода и матери, именно резус-антигены (особенно D) не только оказываются иммуногенными, но и определяют деструктивный эффект гуморального иммунитета. Вероятно, одна из причин — высокая чувствительность эритроцитов, на которых локализуется этот антиген к комплементзависимому лизису. Особое место этого антигена среди эритроцитарных аллоантигенов, по-видимому, обусловлено его наибольшей иммуногенностью.
Систему комплемента, безусловно, нужно рассматривать в ряду потенциальных эффекторных факторов повреждения плода, особенно если учесть синтез антител, способствующих проявлению его активации по классическому пути на клетках плода. Серьезный барьер для транспорта антител и активации комплемента — трофобласт. В клетках трофобласта активно функционирует система контроля и инактивации комплемента: на них повышен уровень экспрессии молекул CD46, CD59, фактора DAF, относящихся к этой системе.
Материал, приведенный выше, свидетельствует о том, что, несмотря на наличие трофобластного барьера, изолирующего MHC-несовместимый плод от иммунной системы матери, существует реальная возможность сенсибилизации матери антигенами плода. Для предотвращения этого в плаценте реализуются разнообразные защитные механизмы, пресекающие развитие иммунных атак. Среди таких механизмов особенно нужно выделить механизмы, направленные против синтеза провоспалительных и TW-цитокинов, способствующих отторжению чужеродных тканей. Напротив, выработка их антагонистов — супрессорных и ^2-цитокинов — поддерживается. Наконец, первостепенную роль в защите плода играет целая система регуляторных Т-клеток, мобилизуемых в зону контакта плода и матки или формирующихся местно. Эти клетки активно блокируют проявления иммунной агрессии против плода.
В результате, хотя при беременности происходят разнообразные иммунные процессы, свидетельствующие о распознавании иммунной системой матери антигенов плода, эти процессы не являются деструктивными. Более того, определенная степень иммунной активации даже благоприятна для поддержания беременности. Среди иммунологических причин выкидышей наряду с факторами, обусловленными тканевой несовместимостью, фигурирует отсутствие или недостаточная выраженность антигенных различий, в первую очередь различий по системе MHC. Акт родов имеет в своей основе (наряду с гормональными) факторы иммунологической природы, в первую очередь, снятие запретов на иммунную реакцию отторжения вследствие быстрого снижения содержания регуляторных Т-клеток. Поэтому в механизме родов определенная роль принадлежит иммунологическим механизмам отторжении несовместимых тканей.
Источник: Ярилин.А.А , «Иммунология » 2010
А так же в разделе «Иммунологические взаимоотношения матери и плода »
- Искусственная иммунологическая толерантность к трансплантатам
- Естественная иммунологическая толерантность
- Выбор между активацией и анергией в лимфоидной ткани слизистых оболочек
- Иммунологически привилегированные органы
- АУТОИММУННАЯ ПАТОЛОГИЯ
- Иммунопатогенез аутоиммунных заболеваний
- Генетические аспекты аутоиммунной патологии
- 4.4.1.З. Иммунологические механизмы повреждения при аутоиммунных процессах
- Аутоиммунные заболевания
- Органоспецифические аутоиммунные заболевания
- Системные аутоиммунные заболевания
- ГИПЕРЧУВСТВИТЕЛЬНОСТЬ
- Аллергия немедленного типа (гиперчувствительность I типа)
- Общая схема развития и проявления аллергических процессов
- Аллергены
- 4.5.1.З. Индукция аллергического иммунного ответа
- Механизмы реализации аллергических реакций
- Роль нарушения баланса субпоплуяций Т-клеток
- Роль наследственных и внешних факторов в развитии аллергии
- Аллергические заболевания
- Принципы лечения аллергических заболеваний