В 1945 г. Дж. Оуен (J. Owen) описал устойчивый химеризм (сосуществование в одном организме клеток разного генотипа) эритроцитов телят- близнецов, у которых в эмбриональном периоде было сращение (анастомоз) сосудов пуповины. Это наблюдение дало начало целенаправленным поискам способа индукции неотвечаемости на чужеродные антигены — толерантности, т.е. «терпимости».
В 1953 г. были опубликованы результаты экспериментов Р. Биллингема (R. Billinham), Л. Брента (L. Brent) и П. Медавара (P. Medawar) по индукции иммунологической толерантности. В период эмбрионального развития
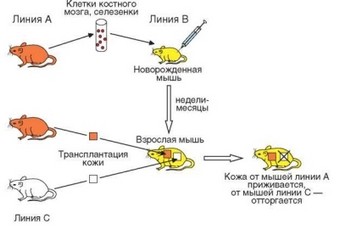
Рис. 4.14. Схема индукции иммунологической толерантности в эксперименте на мышах. В классических опытах иммунологическую толерантность индуцировали введением размножающихся клеток реципентам с незрелой иммунной системой, а тестировали у взрослых животных
мышам линии A/J in utero вводили суспензию клеток, полученных из костного мозга и селезенки мышей линии C57BL/6. На 6-8-й неделе постнатальной жизни реципиентам пересаживали кожные лоскуты от мышей линии C57BL/6. Лоскут не отторгался (что было легко контролировать благодаря контрастной окраске шерсти мышей — белой у мышей A/J и черной у C57BL/6), тогда как в контроле отторжение происходило в течение 10—12 сут. В такой срок отторгалась кожа мышей посторонней линии (рис. 4.14). Описанное явление «терпимости» к коже, несовместимой по MHC (Н-2 мышей), было названо иммунологической толерантностью.
Практически в то же время аналогичный результат получил М. Гашек (M. Hasek), который искусственно объединял кровеносные системы эмбрионов кур (создавал эмбриональный парабиоз) и после вылупления цыплят демонстрировал возможность успешного обмена между ними кожными трансплантатами. Позже было создано несколько модифицированных моделей иммунологической толерантности. Показано, что у мышей и некоторых других животных толерантность может быть индуцирована введением аллогенных клеток в первые сутки после рождения. Временной интервал, при котором существует возможность индуцировать иммунологическую толерантность введением аллогенных клеток, связывали со сроком «созревания» иммунной системы. В целом эта трактовка сохранилась, причем понятие «созревание иммунной системы» сейчас трактуется как ее «перифериали- зация», т.е. заселение вторичных лимфоидных органов и ослабление зависимости Т-клеток от тимуса. Толерантность удается индуцировать также у взрослых животных при предварительном разрушении лимфоидной ткани облучением или цитотоксическими агентами.
Иммунологическая толерантность — не просто состояние иммунодепрессии (хотя иммунодепрессия часто является фоном, на котором удается индуцировать толерантность), поскольку неотвечаемость распространяется только на антигены, использованные для индукции толерантности, тогда как способность к иммунному ответу на другие антигены у животных сохраняется. Иными словами, иммунологическая толерантность представляет собой специфическое подавление способности к иммунному ответу на уровне отдельных клонов лимфоцитов.
Оптимальный материал для индукции толерантности — пролиферирующие клетки кроветворной и иммунной систем. Это связано, во-первых, с длительным персистированием этих клеток в организме вследствие их способности к самовоспроизведению, а во-вторых, — с высоким уровнем экспрессии ими молекул MHC обоих классов. В результате формируется длительный химеризм, что служит обязательным условием поддержания состояния толерантности. Важно сохранение в организме хозяина дендритных клеток донора, почти всегда присутствующих в трансплантируемой ткани.
Вскоре после открытия иммунологической толерантности было установлено, что можно индуцировать специфическую неотвечаемость и на растворимые антигены. Толерантность вызывали внутривенным введением некоторых сывороточных белков, освобожденных от молекулярных агрегатов ультрацентрифугированием или «биологическим фильтрованием» — пропусканием через организм мыши. Толерантность к растворимым антигенам можно индуцировать на двух дозовых уровнях, в результате чего получают низкодозовую и высокодозовую толерантность. Существуют некоторые структурные особенности антигенов или их физико-химического состояния, благоприятствующие индукции толерантности и которые можно обозначить как толерогенность (см. раздел 3.2.1.2).
Отмена состояния иммунологической толерантности может произойти спонтанно после удаления из организма антигена (в случае его связи с клетками — после устранения химеризма). Прерывание толерантности может быть ускорено с помощью воздействий, повреждающих лимфоциты и требующих восстановления лимфоидной системы, при условии отсутствия толерогена в период регенерации. Толерантность удается преодолеть введением сингенных лимфоцитов от нетолерантных животных (особенно эффективно толерантность отменяется при введении лимфоцитов от животных, иммунизированных соответствующим антигеном). Наконец, отмене толерантности способствует иммунизация антигеном, перекрестно реагирующим с антигеном, использованным для индукции толерантности.
Приведенные выше данные свидетельствуют о том, что иммунологическая толерантность есть некая форма активности иммунной системы. Классическая трактовка природы иммунологической толерантности состоит в том, что введенный антиген вызывает элиминацию или анергию клонов лимфоцитов, которые его распознают. По-видимому, именно с возможностью реализации такого процесса как элиминация клонов (наиболее радикального механизма толерантности) связаны возрастные ограничения индукции толерантности путем введения клеток интактным реципиентам.
Вероятно, такая возможность требует наличия на периферии иммунной системы лимфоцитов, отвечающих гибелью (а не активацией, как у взрослых) на действие антигена, а такие клетки содержатся в организме лишь в короткий срок после рождения. Для поддержания толерантности необходимо установление химеризма на уровне костного мозга, в результате чего в тимус поступают дендритные клетки донорского генотипа, несущие антиген, к которому индуцирована толерантность. Эти клетки обеспечивают элиминацию соответствующих клеток на уровне отрицательной селекции. Нарушение химеризма приводит к прекращению такой селекции и потере толерантности.
Индукцию толерантности растворимыми антигенами первоначально трактовали как результат «обхода» нормального механизма поглощения и переработки антигена макрофагами. В настоящее время это можно объяснить сходным, но несколько иным образом: безагрегатные антигены действительно не активируют макрофаги, которые вследствие этого не выделяют провоспалительные цитокины, необходимые для стимуляции созревания иммуногенных дендритных клеток (DC1). В результате антиген поглощают незрелые или DC2-дендритные клетки, являющиеся толероген- ными, так как они способны индуцировать анергию Т-клеток, которым пре- зентируют антиген. Толерантность, индуцированная белками, временна, поскольку с удалением антигена восстанавливается нормальный процесс презентации с участием DO-клеток.
Объекты действия толерогенов и толерогенных факторов — преимущественно Т-лимфоциты, особенно Т-хелперы, первыми получающие сигнал от дендритных клеток. Поскольку от активации Т-хелперов зависят практически все формы иммунного ответа, их «толеризации» обычно бывает достаточно, для предотвращения развития иммунного ответа. Однако в опытах с индукцией иммунологической толерантности разными дозами белковых антигенов показано, что В-клетки тоже могут приобрести состояние специфической неотвечаемости, но для этого необходимы более высокие дозы антигена и достигнутое состояние бывает менее стабильным.
Хотя превентивная индукция иммунологической толерантности к антигенам тканевых трансплантатов донора применения не нашла, ее индукцию с помощью иммунодепрессивных воздействий (прежде всего циклоспорина) после подсадки органов используют повсеместно и она служит основой всех удачных случаев приживления аллогенных тканей. Индукция взаимной толерантности тканей реципиента и донора является условием также для формирования устойчивого химеризма без развития РТПХ при пересадке костного мозга реципиентам, облученным при лечении гемобластозов или в случаях радиационных катастроф.
