Изучение механизма биологической фиксации молекулярного азота проводится со времени открытия и выделения азотфик- сирующих микроорганизмов. В результате выяснены многие важные стороны этого сложного биохимического процесса. В частности, изучено строение и свойства азотфиксирующего ферментного комплекса - нитрогеназы; установлены единста структуры и функций этого фермента у разных азотфиксирующих микроорганизмов, его высокая чувствительность к кислороду; доказан единый восстановительный путь связывания азота у всех азотфиксирующих микроорганизмов; определены ферментные системы, катализирующие реакции восстановления молекулярного азота и пути его дальнейшего превращения.
Как известно, молекулярный азот весьма стабилен и почти не вступает в химические связи с другими элементами (исключение составляет металлический литий, с которым N2 образует в обычных условиях (Li3N). Атомы в молекуле азота соединены тремя связями (N=N). Энергия диссоциации их равна 225 ккал/моль. Наибольшей энергией обладает первая связь - 127 ккал/моль, вторая - 60, третья - 38.
Прочность связей определяет инертность молекулярного азота. Поэтому для химического связывания азота с другими элементами необходима предварительная активизация каждого из них. На химическом активировании молекулярного азота базируется известный способ синтеза аммиака из атмосферного азота химическим путем, предложенный А. Габером-Бошем. Синтез осуществляется при температуре 400-500° С и давлении 200-1000 атм..
В клетках же микроорганизмов данный процесс происходит в обычных условиях. Биологическая фиксация молекулярного азота идет восстановительным путем. Первым стабильным продуктом азотфиксации является аммиак. Активирование молекулярного азота и восстановителя обусловлено деятельностью специфического ферментного комплекса - нитрогеназы. Это основной компонент азотфиксирующей системы. Он состоит из двух белков, т. е. двух ферментных компонентов, один из которых содержит молибден и железо, второй - только железо. Нитрогеназа обладает гидро- геназной активностью, поэтому молекулярный водопровод может подавлять фиксацию азота, конкурируя с ним за активный центр ферментной системы. Донором электронов, т. е. восстановителем, служит негеминовый железосодержащий белок ферродоксин, или флаводоксин, источником энергии - АТФ, являющийся обязательным компонентом азотфиксирующей системы. Потребность в АТФ у азотфиксирующих микроорганизмов очень велика. Для восстановления одной молекулы N2, на которое требуется шесть электронов, затрачивается 12 молекул АТФ. Суммарное уравнение реакции имеет следующий вид:
N2 + 6«Г + 12 АТФ + 12Н20 gt; 2NH,+ + 12 АДФ + 12 Фн + 4Н".
Образовавшийся аммоний используется для синтеза глутаминовой кислоты и глутамина. Ключевую роль в этом процессе играет глутаминсинтетаза. Она катализирует реакцию синтеза глутамина из глутаминовой кислоты и аммиака, снижая тем самым концентрацию аммония в клетке. Это имеет большое значение для повышения азотфиксирующей способности микроорганизмов, ибо ионы аммония или его производные - аминокислоты - подавляют процесс азотфиксации, репрессируя синтез нитрогеназы. Функции глутаминсинтетазы в фиксации молекулярного азота не ограничиваются связыванием аммиака. Она выполняет основную регуляторную роль в синтезе нитрогеназы, активизируя работу nif-оперона, а также в синтезе других ферментов азотного метаболизма.
Опыты, проведенные на бесклеточных препаратах и с очищенным ферментом, показали токсическое действие кислорода на активность нитрогеназы. Но вместе с тем кислород необходим для дыхания аэробных азотфиксирующих микроорганизмов, так как получение энергии из органических соединений и ее трансформация в макроэргические связи АТФ осуществляются у них в процессах дыхания и сопряженного окислительного фосфорилирования. Чтобы предохранить нитрогеназу от токсического действия кислорода воздуха, у микроорганизмов выработались различные защитные механизмы: сильная респирация у азотбакгера, обильное
слизеобразование у ризобий в чистой культуре, наличие леггемоглобина в клубеньках.
Леггемоглобин в клубеньках находится между клетками бактероидов и окружающими их мембранами растений. Синтез леггемоглобина осуществляется растительной клеткой, а синтез исходного вещества - протогема - производится в бактероидах. В отдельности ни бобовые растения, ни клубеньковые бактерии неспособны к синтезу леггемоглобина. При симбиотической азот- фиксации растения и бактерии функционируют как единая система (рис. 12.6). Высшие растения играют роль поставщика энергетического материала для активации и связывания азота и в то же
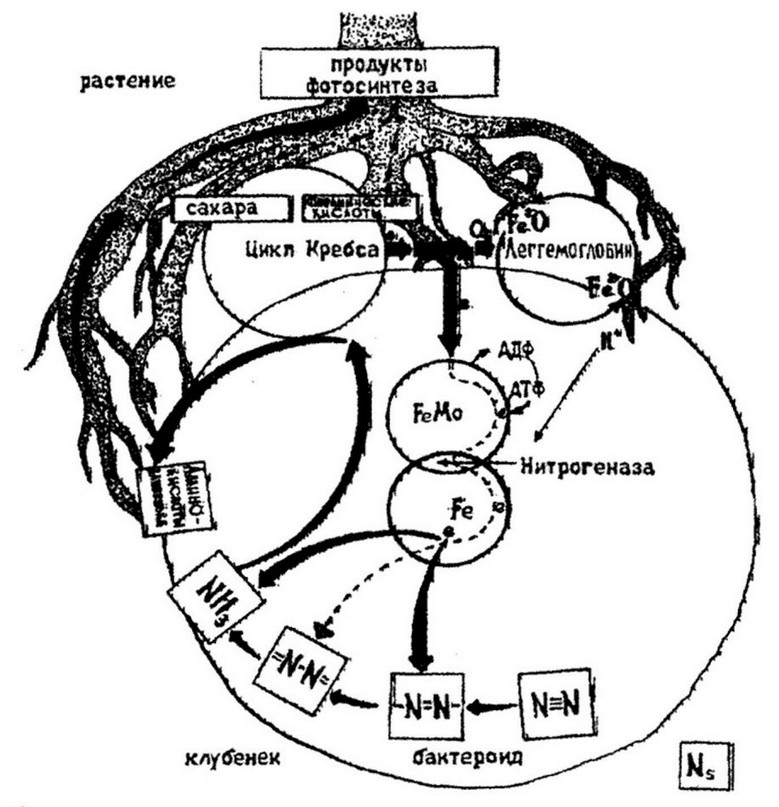
Рис. 12.6 Схема симбиотической азотфиксации
время потребителя азотсодержащих соединений. Электрон- транспортную функцию выполняют леггемоглобин; он же регулирует содержание кислорода в симбиотической системе, который, с одной стороны, необходим для образования АТФ (путем окислительного фосфорилирования), а с другой стороны - является токсичным для нитрогеназ.
Процесс азотфиксации осуществляется в бактероидах. Конечным продуктом его, как было отмечено, является аммоний. Растениями же используются аминокислоты, образовавшиеся в результате соединения аммония с кетокислотами. Выяснение функций бактерий и растений в симбиотической азотфиксации позволило воспроизвести условия для развития бактерий, аналогичные таковым в клубеньке бактерий, и показать способность клубеньковых бактерий разных видов к самостоятельной азотфиксации. Обязательным условием для фиксации молекулярного азота чистыми культурами клубеньковых бактерий является наличие в среде подходящих источников углерода, преимущественно пентоз (арабиноза, р ибо за), промежуточных соединений цикла Кребса (сукцинат, пируват) и минимальных количеств связанного азота. Необходимы также витамины и микроэлементы (Мо, Со). Веским доказательством азотфиксирующей способности свободноживущих клубеньковых бактерий послужило обнаружение в их клетках (а не в растительных) генов азотфиксации.
Симбиотическая азотфиксация обеспечивается сложной системой генов клубеньковых бактерий. Одни из них - гены симбиоза (nof - гены) - контролируют специфичность клубеньковых бактерий и образование клубеньков; другие - гены азотфиксации (nif - гены) кодируют синтез азотфиксирующих ферментов, в том числе и нитрогеназы; третьи гены принимают в азотфиксации косвенное участие - регулируют метаболизм в направлении обеспечения процесса азотфиксации энергией. Гены симбиоза и большинство генов азотфиксации находятся на плазмидах, только некоторые из nif-генов (nif-3, nif-4, nif-7) расположены на хромосоме. Плазмиды клубеньковых бактерий являются составной частью генома, отличаются большой молекулярной массой (2 ’ 10 ) и способны передаваться из клетки в клетку.
