Анальгетическая активность комбинации антагонистов NMDA-рецепторов и опиатных анальгетиков
На моделях острой боли анальгетическая активность комбинации антагонистов NMDA-рецепторов и опиатных анальгетиков зависит от двух факторов — типа антагониста и вида экспериментальных животных. Потенцирование морфиновой анальгезии канальными блокаторами (например дизоцилпином) наблюдали на крысах (Ben-Eliyahu et al., 1992; Kest et al., 1992; Advokat, Rhein, 1995; Grass et al, 1996; см., однако, Ossipov et al., 1995), в то время как снижение анальгетической активности морфина отмечено в исследованиях на мышах (Lipa, Kavaliers, 1990; Lutfy et al., 1993; Saucier, Kavaliers, 1994). При использовании в сочетании с морфином конкурентных антагонистов наблюдают как повышение (мыши: Saucier, Kavaliers, 1994; Bhargava, 1997; крысы: Tiseo, Inturrisi, 1993; Grass et al., 1996), так и отсутствие изменений в острой анальгетической активности морфина (мыши: Elliott et al., 19946; Bilsky et al., 1996). Чтобы сделать какие-либо окончательные выводы относительно других типов антагонистов, информации пока еще недостаточно, хотя имеющиеся данные указывают на повышение анальгетической активности морфина при сочетанном введении его с глициновыми и полиаминовыми антагонистами (Kolesnikov et al., 1994; Bernardi et al., 1996; см., однако, Nishiyama et al., 1998).
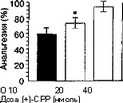
Как уже отмечалось, при интратекальном введении антагонисты NMDA-рецепторов усиливают анальгезию, индуцированную морфином (Chapman, Dickenson, 1992; Wong et al., 1996), а при внутримозговом введении в ЦОВ — ослабляют (Jacquet, 1988; van Praag, Frenk, 1990; Suh et al., 1994). Из рис. 2.6 видно, что при сочетанном внутрижелудочковом введении дизоцилпина и морфина анальгетическая активность последнего достоверно ослабевает. В то же время при совместном интратекальном введении антагониста NMDA-рецепторов (+)-СРР и морфина наблюдается повышение анальгетической активности морфина.
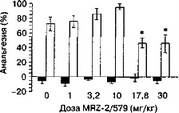
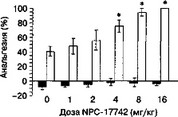
При системном введении антагонисты NMDA-рецепторов действуют одновременно на сегментарные и суирасегментарные механизмы болевого реагирования. Поэтому эффекты сочетанного введения антагонистов с морфином определяются соотношением их епинальных и еупраспинальных эффектов в каждом конкретном случае. Это соотношение зависит от вида используемого антагониста, поскольку в разных структурах ЦНС наблюдается различный уровень экспрессии субъединиц NMDA-рецептора, а значит и неодинаковая фармакологическая чувствительность. На рис. 2.7 представлены результаты экспериментов, в которых оценивали анальгетическую активность сочетанного системного введения антагонистов NMDA-рецеп-

А
Рис. 2.6. Влияние дизоцилпина (А) и (+)-СРР (Б) на анальгетическую активность морфина (10 и 5 мкг) при внутрижелудочковом и интратекальном введении, соответственно (беспородные крысы, тест "отдергивания хвоста"). *р lt; 0,05 (тест Даннетта), по сравнению с группой, получавшей растворитель вместо антагониста (темный столбик) торов и морфина. Антиноцицептивная активность морфина в тесте "отдергивания хвоста" повышалась при введении его в комбинации с конкурентным антагонистом NPC-17742 и снижалась при сочетанном использовании его с канальным блокатором MRZ-2/579.1
На моделях хронической боли (воспалительной и нейропатической) сочетанное введение опиатных анальгетиков и антагонистов NMDA-рецепторов также проявляется выраженной анальгетической активностью. Положительные результаты были получены для канальных блокаторов, конкурентных и глициновых антагонистов (Ossipov et al., 1995; Qian et al, 1996; Nickols et al., 1997; Christensen et al., 1998). Причем установлено, что усиление анальгетической активности опиатных анальгетиков при введении их в комбинации с антагонистами NMDA-рецепторов не сопровождается появлением или усилением моторных нарушений (Christensen et al., 1998).
А Б
Рис. 2.7. Влияние MRZ-2/579 (A) HNPC-17742 (Б) на анальгетическую активность морфина (5 мг/кг и 3 мг/кг, соответственно) при внутрибрюшинном введении (беспородные мыши, тест "отдергивания хвоста"). Антагонисты вводили совместно с морфином (светлые столбики) или растворителем (темные столбики). *р lt; 0,05 (тест Даннетта), по сравнению с группой, получавшей растворитель вместо антагониста ("О”)
При использовании как моделей острой боли (Grass et al., 1996; Wong et al, 1996; Bespalov et al., 19986; и др.), так и моделей хронической боли (Advokat, Rhein, 1995; Christensen et al., 1998; и др.) выявлено, что антагонисты NMDA-рецепторов усиливают морфиновую анальгезию при введении их в дозах, в которых у них отсутствует собственная антиноцицептивная активность (см., однако, Yamamoto, Yaksh, 1992в; Yamamoto et al., 1993). Кроме того, в отличие от морфина антагонисты NMDA-рецепторов не влияют на болевые пороги нормальной (здоровой) ткани (Yamamoto, Yaksh, 1992в; Yamamoto et al., 1993).
Повышение анальгетической активности опиатных анальгетиков при сочетанном введении с антагонистами NMDA-рецепторов настолько значительно, что перспективы клинического использования накопленного экспериментального опыта не вызывают сомнений (табл. 2.7; Christensen et al., 1998; Quartaroli et al., 1999). В клинических испытаниях установлена способность кетамина в субанестетических дозах значительно повышать анальгетический потенциал морфина у резистентных к последнему онкологических больных, а также снижать их потребность в опиатнои анальгезии (Yang et al., 1996).
Однако механизмы этого феномена еще вызывают споры. С одной стороны, выявлено что целый ряд опиатных анальгетиков (например метадон, пропоксифен) являются слабыми блокаторами канала, ассоциированного с NMDA-рецептором (Davis, Inturrisi, 1999; Ebert et al., 1998). С другой стороны, предполагают, что опиатные и NMDA-рецепторы имеют общие внутриклеточные системы вторичных и третичных посредников, на уровне которых и происходит взаимодействие. В пользу такой точки зрения свидетельствует большинство экспериментальных данных. Например, известно, что при нейропатической боли, сопровождающейся повышенным высвобождением глутамата, ослабляется анальгетическая активность морфина (Мао et al., 19956; Ossipov et al., 1995).
Одним из наиболее существенных результатов таких взаимодействий между опиа- тергической и глутаматергическои системами является пролонгирование опиатнои анальгезии при сочетанном введении опиатного анальгетика с антагонистом NMDA- рецепторов (Ben-Eliyahu et al., 1992; Grass et al., 1996; Bespalov et al., 19986). Возможные механизмы и последствия подобных взаимодействий, а также экспериментальные примеры представлены в гл. 3.
Усиление эффектов опиатных анальгетиков может оказаться более общим явлением, не ограничивающимся анальгетической активностью. Например, антагонисты NMDA-рецепторов способны усиливать гипотермию, каталепсию, вызываемые морфином, а также снижать ЛД50 для морфина (Trujillo, Akil, 19916; Bhargava, 1997).
Таблица 2.7. Анальгетическая активность антагонистов NMDA-рецепторов
|
Вид анальгетической активности |
Канальные блокаторы |
Конкурентные антагонисты |
Глициновые антагонисты |
Полиаминовые антагонисты |
|
Собственная активность - фазная боль |
|
|
|
|
|
-тоническая боль |
+ |
+ |
+ |
+ |
|
В комбинации с опиатами |
+ |
+ |
+ |
? |
Источник: Беспалов А. Ю., Звартау Э. Э., «Нейропсихофармакология антагонистов NMDA-рецепторов» 2000
А так же в разделе «Анальгетическая активность комбинации антагонистов NMDA-рецепторов и опиатных анальгетиков »
- NMDA-рецепторы и физиологические механизмы болевой чувствительности
- Анальгетическая активность антагонистов NMDA-рецепторов
- 2.7. Факторы, ограничивающие клиническое применение антагонистов NMDA-рецепторов
- Первично-подкрепляющие свойства
- Дискриминативные стимул ьные свойства
- Реакция электрической самостимуляции мозга
- Условнорефлекторная реакция предпочтения места
- Возможные пути ослабления психотомиметического и аддиктивного потенциала антагонистов NMDA-рецепторов
- Расстройства внимания и сенсомоторный дефицит
- Развитие толерантности
- Нейротоксическое действие