БИОЛОГИЧЕСКОЕ ДЕЙСТВИЕ ИОНИЗИРУЮЩЕГО ИЗЛУЧЕНИЯ И ПАТОГЕНЕЗ ЛУЧЕВОЙ БОЛЕЗНИ
Поток проникающей радиации ядерного взрыва состоит из гамма-лучей и нейтронов. Время поражающего действия гамма- излучения ядерного взрыва равняется примерно 10 сек, а поток нейтронов действует на организм только в момент взрыва — в течение нескольких десятых долей секунды. Величина доз гамма- излучения выражается в рентгенах (р) \ а для оценки биологической активности нейтронов пользуются биологическим эквивалентом рентгена (бэр) ‘. В последние годы широкое распространение в дозиметрии получила новая единица — рад[1], рекомендованная 7-м Международным конгрессом радиологов (1953).
Доза нейтронного излучения в потоке проникающей радиации ядерного взрыва составляет примерно 20—30% дозы гамма-излучения. При применении ядерного оружия малого и ультрамалого калибра удельный вес нейтронного излучения будет значительно больше. Оба эти излучения обладают большой проникающей способностью.
Поглощение гамма-лучей (гамма-квантов) веществом происходит в результате их соударения с электронами среды. При этом гамма-кванты либо полностью (фотоэффект), либо частично (комптон-эффект) передают свою энергию электронам; наблюдается и превращение гамма-кванта (только с энергией выше 1,02 Мэе) в пару частиц — электрон и позитрон. Электроны, получившие энергию гамма-квантов (вторичные электроны), отрываются от своих атомов, движутся с большими скоростями и, расходуя свою энергию, вызывают ионизацию и возбуждение атомов и молекул среды.
Нейтроны, в зависимости от их энергии, условно делят: на быстрые— с энергией больше 1 Мэе (мегаэлектронвольт), промежуточные— с энергией 1 Мэе до 100 эв и медленные (тепловые)— с энергией меньше 100 эв. При своем движении нейтроны взаимодействуют с ядрами атомов среды, причем могут наблюдаться рассеяние и захват нейтронов. При рассеянии быстрые нейтроны часть своей энергии отдают ядрам среды и постепенно превращаются в медленные нейтроны. Ядра атомов среды, получившие энергию от быстрых нейтронов (так называемые ядра отдачи), при движении вызывают сильную ионизацию среды. Медленные нейтроны захватываются ядрами среды, причем испускается гамма-квант, который имеет меньшую ионизирующую способность, чем ядра отдачи.
Поражающее действие потока нейтронов определяется суммарной дозой быстрых, средних и медленных нейтронов. Основная доля в этой суммарной дозе приходится на дозу быстрых нейтронов, которые имеют наибольшую ионизирующую способность. Захват нейтронов атомами среды приводит к образованию изотопов, в том числе и радиоактивных. В тканях организма при воздействии нейтронов образуются радиоактивные изотопы: Na24, К42, Р32 и др. (так называемая наведенная активность).
На местности, зараженной продуктами ядерного взрыва, поражения людей могут возникать в результате внешнего воздействия смешанного бета-гамма-излучения и в результате попадания продуктов ядерного взрыва внутрь организма и на кожные покровы.
Бета-частицы в сравнении с гамма-лучами обладают меньшей проникающей, но большей ионизирующей способностью. В ткани организма они проникают на глубину до 8 мм. Поэтому при внешнем воздействии бета-излучений[2] возникают главным образом местные поражения поверхности тканей организма.
Альфа-частицы обладают весьма высокой ионизирующей способностью, но очень низкой проникающей способностью: они не проходят даже сквозь лист писчей бумаги. Наибольшее поражающее действие альфа- и бета-активных изотопов наблюдается при их попадании внутрь организма или на раневые п ожоговые поверхности.
Все сказанное выше приводит к заключению, что различные виды радиоактивных излучений, обладая общим свойством ионизировать и возбуждать атомы и молекулы облучаемых тканей, вместе с тем отличаются интенсивностью ионного выхода и характером поглощения их энергии, что, естественно, находит отражение в особенностях биологического эффекта, вызываемого разными видами радиации.
Для объяснения механизма возникновения у человека поражений, обусловленных ионизирующей радиацией, предложено немало теорий, перечислять которые не представляется целесообразным, так как значительное их число уже устарело или не имеет достаточно научных обоснований.
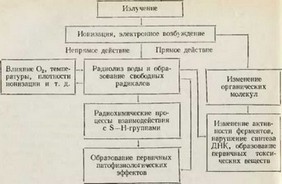
Для характеристики чрезвычайно сложных и во многом неясных процессов, развивающихся в организме при воздействии ионизирующих излучений, представляется целесообразным разделить их как бы на три этапа. В основе первого этапа лежат физические процессы (на субатомном и субмолекулярном уровнях), связанные непосредственно с поглощением энергии излучения, в результате чего образуются ионизированные и возбужденные атомы и молекулы. С этим сопряжено возникновение физико-хи мических процессов (радиохимическихпревращений),протекающих на субмолекулярном и молекулярном уровнях, с образованием небольшого количества высокоактивных окисляющих ради калов (второй этап). Физический и физико-химический (радиохимический) этапы действия ионизирующих излучений крайне скоротечны: они измеряются тысячными и миллионными долями микросекунд. Однако при этом наступает поражение ряда молекул и субклеточных структур, которые в дальнейшем вызывают функционально-морфологические нарушения в клетках и физиологических системах.
В настоящее время признается, что ионизирующие излучения влияют на различные молекулы (в том числе белковые) как непосредственно, так и опосредованно (через механизм радиолиза воды). Так, установлено, что ионизированные молекулы воды расщепляются, образуя химически активные свободные радикалы
(Н+, ОН-, НОг, Н202 и др.). Эти свободные радикалы, обладающие сильными окисляющими и, частично, восстанавливающими свойствами, вступают в реакции как с ферментами (весьма чувствительными к излучению оказались ферменты, содержащие сульф- гидрнльную группу SH) и тканевыми белками, так и между собой, что приводит к подавлению активности важнейших ферментных систем, нарушению обменных процессов, в частности синтезу нуклеопротеидов и нуклеиновых кислот, и накоплению новых химических веществ, несвойственных организму в нормальных условиях его жизнедеятельности. Этому механизму непрямого (через ионизацию воды) действия излучения придается основное значение. Однако под влиянием больших доз наблюдается и прямое действие радиации на молекулы белка. В этом смысле определенное значение приобретает так называемая денатурация белка. Денатурированная белковая молекула коагулируется, выпадает из коллоидного раствора и в дальнейшем подвергается распаду под влиянием протеолитических ферментов организма.
При денатурации молекулы белка нарушаются функциональные свойства самой клетки, а при разрушении нескольких молекул может наступить и гибель клетки.
Кроме денатурации белковых молекул, при воздействии ионизирующим излучением наступает и фотолиз их, характеризующийся распадом молекул в результате непосредственного действия радиации. Наконец, под влиянием излучения наступает деполимеризация нуклеопротеидов и прежде всего нуклеиновых кислот, что отражается на жизнедеятельности клетки в целом, на изменении ферментативной деятельности организма.
В последние годы подробно исследовались первичные биохимические изменения, происходящие в клетках и особенно в клеточных ядрах облученного организма (И. И. Иванов и др.). При этом были установлены факты фундаментального значения, свидетельствующие о том, что при облучении закономерно и рано возникают нарушения в сложных системах синтеза ДНК и РНК (нарушения структуры нуклеиновых кислот; изменение активности лизирующнх и репарационных ферментов, регулирующих их обмен, и др.) и в образовании богатых энергией фосфорных соединений (особенно синтеза АТФ). Эти изменения биохимизма ядер морфологически проявляются в виде различных нарушений структуры хромосом. Описываемые изменения уникальных генетических систем и другие биохимические нарушения, развивающиеся в ядрах радиопоражаемых клеток под влиянием облучения, Рассматриваются в большой мере как результат непосредственного воздействия радиации на эти структуры. Вместе с тем, можно полагать, что на течение биохимических процессов в ядрах клеток радиопоражаемых тканей влияют образующиеся радиоток- сины и изменения нервной и гормональной регуляции тканей и клеток.
В организме, возможно, развиваются цепные физико-химиче- кие реакции в сфере белкового и липидного обмена, которые уже
после прекращения воздействия радиации приводят к накоплению несвойственных организму химических веществ (гистаминоподобные вещества, токсические амино- и жирные кислоты), что усиливает биологический эффект воздействия ионизирующего излучения.
Обращаясь к анализу механизмов изменений на физиологическом уровне (третий этап), т. е. в целостном организме, следует отметить, что, по мнению ряда исследователей, ионизирующие излучения как этиологический фактор обладают двоякого рода действием (А. К. Гуськова, П. Д. Горизонтов и др.): специфическим повреждающим в отношении радиочувствительных тканей (органы кроветворения, желудочно-кишечный тракт, гонады и др.) и неспецифическим раздражающим действием по отношению к нейроэндокринной системе.
Поражению органов кроветворения принадлежит ведущее место в патогенезе и клинике лучевой болезни. Кроветворная ткань отличается наибольшей радиопоражаемостью, причем среди клеток системы крови наименее резистентны к облучению лимфоциты всех генераций; высокая чувствительность к радиации характерна также для всех бластных клеток костного мозга (эритробласты, миелобласты, мегакариобласты и др.). Можно считать доказанным, что развивающаяся под влиянием ионизирующих излучений аплазия костного мозга является общим следствием как резкого угнетения митотической активности кроветворной ткани, так и массовой гибели малодифференцированных костномозговых клеток в интерфазе (интеркинетическая гибель). Лучевой панмиело- парез или аплазия костного мозга обусловливают наступление панцитопенни — характерного для лучевой болезни изменения периферической крови. Резкое снижение кроветворения лежит также в основе развития геморрагического синдрома и способствует возникновению инфекционных осложнений при радиационных поражениях.
Изменения, происходящие в клетках различных органов и тканей, а также в жидких средах организма, вызывают раздражения экстеро- и ннтерорецепторов, что приводит к нарушению функции центральной нервной системы. Деятельность нервных центров может и в ранние сроки изменяться под влиянием эндогенных токси ¦ ческих гуморальных раздражителей. При высоких уровнях облучения могут иметь место и структурные поражения элементов центральной нервной системы и ее периферических отделов.
Наступающие нарушения функций высших отделов рефлектор- но приводят к изменениям деятельности внутренних органов и тканей (прежде всего органов кровообращения и желудочно-кишечного тракта). Существенная роль в этом принадлежит также эндокринной системе, в первую очередь гипофиз-надпочечнико- вой системе, далее — щитовидной железе и другим эндокринным органам. Описанные нейроэндокринные и висцеральные изменения правомерно понимать как проявление неспецифического раздражающего действия ионизирующих излучений. К симптомам
этого порядка относят диспептические явления, ангиодистонию, нейтрофильный лейкоцитоз и другие признаки, возникающие в первые часы после облучения. Неспецифическне нейроэндокринные сдвиги играют решающую роль в начале заболевания и затем усугубляют основные нарушения, связанные с непосредственным разрушением радиопоражаемых тканей (особенно органов кроветворения).
С первых часов после облучения в пораженных органах возникают репаративно-регенераторные процессы, которые сосуществуют, таким образом, с процессами структурного поражения. Имеются основания признать, что течение и исход острой лучевой болезни при облучении в интервале от 100 до 1000 р в решающей степени зависят от соотношения темпов деструкции и регенерации в системе кроветворения. Исследованиями последних лет установлено, что процессы регенерации при этом связаны с размножением нелетально пораженных клеток и восстановлением первично пораженных клеток. Недавно была доказана возможность восстановления поврежденного хромосомного комплекса. Пострадиационное восстановление кроветворения ставят в зависимость от сохранившихся стволовых кроветворных элементов. Так, в экспериментах показано, что для выживаемости млекопитающих достаточно сохранение 0,1—0,3% стволовых элементов, имеющихся в костном мозге.
Определенную роль в постлучевом восстановлении кроветворения играют разбросанные по организму депо низкодифференцированных «плюрипотентных» клеток, которых особенно много в ретикулоэндотелиальной системе. Эти депо, играющие роль как бы аварийного запаса кроветворения, могут особенно активизироваться при резко неравномерном облучении.
Следует отметить, что восстановительные процессы в тканях регулируются и стимулируются нейроэндокринной системой и достигают высокого уровня компенсации. Необратимые изменения соответствуют повреждению, вызываемому примерно 10%' полученной дозы. Эта величина, обозначаемая термином «остаточная радиация», лежит в основе соматических и генетических последствий лучевой болезни.
Ниже приводится схема патогенеза лучевой болезни по П. Д. Горизонтову.
Основным морфологическим субстратом острой лучевой болезни являются кровоизлияния и воспалительно-некротические очаги, обнаруживаемые в различных органах, а также — деструктивные изменения и аплазия кроветворной ткани.
При вскрытии трупов людей и животных, погибших от острой лучевой болезни, кровоизлияния обнаруживаются в различных отделах головного и спинного мозга, в сердце, желудочно-кишечном тракте, лимфатических узлах и т. п.
Резкие морфологические изменения наблюдаются во всех органах. Так, структура печени изменяется, нарушается структура печеночных балок, появляется перикапиллярный отек, развивается
жировая дистрофия. Лимфатические узлы сначала уменьшаются в объеме, затем (к концу 1—2-й недели) набухают; в них также наблюдаются кровоизлияния. Микроскопическое исследование костного мозга показывает его опустошение. Осложнение заболевания инфекциями обусловливает развитие соответствующих изменений (воспалительные очаги, некрозы, язвы).
Источник: Н.С Молчанов Е. В. Гембицкий, «ВОЕННО-ПОЛЕВАЯ ТЕРАПИЯ» 1973
А так же в разделе «БИОЛОГИЧЕСКОЕ ДЕЙСТВИЕ ИОНИЗИРУЮЩЕГО ИЗЛУЧЕНИЯ И ПАТОГЕНЕЗ ЛУЧЕВОЙ БОЛЕЗНИ »
- ЗАДАЧИ И СОДЕРЖАНИЕ ВОЕННО-ПОЛЕВОЙ ТЕРАПИИ
- КРАТКИЙ ОБЗОР ИСТОРИИ РАЗВИТИЯ ВОЕННО-ПОЛЕВОЙ терапии
- ОСОБЕННОСТИ ВОЗНИКНОВЕНИЯ, ТЕЧЕНИЯ И ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ ВНУТРЕННИХ ОРГАНОВ В ВОЕННОЕ ВРЕМЯ
- ОРГАНИЗАЦИЯ ТЕРАПЕВТИЧЕСКОЙ ПОМОЩИ ПОРАЖЕННЫМ И БОЛЬНЫМ В ВОЕННОЕ ВРЕМЯ
- Принципы сортировки пораженных и больных терапевтического профиля
- Организация терапевтической помощи пораженным и больным
- Глава II ЗАБОЛЕВАНИЯ ВНУТРЕННИХ ОРГАНОВ, ВЫЗЫВАЕМЫЕ ТРАВМАТИЧЕСКИМИ ПОВРЕЖДЕНИЯМИ И ОЖОГАМИ
- ЗАБОЛЕВАНИЯ ВНУТРЕННИХ ОРГАНОВ У РАНЕНЫХ
- Болезни легких и плевры
- Заболевания почек
- Заболевания системы пищеварения
- Изменения системы крови
- Профилактика и лечение заболеваний внутренних органов
- ЗАБОЛЕВАНИЯ ВНУТРЕННИХ ОРГАНОВ, ВЫЗЫВАЕМЫЕ ВОЗДЕЙСТВИЕМ УДАРНОЙ ВОЛНЫ
- СИНДРОМ ДЛИТЕЛЬНОГО РАЗДАВЛИВАНИЯ
- Глава III ЛУЧЕВАЯ БОЛЕЗНЬ
- ХАРАКТЕРИСТИКА УСЛОВИЙ ОБЛУЧЕНИЯ. ВОПРОСЫ КЛАССИФИКАЦИИ
- ОСТРАЯ ЛУЧЕВАЯ БОЛЕЗНЬ (ПРИ ВНЕШНЕМ ОТНОСИТЕЛЬНО РАВНОМЕРНОМ ОБЛУЧЕНИИ)
- Особенности клиники острой лучевой болезни от внешнего резко неравномерного облучения
- Лечение
- Профилактика
- ДРУГИЕ ОСТРЫЕ ФОРМЫ РАДИАЦИОННЫХ ПОРАЖЕНИИ
- Радиационные поражения, вызванные радиоактивными веществами, проникающими внутрь организма
- ХРОНИЧЕСКАЯ ЛУЧЕВАЯ БОЛЕЗНЬ
- Профилактика и лечение