Анестезиологическое обеспечение реконструктивных и пластических операций с применением микрохирургической техники
В связи с совершенствованием микрохирургической техники, обеспечившим возможность восстановления анатомической целости структур челюстно-лицевой области, стало возможным осуществление свободной пересадки тканей, значительно расширить возможности реконструктивной и пластической хирургии. Это способствовало расширению показаний к оперативным вмешательствам у онкологических больных, у которых отмечается метаболическая нестабильность, ограниченные резервы системы восстановления кровообращения и дыхания после лучевого лечения химиотерапии. В настоящее время они составляют основной контингент больных хирургического стационара, которым показаны восстановительные операции с применением хирургической техники.
Использование современных оптических систем, повысив прециозность хирургических манипуляций, обусловило неизбежное в таких случаях увеличение длительности операций — более 10 ч. (12—14 ч.). Все это заставило по-новому взглянуть на вопросы безопасности оперируемого больного, так как была установлена тесная связь между частотой ятрогенных осложнений анестезии и ее продолжительностью (Светлов В.А., 1989, Derrington А., 1987). Осложнения, возникающие при сверхпродолжи- тельных операциях, связывают с комбинированным наркозом, циркуляторной гипоксией, развивающейся при применении анестетиков, анальгетиков и мышечных релаксантов. Нет единого мнения и по вопросу о выборе метода обезболивания при сверхпродолжительных реконструктивных операциях с применением микротехники.
Предлагаемые в качестве альтернативы нетрадиционные методы обезболивания — злсктромедикаментозная (Сачков В.И.. 1989) и диссоциативная анестезия (Уваров Б.С. и др., 1986), а также региональные блокады (Sada С., 1989) и их комбинации (Светлов В.А., 1989) — в определенной степени позволяют ограничить использование традиционных препаратов селективного действия.
Как уже отмечалось выше, применение разных вариантов электроанестезии при реконструктивных операциях достаточно проблематично, поскольку пока не накоплен опыт, который подтверждал бы их надежность, управляемость и безопасность при наркозах. Большинство анестезиологов испытывают технические трудности при использовании электроанестезии, сохраняются определенные сомнения относительно адаптации к действию электрического тока, его анальгетической активности. Исследователи отмечают загадочность и непредсказуемость «поведения* сосудистого кровотока во время операции, выдвигая это как основную анестезиологическую проблему, связанную с непредсказуемостью вазоспазма, локального и генерализованного, ответственного за состояние кровотока в пересаживаемых тканях. До сих пор ведутся поиски путей оптимизации периферического и центрального кровотока посредством разработки рациональных инфузионных программ с управляемой гемодилюцией.
Генерализованная вазоконстрикция сосудов, развивающаяся при длительных операциях, ограничивает периферический кровоток при длительных операциях, увеличивает теплопотери, возрастающие по мере увеличения продолжительности наркоза.
Выбор метода анестезии определяется локализацией восстанавливаемого участка в области головы и шеи, состоянием донорского и реципиентского ложа. В анамнезе больных, которым предстояло выполнить реконструктивную операцию, чаще всего отмечались оперативные вмешательства по поводу онкологических заболеваний, неоднократные безуспешные попытки произвести пластику, нарушения кровообращения в зоне реципиентных тканей. Методику анестезии в каждом конкретном случае выбирают в зависимости от соматического состояния больного и наличия противопоказаний к применению того или иного
метода обезболивания. В связи с длительностью операций, наличием нескольких операционных полей и высокой травматичностью вмешательств естественно ожидать увеличение риска возникновения осложнений и побочных эффектов фармакологических препаратов и ИВЛ.
С учетом общего состояния больного, сопутствующей соматической патологии и локализации процесса при проведении операции с применением микрохирургической техники используют следующую схему анестезии, которая может быть изменена в зависимости от поставленной задачи: комбинированный наркоз на основе препаратов НЛА (фентанил, дроперидол, газонаркотическая смесь закиси азота и кислорода в соотношении 3:1).
Для вводной анестезии мы применяли тиопентал натрия (до 1000 мг) или калипсол (0,5 мг/кг в 1 ч.). Релаксации мускулатуры добивались с помощью тубокурарина. Искусственную вентиляцию легких проводили в режиме нормовентиляции (РС02 33—40 мм рт. ст.). У всех больных стремились к достижению умеренной гиперволеми- ческой гемодилюции (гематокрит 30). Инфузионную терапию осуществляли с помощью коллоидных и кристалле- идных растворов, белковых препаратов и аминокислот, 5—10 % раствора альбумина. Для поддержания анестезии использовали препараты НЛА, комбинированный калип- соловый наркоз или электромедикаментозную анестезию. Электроимпульсное воздействие на центральную нервную систему проводили на фоне препаратов селективного действия (анальгетики, релаксанты, нейролептики).
Региональные методы анестезии можно применять как самостоятельные варианты или как базисные в схеме сбалансированной медикаментозной анестезии. Продолжительность анестезии зависит от хирургической техники и тактической схемы наркоза, при проведении которого анестезиологу приходится мириться с введением не безразличных для больного непато- и церебротоксических компонентов. В связи с этим актуальной задачей является разработка трансцеребрального электровоздействия, способного заменить наркотические анальгетики в схеме комбинированной аналгезии. Использование с этой целью трасцеребрального электровоздействия токами Лиможа (комбинированные монополярные импульсы) подтвер
ждает реальность аналгезирующего действия электроанестезии. В связи с этим появилась возможность практически в 2 раза снизить расход наркотических анальгетиков и уменьшить опасность центральной депрессии, связанной с их длительным применением (Кузин М.И. и др., 1974). При изучении системы кровообращения и функции пересаживаемого лоскута доказано, что на микрохирургическом этапе (5—6 ч. операции) в условиях минимальной операционной травмы при электронаркозе появляется возможность отказаться от анальгетиков, переориентируясь на центральные и периферические эффекты субтера- певтических доз кетамина. При этом наблюдается положительная динамика сократительной способности миокарда и показателей насосной функции сердца (УО, МОК), значительно реже возникают эпизоды гипертензии и тахикардии, позволяющие заподозрить неадекватность анестезиологической защиты при электроанестезии (Бунятян А.А. и др., 1977; Светлов В.А., 1989).
Генерализованная вазоконстрикция в конце операции часто возникает не только при продолжительном наркозе. Особенностью операций с применением микрохирургической техники является неадекватный кровоток в пересаженном лоскуте, а умеренная гипертермия (37"С) к моменту реваскуляризации положительно отражается на кровотоке. Изучив эти особенности, в частности характер вазоспазма, исследователи выявили их прямую коррелятивную связь с нарушением теплорегуляции и теплопродукции при продолжительном наркозе. Установлено, что длительные микрохирургические операции сопровождаются избыточной потерей тепла, это приводит к возникновению генерализованного вазоспазма и влияет на кровоток пересаженного сосудистого лоскута.
Наиболее эффективный способ предупреждения теп- лопотерь — активное согревание больного на операционном столе с помощью одеяла или специального матраса с подогревом. Важным моментом, способствующим сохранению тепла в организме и снижению теплопотерь, является применение увлажнителя для согревания дыхательной смеси, встроенного в наркозный аппарат, или специальной приставки к нему.
Из наркотических средств благоприятное воздействие на кровоток в лоскуте оказывает калипсол в субнарко- тических дозах, который обеспечивает вазодилатирую- щий эффект в период пробуждения на фоне теплового баланса периферических тканей. Калипсол известен также, как наркотическое средство, вызывающее увеличение кровообращения на 25—39 %.
В настоящее время освоение сложных микрохирургических подходов идет успешнее, чем развитие анестезиологического обеспечения, при котором все еще высок риск возникновения осложнений, а «поведение» и судьбу пересаженных тканей в области головы не всегда можно предвидеть. При анализе осложнений установлена тесная взаимосвязь между локализацией, скоростью кровотока через анастамоз и теми неудачами, которые встречаются при выполнении микрохирургических операций в области головы, выявлено специфическое влияние аутотрансплантата на гомеостаз, отмечено усилие неблагоприятных рефлекторных реакций со стороны пересаженного лоскута, а также рефлекторно-гуморальное воздействие крови, притекающей через лоскут к мозгу. Одним из факторов, ведущих к повреждению функциональной способности мозга, являются особенности кровотока и обменных перестроек, происходящих в реконструированных тканях в области верхней и средней зон лица. Перемещенный с другого участка тела лоскут с осевым кровотоком фиксируют в подготовленном ложе, чаще в средней зоне лица, точнее на верхней челюсти, в непосредственной близости от основной кости, на которой в области турецкого седла располагается гипофиз. Многочасовые операции и наличие пересаженного лоскута способствуют развитию токсикоза в тканях головы с последующим всасыванием продуктов аутолиза ишемизированных тканей. Возникает реальная угроза того, что содержимое операционной раны вместе с продуктами секретирующего лоскута через сосудистую сеть головы попадет непосредственно в мозг.
Известно, что кости черепа служат препятствием для проникновения раневого содержимого через гематоэнце- фалический барьер (ГЭБ). Постулируя феномен проникновения субстратов крови из операционной раны на голове в
мозг через гематоэнцефалический барьер, М.Бредбери (1979) практически исключал такую возможность, считая, что для этого необходимы нарушение целости костных тканей, измененный градиент и высокая скорость кровотока. Проникновение через ГЭБ в силу анатомических особенностей черепа невозможно, за исключением участка средней зоны лица по линии проекции гипофиза, где часть основной кости практически проницаема для крови. М.Бредбери считает, что в стрессовых ситуациях секрет гипофиза должен быстро и беспрепятственно попадать в сосудистое русло. При хирургической операции проникновению субстратов способствует не только уязвимость этого участка ГЭБ, но также изменение скорости кровотока, увеличивается потребность мозга в кислороде.
Очевидно, что при любом операционном или травматическом повреждении увеличивается потребность мозга в кислороде. В отличие от мозга соотношение количества потребляемого кислорода и скорости кровотока для печени ухудшается, что и может привести к ее гипоксии, которая прогрессирует пропорционально длительности анестезии (Грицук С.Ф., 1981). Продолжительная анестезия приводит к перестройке обмена по пути анаэробного гликолиза, наименее эффективному для организма, способствуя увеличению потребности в энергии, и сопровождается перекисным окислением липидов, повышением клеточной и мембранной проницаемости. Циркуляторная гипоксия, неизбежно развивающаяся при продолжительном наркозе, и наличие раневой поверхности в непосредственной близости от мозга могут привести к нарушению ГЭБ, анок- сическому повреждению клеточных мембран мозговой ткани и последующему отеку мозга. Развивающийся отек вначале имеет вазогенный характер, а в последующем переходит в цитотоксический, сопровождаясь гибелью клеточных элементов. Изучение содержания аминокислот пролин, лейцин, изолейцин в плазме крови, оттекающей от мозга, показало, что их дефицит нарастал по мере увеличения продолжительности анестезии. При этом концентрация глюкозы и аммиака к концу операции повышалась в 4 раза по сравнению с дооперационным уровнем. В плазме крови, оттекающей от печени, наблюдалось увеличение концентрации аммиака, лейцина, изолейцина, что свиде
тельствовало о снижении функциональной способности печени по утилизации эссенциальных аминокислот и ингибировании обменных процесов во время операции (рис. 24).
Снижение концентрации эссенциальных аминокислот с разветвленной цепью в крови, оттекающей от мозга, и активности расщепляющих ферментов в печени — решающие патогенетические факторы энцефалопатии. Данные Gerok W. (1984), изучавшего метаболизм аминокис-
х 10’ мкмоль/мл
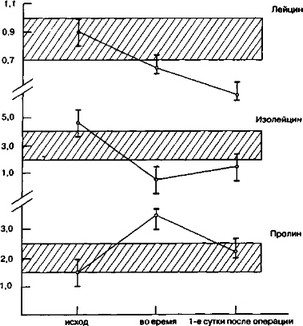
Рис 24 Свободные аминокислоты в крови яремной вены при длительной общей анестезии (М ± гл)
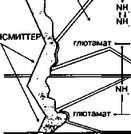
лот в мозге, свидетельствуют о том, что нарушение их баланса проявляется конкуренцией в области ГЭБ двух групп аминокислот: с разветвленной цепью и ароматических (фенилаланин, тирозин, триптофан). Мозг способен быстро метаболизировать аминокислоты с разветвленной цепью, преимущественно в астроцитах, с образованием глутамата, который, соединяясь с аммиаком, поступает в систему нейрона, образуя новоструктурные нейротрансмиттеры (рис. 25). Длительный наркоз способствует снижению церебральной утилизации глюкозы и накоплению аммиака в мозге, в результате чего изменяются схемы незаменимых аминокислот. Вследствие нарушений в нейротрансмиттерной системе мозга резко уменьшается образование новых трансмиттеров (Gerok W., 1984).
Операционное повреждение тканей в области средней зоны лица и нарушение проницаемости ГЭБ приводят к соединению раневого кровотока с кровообращением мозга. В результате этого в сосудистое русло мозга попадают обменные субстраты операционной раны, тромбопластический материал и обломки метаболитов, что может привести сначала к латентно протекающей энцефалопатии, а
 АСТРОЦИТ
АСТРОЦИТ
Рис 25 Обмен аминокислот в головном мозгу (по Герок В , 1984)
в последующем к повреждению и отеку мозга. Сочетание дефицита аминокислот и аммиачной интоксикации отрицательно сказывается на церебральном обмене, препятствуя процессам аэробного гликолиза в цикле Кребса. Это приводит к потере саморегуляции мозгового кровообращения, повреждению центральных механизмов регуляции и несостоятельности адаптационных реакций в ответ на операционную травму. На этом фоне возникают вторичные гемодинамические и биохимические расстройства, сопровождающиеся нарушением функций жизненно важных органов и систем. Образующийся дефицит пластического и энергетического материала приводит к тому, что ионные градиенты и мембранный потенциал не могут поддерживаться на необходимом уровне, уменьшаются перенос продуктов обмена (аминокислоты, витамины) и выведение не- доокисленных метаболитов (лактат). Все это обусловливает необходимость коррекции метаболических потребностей и осуществления интенсивной терапии с целью обеспечения газообмена и сердечного выброса, поддержания ОЦК. Комплексная схема лечебно-профилактических мероприятий при длительном наркозе включает введение препаратов, снижающих энергетические потребности мозга, анти- гипоксантов, средств, улучшающих микроциркуляцию и метаболические процессы в клетках мозга (ноотрапы, мадопар, наком), мембраносохраняющих препаратов (гор- доке, контрикал). Планомерное осуществление сбалансированного искусственного питания (парентерального и энтерального) обеспечивает организм субстратом окисления, дефицитными незаменимыми аминокислотами и энергетическим материалом.
Заслуживают внимания предлагаемые В.А.Светло- вым (1989) меры по оптимизации периферического кровообращения и увеличению жизнеспособности приживляемых тканей с помощью рациональной инфузионной терапии, требованиям которой в наибольшей степени отвечает терапия коллоидными, кристаллоидными растворами и препаратами плазмы. В послеоперационном периоде наряду с гемодилюцией целесообразно поддержание в физиологических пределах электролитного и белкового состава крови, необходимого для обеспечения нормального кровообращения в трансплантате.
Для успешного выполнения продолжительных реконструктивных и пластических операций с применением микрохирургической техники необходимо организовать специальное анестезиологическое обеспечение и предпринять меры для повышения безопасности больных. Затруднения, возникающие при проведении анестезии и интенсивной терапии обусловлены: повреждением центральных механизмов регуляции метаболических процессов и несостоятельностью адаптационных реакций в ответ на операцию; продолжительным фиксированным положением больного на операционном столе; наведенной гипотермией или гипертермией центрального происхождения; значительными потерями жидкости при продолжительном наркозе; ишемией трансплантата и развитием синдрома его отторжения; явлениями циркуляторной и тканевой гипоксии.
Среди причин типичных ятрогенных анестезиологических осложнений следует отметить отсутствие у анестезиолога опыта выполнения микрохирургических вмешательств, усталость, смену анестезиологических бригад во время продолжительных операций.
Использование современных оптических систем, повысив прециозность хирургических манипуляций, обусловило неизбежное в таких случаях увеличение длительности операций — более 10 ч. (12—14 ч.). Все это заставило по-новому взглянуть на вопросы безопасности оперируемого больного, так как была установлена тесная связь между частотой ятрогенных осложнений анестезии и ее продолжительностью (Светлов В.А., 1989, Derrington А., 1987). Осложнения, возникающие при сверхпродолжи- тельных операциях, связывают с комбинированным наркозом, циркуляторной гипоксией, развивающейся при применении анестетиков, анальгетиков и мышечных релаксантов. Нет единого мнения и по вопросу о выборе метода обезболивания при сверхпродолжительных реконструктивных операциях с применением микротехники.
Предлагаемые в качестве альтернативы нетрадиционные методы обезболивания — злсктромедикаментозная (Сачков В.И.. 1989) и диссоциативная анестезия (Уваров Б.С. и др., 1986), а также региональные блокады (Sada С., 1989) и их комбинации (Светлов В.А., 1989) — в определенной степени позволяют ограничить использование традиционных препаратов селективного действия.
Как уже отмечалось выше, применение разных вариантов электроанестезии при реконструктивных операциях достаточно проблематично, поскольку пока не накоплен опыт, который подтверждал бы их надежность, управляемость и безопасность при наркозах. Большинство анестезиологов испытывают технические трудности при использовании электроанестезии, сохраняются определенные сомнения относительно адаптации к действию электрического тока, его анальгетической активности. Исследователи отмечают загадочность и непредсказуемость «поведения* сосудистого кровотока во время операции, выдвигая это как основную анестезиологическую проблему, связанную с непредсказуемостью вазоспазма, локального и генерализованного, ответственного за состояние кровотока в пересаживаемых тканях. До сих пор ведутся поиски путей оптимизации периферического и центрального кровотока посредством разработки рациональных инфузионных программ с управляемой гемодилюцией.
Генерализованная вазоконстрикция сосудов, развивающаяся при длительных операциях, ограничивает периферический кровоток при длительных операциях, увеличивает теплопотери, возрастающие по мере увеличения продолжительности наркоза.
Выбор метода анестезии определяется локализацией восстанавливаемого участка в области головы и шеи, состоянием донорского и реципиентского ложа. В анамнезе больных, которым предстояло выполнить реконструктивную операцию, чаще всего отмечались оперативные вмешательства по поводу онкологических заболеваний, неоднократные безуспешные попытки произвести пластику, нарушения кровообращения в зоне реципиентных тканей. Методику анестезии в каждом конкретном случае выбирают в зависимости от соматического состояния больного и наличия противопоказаний к применению того или иного
метода обезболивания. В связи с длительностью операций, наличием нескольких операционных полей и высокой травматичностью вмешательств естественно ожидать увеличение риска возникновения осложнений и побочных эффектов фармакологических препаратов и ИВЛ.
С учетом общего состояния больного, сопутствующей соматической патологии и локализации процесса при проведении операции с применением микрохирургической техники используют следующую схему анестезии, которая может быть изменена в зависимости от поставленной задачи: комбинированный наркоз на основе препаратов НЛА (фентанил, дроперидол, газонаркотическая смесь закиси азота и кислорода в соотношении 3:1).
Для вводной анестезии мы применяли тиопентал натрия (до 1000 мг) или калипсол (0,5 мг/кг в 1 ч.). Релаксации мускулатуры добивались с помощью тубокурарина. Искусственную вентиляцию легких проводили в режиме нормовентиляции (РС02 33—40 мм рт. ст.). У всех больных стремились к достижению умеренной гиперволеми- ческой гемодилюции (гематокрит 30). Инфузионную терапию осуществляли с помощью коллоидных и кристалле- идных растворов, белковых препаратов и аминокислот, 5—10 % раствора альбумина. Для поддержания анестезии использовали препараты НЛА, комбинированный калип- соловый наркоз или электромедикаментозную анестезию. Электроимпульсное воздействие на центральную нервную систему проводили на фоне препаратов селективного действия (анальгетики, релаксанты, нейролептики).
Региональные методы анестезии можно применять как самостоятельные варианты или как базисные в схеме сбалансированной медикаментозной анестезии. Продолжительность анестезии зависит от хирургической техники и тактической схемы наркоза, при проведении которого анестезиологу приходится мириться с введением не безразличных для больного непато- и церебротоксических компонентов. В связи с этим актуальной задачей является разработка трансцеребрального электровоздействия, способного заменить наркотические анальгетики в схеме комбинированной аналгезии. Использование с этой целью трасцеребрального электровоздействия токами Лиможа (комбинированные монополярные импульсы) подтвер
ждает реальность аналгезирующего действия электроанестезии. В связи с этим появилась возможность практически в 2 раза снизить расход наркотических анальгетиков и уменьшить опасность центральной депрессии, связанной с их длительным применением (Кузин М.И. и др., 1974). При изучении системы кровообращения и функции пересаживаемого лоскута доказано, что на микрохирургическом этапе (5—6 ч. операции) в условиях минимальной операционной травмы при электронаркозе появляется возможность отказаться от анальгетиков, переориентируясь на центральные и периферические эффекты субтера- певтических доз кетамина. При этом наблюдается положительная динамика сократительной способности миокарда и показателей насосной функции сердца (УО, МОК), значительно реже возникают эпизоды гипертензии и тахикардии, позволяющие заподозрить неадекватность анестезиологической защиты при электроанестезии (Бунятян А.А. и др., 1977; Светлов В.А., 1989).
Генерализованная вазоконстрикция в конце операции часто возникает не только при продолжительном наркозе. Особенностью операций с применением микрохирургической техники является неадекватный кровоток в пересаженном лоскуте, а умеренная гипертермия (37"С) к моменту реваскуляризации положительно отражается на кровотоке. Изучив эти особенности, в частности характер вазоспазма, исследователи выявили их прямую коррелятивную связь с нарушением теплорегуляции и теплопродукции при продолжительном наркозе. Установлено, что длительные микрохирургические операции сопровождаются избыточной потерей тепла, это приводит к возникновению генерализованного вазоспазма и влияет на кровоток пересаженного сосудистого лоскута.
Наиболее эффективный способ предупреждения теп- лопотерь — активное согревание больного на операционном столе с помощью одеяла или специального матраса с подогревом. Важным моментом, способствующим сохранению тепла в организме и снижению теплопотерь, является применение увлажнителя для согревания дыхательной смеси, встроенного в наркозный аппарат, или специальной приставки к нему.
Из наркотических средств благоприятное воздействие на кровоток в лоскуте оказывает калипсол в субнарко- тических дозах, который обеспечивает вазодилатирую- щий эффект в период пробуждения на фоне теплового баланса периферических тканей. Калипсол известен также, как наркотическое средство, вызывающее увеличение кровообращения на 25—39 %.
В настоящее время освоение сложных микрохирургических подходов идет успешнее, чем развитие анестезиологического обеспечения, при котором все еще высок риск возникновения осложнений, а «поведение» и судьбу пересаженных тканей в области головы не всегда можно предвидеть. При анализе осложнений установлена тесная взаимосвязь между локализацией, скоростью кровотока через анастамоз и теми неудачами, которые встречаются при выполнении микрохирургических операций в области головы, выявлено специфическое влияние аутотрансплантата на гомеостаз, отмечено усилие неблагоприятных рефлекторных реакций со стороны пересаженного лоскута, а также рефлекторно-гуморальное воздействие крови, притекающей через лоскут к мозгу. Одним из факторов, ведущих к повреждению функциональной способности мозга, являются особенности кровотока и обменных перестроек, происходящих в реконструированных тканях в области верхней и средней зон лица. Перемещенный с другого участка тела лоскут с осевым кровотоком фиксируют в подготовленном ложе, чаще в средней зоне лица, точнее на верхней челюсти, в непосредственной близости от основной кости, на которой в области турецкого седла располагается гипофиз. Многочасовые операции и наличие пересаженного лоскута способствуют развитию токсикоза в тканях головы с последующим всасыванием продуктов аутолиза ишемизированных тканей. Возникает реальная угроза того, что содержимое операционной раны вместе с продуктами секретирующего лоскута через сосудистую сеть головы попадет непосредственно в мозг.
Известно, что кости черепа служат препятствием для проникновения раневого содержимого через гематоэнце- фалический барьер (ГЭБ). Постулируя феномен проникновения субстратов крови из операционной раны на голове в
мозг через гематоэнцефалический барьер, М.Бредбери (1979) практически исключал такую возможность, считая, что для этого необходимы нарушение целости костных тканей, измененный градиент и высокая скорость кровотока. Проникновение через ГЭБ в силу анатомических особенностей черепа невозможно, за исключением участка средней зоны лица по линии проекции гипофиза, где часть основной кости практически проницаема для крови. М.Бредбери считает, что в стрессовых ситуациях секрет гипофиза должен быстро и беспрепятственно попадать в сосудистое русло. При хирургической операции проникновению субстратов способствует не только уязвимость этого участка ГЭБ, но также изменение скорости кровотока, увеличивается потребность мозга в кислороде.
Очевидно, что при любом операционном или травматическом повреждении увеличивается потребность мозга в кислороде. В отличие от мозга соотношение количества потребляемого кислорода и скорости кровотока для печени ухудшается, что и может привести к ее гипоксии, которая прогрессирует пропорционально длительности анестезии (Грицук С.Ф., 1981). Продолжительная анестезия приводит к перестройке обмена по пути анаэробного гликолиза, наименее эффективному для организма, способствуя увеличению потребности в энергии, и сопровождается перекисным окислением липидов, повышением клеточной и мембранной проницаемости. Циркуляторная гипоксия, неизбежно развивающаяся при продолжительном наркозе, и наличие раневой поверхности в непосредственной близости от мозга могут привести к нарушению ГЭБ, анок- сическому повреждению клеточных мембран мозговой ткани и последующему отеку мозга. Развивающийся отек вначале имеет вазогенный характер, а в последующем переходит в цитотоксический, сопровождаясь гибелью клеточных элементов. Изучение содержания аминокислот пролин, лейцин, изолейцин в плазме крови, оттекающей от мозга, показало, что их дефицит нарастал по мере увеличения продолжительности анестезии. При этом концентрация глюкозы и аммиака к концу операции повышалась в 4 раза по сравнению с дооперационным уровнем. В плазме крови, оттекающей от печени, наблюдалось увеличение концентрации аммиака, лейцина, изолейцина, что свиде
тельствовало о снижении функциональной способности печени по утилизации эссенциальных аминокислот и ингибировании обменных процесов во время операции (рис. 24).
Снижение концентрации эссенциальных аминокислот с разветвленной цепью в крови, оттекающей от мозга, и активности расщепляющих ферментов в печени — решающие патогенетические факторы энцефалопатии. Данные Gerok W. (1984), изучавшего метаболизм аминокис-
х 10’ мкмоль/мл

Рис 24 Свободные аминокислоты в крови яремной вены при длительной общей анестезии (М ± гл)
лот в мозге, свидетельствуют о том, что нарушение их баланса проявляется конкуренцией в области ГЭБ двух групп аминокислот: с разветвленной цепью и ароматических (фенилаланин, тирозин, триптофан). Мозг способен быстро метаболизировать аминокислоты с разветвленной цепью, преимущественно в астроцитах, с образованием глутамата, который, соединяясь с аммиаком, поступает в систему нейрона, образуя новоструктурные нейротрансмиттеры (рис. 25). Длительный наркоз способствует снижению церебральной утилизации глюкозы и накоплению аммиака в мозге, в результате чего изменяются схемы незаменимых аминокислот. Вследствие нарушений в нейротрансмиттерной системе мозга резко уменьшается образование новых трансмиттеров (Gerok W., 1984).
Операционное повреждение тканей в области средней зоны лица и нарушение проницаемости ГЭБ приводят к соединению раневого кровотока с кровообращением мозга. В результате этого в сосудистое русло мозга попадают обменные субстраты операционной раны, тромбопластический материал и обломки метаболитов, что может привести сначала к латентно протекающей энцефалопатии, а
 АСТРОЦИТ
АСТРОЦИТ
Рис 25 Обмен аминокислот в головном мозгу (по Герок В , 1984)
в последующем к повреждению и отеку мозга. Сочетание дефицита аминокислот и аммиачной интоксикации отрицательно сказывается на церебральном обмене, препятствуя процессам аэробного гликолиза в цикле Кребса. Это приводит к потере саморегуляции мозгового кровообращения, повреждению центральных механизмов регуляции и несостоятельности адаптационных реакций в ответ на операционную травму. На этом фоне возникают вторичные гемодинамические и биохимические расстройства, сопровождающиеся нарушением функций жизненно важных органов и систем. Образующийся дефицит пластического и энергетического материала приводит к тому, что ионные градиенты и мембранный потенциал не могут поддерживаться на необходимом уровне, уменьшаются перенос продуктов обмена (аминокислоты, витамины) и выведение не- доокисленных метаболитов (лактат). Все это обусловливает необходимость коррекции метаболических потребностей и осуществления интенсивной терапии с целью обеспечения газообмена и сердечного выброса, поддержания ОЦК. Комплексная схема лечебно-профилактических мероприятий при длительном наркозе включает введение препаратов, снижающих энергетические потребности мозга, анти- гипоксантов, средств, улучшающих микроциркуляцию и метаболические процессы в клетках мозга (ноотрапы, мадопар, наком), мембраносохраняющих препаратов (гор- доке, контрикал). Планомерное осуществление сбалансированного искусственного питания (парентерального и энтерального) обеспечивает организм субстратом окисления, дефицитными незаменимыми аминокислотами и энергетическим материалом.
Заслуживают внимания предлагаемые В.А.Светло- вым (1989) меры по оптимизации периферического кровообращения и увеличению жизнеспособности приживляемых тканей с помощью рациональной инфузионной терапии, требованиям которой в наибольшей степени отвечает терапия коллоидными, кристаллоидными растворами и препаратами плазмы. В послеоперационном периоде наряду с гемодилюцией целесообразно поддержание в физиологических пределах электролитного и белкового состава крови, необходимого для обеспечения нормального кровообращения в трансплантате.
Для успешного выполнения продолжительных реконструктивных и пластических операций с применением микрохирургической техники необходимо организовать специальное анестезиологическое обеспечение и предпринять меры для повышения безопасности больных. Затруднения, возникающие при проведении анестезии и интенсивной терапии обусловлены: повреждением центральных механизмов регуляции метаболических процессов и несостоятельностью адаптационных реакций в ответ на операцию; продолжительным фиксированным положением больного на операционном столе; наведенной гипотермией или гипертермией центрального происхождения; значительными потерями жидкости при продолжительном наркозе; ишемией трансплантата и развитием синдрома его отторжения; явлениями циркуляторной и тканевой гипоксии.
Среди причин типичных ятрогенных анестезиологических осложнений следует отметить отсутствие у анестезиолога опыта выполнения микрохирургических вмешательств, усталость, смену анестезиологических бригад во время продолжительных операций.
Источник: Грицук С.Ф., «Анестезия в стоматологии» 1998
А так же в разделе « Анестезиологическое обеспечение реконструктивных и пластических операций с применением микрохирургической техники »
- Особенности анестезиологического обеспечения
- Анестезия в хирургии опухолей челюстно-лицевой области
- Анестезия у больных с деформациями черепно-лицевой области
- Обезболивание у больных с воспалительными заболеваниями челюстно-лицевой области
- Анестезиологическое обеспечение операций у больных пожилого и старческого возраста
- Хирургический стресс. Концепция адекватности анестезии и метаболической защиты пациента при реконструктивных операциях на лицевом и мозговом черепе
- ПОСЛЕОПЕРАЦИОННАЯ ИНТЕНСИВНАЯ ТЕРАПИЯ
- Профилактика и лечение дыхательной недостаточности
- Поддержание эффективной гемодинамики
- Метаболическая коррекция (трансфузионная терапия, парентеральное и энтеральное питание)
- Интенсивная терапия у больных с острыми воспалительными заболеваниями челюстно-лицевой области
- Принципы трансфузионной терапии больных с флегмонами челюстно-лицевой области