Метаболическая коррекция (трансфузионная терапия, парентеральное и энтеральное питание)
У наблюдавшихся нами больных увеличение отека в области операционной раны достигало максимума к 5— 6-м суткам после вмешательства и часто было связано не только с наличием раны, но и с перераспределением воды, белка и электролитов в организме. В плазме крови и моче наблюдалось увеличение выделения калия и задержка натрия, что свидетельствовало об изменении их соотношения по сравнению с дооперационным периодом. Диурез в 1-е сутки был равен + 0,41 мл/кг, что расценивали как приспособительную реакцию, возникавшую в ответ на операционную травму.
Одними из основных причин дефицита калия в послеоперационном периоде являются катаболическая реакция и дефицит клеточных белков, обусловленный уменьшением их поступления с пищей. Послеоперационное усиление основного обмена в ответ на стрессовую реакцию — оперативное вмешательство — активизирует распад не только белков, но и углеводов.
При любых травматичных вмешательствах, как правило, отмечаются значительные потери азота в послеоперационном периоде. По нашим данным, в первые сутки после остеотомии верхней и нижней челюсти потери азота
составили 18 г, что в пересчете на белок составляет свыше 120 гили 475 г мышечной ткани. В белке содержится 16— 17 % а.юта, т.е. 1 г азота соответствует 6,25 г белка (в мышечной ткани содержится 25 % белка).
С 1-го дня голодания организм человека утилизирует структурный белок мышцы внутренних органов. Это приводит к нарушению регуляции обмена веществ, главным образом в печени. В 1-е сутки снижается синтез альбумина в печени, происходит снижение коллоидно-осмотичес- кого давления и водоудерживающей функции плазмы крови. При полном или частичном белковом голодании печень может потерять до 40 % белков. В то же время в ней происходит накопление жира, в результате чего ухудшается ее функциональное состояние, тормозится деятельность ферментных систем печени, осуществляющих синтез аминокислот. Таким образом, состояние процессов метаболизма в крови, оттекающей от печени, раскрывает сущность и динамику процессов, происходящих в органе после операции. Состояние кровотока в органах спланхни- ческого бассейна при проведении реконструктивных операций на костях черепа является важным показателем адекватности обмена в зависимости от функционального состояния печени, системного и регионального кровотока.
Исследования, проведенные нами у 48 больных, перенесших реконструктивные операции в черепно-лицевой области, позволили выявить нарушения обмена в послеоперационном периоде. У больных изучены биохимические показатели артериальной крови и крови в печеночной вене. Больные в возрасте от 18 до 38 лет были распределены на две группы: первая группа практически здоровые лица с косметическим дефектом челюстей, которым были проведены реконструктивные операции на челюстях; вторая группа — больные, перенесшие сложные реконструктивные операции в средней зоне лица и остеотомии с внутричерепным доступом. В послеоперационном периоде биохимические показатели крови, оттекающей от печени, претерпевали значительные изменения. В условиях целостного организма такой подход позволяет сделать вывод о состоянии обменных процессов в послеоперационном периоде.
У соматически здоровых пациентов (первая группа) снижение кровотока в печени после оперативного вмеша
тельства не приводило к изменению ее функциональной активности. У больных второй группы в послеоперационном периоде отмечались ухудшения показателей кровообращения, уменьшение систолического объема и минутного объема кровообращения, тахикардия. Травматичная операция и уменьшение ОЦК провоцировали возникновение патологических реакций со стороны рефлексогенных зон основания черепа, сопровождавшихся критическим повышением или снижением артериального давления, нарушением ритма сердца.
Возмещение кровопотери, составляющей в среднем 80 % ОЦК, проводили плазмозаменителями, свежецит- ратной кровью, эритроцитной массой в количествах до 80 % от объема утраченного ОЦК.
В послеоперационном периоде оксигенация крови в печеночной вене была достоверно ниже, чем в артериальной крови (см. табл. 3). Концентрация фибриногена в крови, оттекающей от печени, была значительно выше исходного уровня. Установлено, что артерио-венозная разница по кислороду крови, оттекающей от печени, резко возраставшая во время операции, постепенно стабилизировалась, но не достигла исходного уровня. По нашему мнению, этот факт объясняется снижением насыщения крови кислородом у больных второй группы, что свидетельствует о несоответствии между энергетическими затратами и кровотоком в печени. Нарушение газообмена в печени и изменения скорости кровотока в ней находят свое выражение в изменении обмена белка и нарушении синтеза аминокислот. Начиная с 1-х суток послеоперационного периода у больных наблюдаются отрицательный азотистый баланс, снижение концентрации белка, увеличение экскреции азота мочевины, уменьшение коэффициента А/Г. Закономерным отражением белковой недостаточности явилось изменение аминокислотного спектра в организме. В плазме увеличивалась концентрация аммиака, в моче содержание аммиака уменьшалось до 90 % по сравнению с дооперационным уровнем. Дефицит пластических и энергетических резервов вызывал ухудшение общего состояния больных и замедление репаративных процессов в ране. Из изложенного выше следует, что при лечении больного ботьшое значение имеют рациональное питание
и введение в организм дефицитных субстратов, обеспечить которыми больных в послеоперационном периоде естественным способом не представляется возможным (Silberman Н. et al., 1982).
Таким образом, результаты хирургической операции в области лицевого и мозгового черепа в значительной степени зависят от эффективности послеоперационной интенсивной терапии, которая нередко принимает характер реанимационных мероприятий. Приводим наблюдение, иллюстрирующее характер терапии после операции.
Больной Т., 35 лет, поступил в клинику с диагнозом: сочетанная деформация челюстей (верхняя микрогнатия и нижняя макрогнатия), синдром удлиненного лица.
Операция: плоскостная двусторонняя остеотомия нижней челюсти, остеотомия верхней челюсти по Безрукову, гениопластика.
Комбинированный эндотрахеальный наркоз: фента- нил, дроперидол, закись азота с кислородом, интубация трахеи через нос под контролем прямой ларингоскопии. В условиях нейролептаналгезии и ИВЛ проведена остеотомия верхней челюсти, двухсторонняя остеотомия нижней челюсти, гениопластика. Все оперативные вмешательства выполнены последовательно. Анестезия протекала гладко, продолжительность наркоза 4 ч. 35 мин. По ходу операции проводили управляемую гемодилюцию с использованием коллоидных и кристаллоидных растворов, аутогемотрансфузию (800 мл). Операционная кровопотеря составила 1 л 200 мл. По ходу операции перелито 800 мл поли- глюкина, 800 мл реополиглюкина, 400 мл лактасола, 800 мл аутокрови. К концу операции дефицит ОЦК составил более 20 % от расчетной нормы.
После пробуждения и восстановления спонтанного дыхания больной доставлен в послеоперационную палату, где за ним проводили мониторное динамическое наблюдение. Несмотря на тампонаду носовых ходов, выполненную с целью гемостаза, отмечено подтекание крови из носоглотки. Проведена задняя и передняя тампонада.
Спустя 2 ч. 50 мин. в момент осмотра больного отмечаются бледность кожных покровов, цианоз губ, дыхание поверхностное, не адекватно. В полости рта большое количество крови, пульсация на периферических сосудах от
сутствует, тоны сердца не выслушиваются. Незамедлительно начаты реанимационные мероприятия: удаление крови и сгустков из полости рта для обеспечения свободной проходимости верхних дыхательных путей; аппаратная вентиляция легких, закрытый массаж сердца (аппарат РО-6, минутный объем вентиляции 13 л/мин, дыхательный объем 750 мл, кислород 100 %; трансфузионная терапия с целью поддержания необходимого ОЦК и центральной гемодинамики. В подключичную вену введено 1 мл адреналина и 1 мл атропина. Спустя 2 мин. после начала реанимационных мероприятий кровообращение было восстановлено, АД 140/90 мм рт. ст., пульс 115 в минуту. Приняты меры для остановки кровотечения.
Гемотрансфузии и интенсивная трансфузионная терапия: 1500 мл консервированной донорской крови, 400 мл реополиглюкина, 400 мл лактасола, 600 мл плазмы, 20 мл 10 % раствора альбумина, 200 мл 20 % раствора глюкозы с инсулином, витамины группы В и С. Под влиянием терапии увеличился сердечный выброс, улучшился транскапиллярный обмен.
Больному наложена трахеостома. В конце дня объем перелитой жидкости составил 6 л, кровопотеря 3500 мл, диурез 3 л.
Второй этап лечения начали после ликвидации геморрагии и устранения непосредственной угрозы жизни больного. С целью доставки в организм пластических и энергетических веществ на следующий день, помимо корригирующих трансфузий, начали проводить парентеральное питание в режиме гипералиментации (продолжительность 7 дней с последующим переходом на смешанное питание. Расчет компонентов парентерального питания:
Парентеральное питание проводили через подключичную вену в режиме до 40 капель в минуту в течение 8— 10 ч. С 3-го дня послеоперационного периода начато вспомогательное комбинированное питание, включавшее энтеральные средства, всасывающиеся в верхних отделах желудочно-кишечного тракта (сметана, яйца, спирт, молоко, сливки). На 8-й день больной переведен в общую палату. Дефицит массы тела к этому времени составил 1,2 кг по сравнению с исходным уровнем. На 35-й день больной выписан из стационара в удовлетворительном состоянии.
Парентеральное и энтеральное питание. Результаты операции часто больше зависят от эффективности интенсивной терапии, которую проводят в послеоперационный период, чем от мастерства хирурга, особенно при заболеваниях челюстно-лицевой области, пищеварительного тракта и смежных областей. Поиск оптимальных методов лечения по-прежнему остается актуальной проблемой (Roth Б., 1986; Karner J. et al., 1987).
Интенсивная трансфузионная терапия, парентеральное и энтеральное питание, проводимые в послеоперационном периоде, обеспечивают поддержание адекватных приспособительных реакций организма в ответ на операционную травму и способствуют восстановлению постоянства внутренней среды. Обеспечение жизнедеятельности основных систем организма должно идти по пути нормализации их работы, а компоненты вводимых смесей, воздействуя на обменные процессы, обеспечивают доставку к ним необходимых пластических и энергетических веществ.
Многообразные физико-химические и физиологические реакции объединяют термином «обмен». Обмен состоит из анаболитической фазы — доставка и усвоение питательных веществ — и катаболитической — расщепление, распад и выведение продуктов обмена из организма. Функция питания строится по принципу энергетического, пластического, ферментативного и резервного построения всей системы обменных реакций, происходящих в организме от момента зарождения и смерти.
Основные превращения белков, жиров и углеводов совершаются^в процессе ассимиляции и диссимиляции. Биологическое значение этих процессов состоит в том, что при расщеплении веществ освобождается энергия, которая обеспечивает все функции организма. В то же время при синтезе образуются видоспецифические субстраты: углеводы, жиры и белки, т.е. те структурные элементы, которые определяют целостность организма. Питательные вещества представляют собой крупные молекулы, и их распад на более простые соединения является необходимым условием дальнейшего использования в клетке источников энергии и пластического материала.
Ближайший послеоперационный период характеризуется увеличением потребностей организма в заменимых и незаменимых факторах питания, энергии возрастанием функциональной нагрузки на жизнеобеспечивающие системы организма (рис. 27).
Рис 27 Парентеральное питание в клинической стоматологии
Парентеральное питание. Парентеральное питание реализуется на клеточном и субклеточном ушgt;вне, минуя фазу пищеварения, именно ту фазу, которая у стоматологических больных наиболее часто бывает затруднена. При этом внутривенно вводимые субстраты поступают с кровью портальной вены в печень, где подвергаются химическим превращениям, после чего используются на построение клеток организма. Этот схематически представленный процесс в определенной мере объясняет основной принцип метода парентерального питания, необходимость его применения у стоматологических больных в отличие от больных с другими заболеваниями.
Важным фактором катаболической фазы обмена является усиление гликогенолиза с быстрым истощением запасов гликогена — одного из главных источников энергии в организме. В катаболической фазе существенно увеличиваются потери организмом азота, которые могут достигать 35—49 г в сутки. Содержание азота в белке составляет в среднем 16 %, т.е. 1 г азота соответствует 6,25 г белка. Следовательно, выделение 35—40 г азота эквивалентно потере 220—250 г белка в сутки (средние потери белка за сутки в состоянии относительного покоя составляют 60—70 г).
Важным энергетическим компонентом парентерального питания является глюкоза, которая подвергается качественной и количественной перестройке в случае развития патологического процесса. При парентеральном питании углеводы, попадая в печень, превращаются в сложный полисахарид — гликоген. Находящаяся в крови глюкоза выполняет роль основного биологического топлива и является составной частью полисахаридов и гликопротеидов.
Гликопротеиды входят в состав клеточной оболочки и циркулируют в кровяном русле в качестве транспортных молекул. К гликопротеидам относятся некоторые гормоны, ферменты, иммуноглобулины. В организме глюкоза является исходным продуктом для биосинтеза ряда сахаров, например фруктозы, галактозы, ксилозы и др.
Не менее важное значение в обмене играют жиры, являющиеся энергетической формой питательных веществ. Вместе с тем они используются в организме и как источники энергии.
Содержание общих липидов в плазме крови человека зависит от многих факторов, таких, как количество потребляемой пищи, физическая активность конституции. Из многочисленных функций жирных кислот наиболее важной является участие липидов в построении биологических мембран.
Обязательной составной частью парентерального питания являются витамины, различные соли, микроэлементы и другие химические вещества. Именно они поддерживают обмен белков, жиров и углеводов, обеспечивая необходимые для организма структурные перестройки.
Важная задача парентерального питания — не только восполнить дефицит питательных веществ, необходимых для жизнедеятельности организма, но и обеспечить течение процессов саморегуляции и функциональной системы питания и поддержание концентрации необходимых веществ в крови на оптимальном уровне.
Относительно обеспечения эффективного питания больных с опухолями до сих пор высказываются противоречивые мнения. По существу в послеоперационном периоде в зоне травмы необходимо создать максимальный покой, что не может быть выполнено у стоматологических больных. В то же время в этот период организм нуждается в достаточном количестве пластического и энергетического материала, способного обеспечить повышение регенеративных процессов в ране. Зондовое и парентеральное питание имеет своих противников и сторонников, которые достаточно аргументированно обосновали свои взгляды на тот или иной способ питания стоматологических больных в послеоперационном периоде.
Ряд исследователей убедительно доказали наличие прямой связи между нормализацией метаболизма, рациональным азотистым питанием и клиническим течением послеоперационного периода. Парентеральное питание в послеоперационном периоде может быть эффективным только после ликвидации грубых расстройств (восстановление КОР, водно-солевого равновесия, адекватного кислородного режима), возникших во время оперативного вмешательства.
Парентеральное питание назначают при ликвидации функциональных расстройств жизненно важных органов
и систем: нарушений деятельности сердечно-сосудистой и дыхательной систем, отека мозга и шокового состояния. Обязательными условиями являются ликвидация кровотечения и возмещение кровопотери. Эти положения особенно важны для онкологических больных, так как при их лечении анестезиологу нередко приходится решать вопросы борьбы с кровотечением, функциональными нарушениями и расстройствами метаболизма в ближайшем послеоперационном периоде (Jehn U., 1986).
В это время организм больного страдает от того, что не обеспечен полноценными питательными веществами (нутриентами), и от метаболических расстройств, явившихся следствием реакции на травму.
Выбор средств определялся катаболизмом белка, нарушениями обмена жиров, энергетической недостаточностью и невозможностью обеспечить физиологический режим доставки питательных ингредиентов в организм больного. Для восполнения пластического и энергетического дефицита использовали гидролизаты белка (казеин, аминозол), аминокислоты (вамин, левамин, жировая эмульсия (интралипид), растворы углеводов, раствор Рин- гера, витамины, стимуляторы анаболизма (неробол, рета- болил).
В зависимости от общего состояния больного и средней энергетической потребности (24 ккал/кг в сутки) у больных в послеоперационном периоде рекомендуется увеличить энергетический уровень на 10—20 % от должных показателей. Ряд авторов рекомендуют увеличивать объем парентерального питания на 5—8 % на каждый градус температуры тела сверх 37°С (Рябов Г.А., 1983).
Тесная взаимосвязь энергетических и пластических процессов в организме обусловливает введение энергетических компонентов в виде глюкозы или жировой эмульсии (чаще применяют оба компонента одновременно).
В 1-е сутки послеоперационного периода больному требуется от 30 до 40 ккал на 1 кг массы тела или 200-250 небелковых килокалорий на каждый грамм вводимого азота (2100—2300 ккал в сутки). Для этого необходимо 2100 : 4 = 525 г глюкозы (1 г глюкозы утилизируется с выделением 4,1 ккал). При повышении температуры на каж
дые 0,5 С (свыше 37 С) необходимо добавить еще 100 ккал. Таким образом, суточная потребность в глюкозе (вводимой через магистральную вену) составит:
^3«01QQ = 1750 мп 30 % глюкозы
В последние годы за рубежом выпускают 50 % оффи- цинальные растворы глюкозы с микроэлементами, предназначенные для введения через крупные сосуды. При этом общее количество вводимой жидкости уменьшается в несколько раз. Следует помнить, что концентрацию глюкозы необходимо повышать постепенно в связи с адаптацией инкреторного аппарата поджелудочной железы к большим дозам и высокой концентрации.
После оперативных вмешательств возможно снижение толерантности к глюкозе вследствие подавления инкреторной функции поджелудочной железы. Обязательным компонентом энергетической смеси является инсулин (Ollenschlager G., 1985; Green N.M., 1987). Если глю- козурия превышает 1—3 %, то следует увеличить дозу инсулина. Жировая эмульсия интралипид является энергетическим материалом (1 г жира считается эквивалентным 9,1 ккал), доза эмульсии составляет 1,5—2 г/кг в сутки.
Практический учет всех показателей дефицита должен быть индивидуальным в зависимости от биохимических показателей. Важную роль в обмене играют витамины группы В и С, являющиеся биологическими катализаторами метаболических процессов.
Зондовое (энтеральное) питание. Обеспечить нормальные процессы синтеза после операции можно лишь с помощью адекватного сбалансированного питания, т.е. путем введения в организм необходимых количеств пластических материалов, энергии, воды, электролитов, витаминов, микроэлементов. Использовать оральное питание далеко не всегда возможно, особенно в хирургии челюстно- лицевой области, глотки, полости рта. В связи с этим в до- и послеоперационном периодах особое значение приобретает энтеральное питание как единственное средство, способное нивелировать потери, вызванные катаболической направленностью обмена веществ в организме больного.
обусловленной влиянием заболевания и операционной травмы. Еще сравнительно недавно среди клиницистов было распространено мнение, что в первые 2—3 дня после оперативного вмешательства больной не нуждается в питании. Об этом в 1959 г. писал известный специалист по метаболизму и лечению больных после операции Д.Мур. Спустя несколько лет он признал необходимость питания хирургических больных с 1-го дня после операции (BablerK.H.et al., 1987).
При обычном питании белок поступает в желудочно- кишечный тракт с неизменной первичной структурой. В желудке он подвергается дальнейшей денатурации с помощью соляной кислоты желудочного сока и далее — ферментативному расщеплению до аминокислот. Аминокислоты всасываются в средних и нижних отделах кишечника, поступают в венозные сосуды кишечника, затем через систему воротной вены в печень, где и начинается их метаболический цикл в организме (Kommerell В., 1985).
При парентеральном питании препараты белка вводятся в сосудистое русло, как правило, в отделы, не связанные с портальной системой. Если для парентерального питания используют гидролизаты белка (наиболее употребительная лекарственная форма), то имеющиеся в ней аминокислоты, пройдя через малый круг кровообращения и попав в ткани, сразу вступают в обменные процессы. Почти то же самое происходит с остальными компонентами парентерального питания: углеводами, жирами, витаминами (Adibi S.A. et al., 1984).
У большинства хирургических больных имеется дефицит белка и энергии, причем его выраженность зависит от ряда причин. При дефиците потребления и затрудненной утилизации пищевых продуктов (деформации челюстей, опухоли, анкилозы височно-нижнечелюстного сустава и др.) у больных отмечается уменьшение массы тела до 50 % за счет скелетной мускулатуры и подкожной жировой клетчатки. Содержание альбумина в плазме у них может быть нормальным, а признаков повышения обмена не отмечается, при этом потери азота с мочой невелики. Сумма суточных энергетических потребностей хирургического больного резко возрастает при наличии сопутствующего патологического процесса или присоединении инфекции и достигает 43 ккал/кг, или 180 кДж/кг, в сутки.
Оперативное вмешательство в челюстно-лицевой области нарушает обычный путь поступления пищи в начальные отделы пищеварительной трубки при сохранной функции желудочно-кишечного тракта. Эффективным методом, позволяющим предупредить возникновение классической катаболической реакции после операции, является специальное питание — зондовое (энтеральное). В зондовом питании нуждаются стоматологические больные с пониженным статусом питания, пациенты с нарушениями белкового и водно-солевого обмена, у которых в послеоперационном периоде возникают осложнения, препятствующие адекватному питанию. Применение зондово- го питания оправдано в тех случаях, когда после операции поступление пищи через рот затруднено или невозможно. Питательную смесь вводят через тонкий пластмассовый зонд (через нос) с помощью помпы (насоса) либо обычной капельной системы без фильтра.
Перед началом операции определяют тактику питания больного, которому предполагают ввести зонд и проводить искусственное кормление:
Для зондового питания применяют энпиты, представляющие собой полимерные питательные модули или элементные диеты, т.е. питательные смеси, обеспечивающие потребность больных в повышенных количествах того или иного нутриента. С этой целью используют инцитан (СССР), терапин (ПНР), козелат (ВНР), биосорб (ФРГ). При раздельном применении этих препаратов выявлено недостоверное различие в их составляющих, а отсутствие изменений в биохимических показателях вследствие их относительной однотипности позволило нам оценить данные смеси как единый препарат для зондового питания (например, терапин содержит 1—1,5 ккал/мл, инпитан — 1,06 ккал/мл, козелат — 1 ккал/мл).
Белки в этих смесях представлены казеином, жиры — в форме масел (кукурузное, соевое). Энпиты имеют вид по
рошка, который разводят в воде, а затем вводят через эластичный полимерный зонд. Биосорб представлен и виде жидкости во флаконах заводской упаковки.
Суточную дозу препаратов мы рассчитывали на основании реальных энергетических потребностей, исходя из основного обмена:
00 - 66,4 * 13 7 X МТ + 50 Р - 6.7 х В где ОО — основной обмен, ккап/сут
МТ — масса тела, кг, Р — рост см, В — возраст, годы
Энергетическая ценность суточного рациона составила 2100 ккал, из которых на до побелка приходилось 15 '!'•, жира 35 'л , углеводов — 50 %. Зондовое питание проводили в течение 7 дней. Контрольная группа состояла m практически здоровых людей.
Для оценки эффективности проводимой терапии изучали антропометрические данные: Р, МТ, толщину кожной складки (ТКС) в области проекции трехглавой мышцы, окружность конечности (ОК). ТКС и ОК измеряли с помощью кали пера Align Arrows и измерительной линейки.
За стандартные показатели принимали данные, полученные в контрольной группе, и значения, рекомендованные ВОЗ. Кроме того, определяли концентрацию общего белка и альбумина в сыворотке крови, уровень гемоглобина, содержание мочевины в суточной моче, коэффициент альбумин/глобулин (А/Г), количество лимфоцитов. Суточную экскрецию азота (N) рассчитывали по Тодорозу (доклад ФАО, ВОЗ, 1987):
где V — количество выведенной мочевины (в моче), i/cyi,
МТ — масса тела, кг
Азотный баланс (АБ) определяли как разность между введенным и выведенным за сутки количеством азота + 4; дополнительные потери N (пот, мокрота и др.) принимали равными 4 г/сут.
Из отечественных смесей для лечения больных применяют белковый, низколактозный энпит и инпитан, разработанные в Институте питания АМН СССР. Инпитан не только сбалансирован по всем нутриентам, но частично гидролизован по белку, содержит 440 ккал на 100 г сухого вещества, или 1000 ккал в 1000 мл смеси.
Хорошо зарекомендовала себя смесь, состоящая из общедоступных продуктов: 500 мл молока, 250 г сухого молока, по 50 г сливочного масла, меда, сахара, 3 яйца, разведенные в 1000 мл воды; 2500 мл этой смеси содержат 2500 ккал.
Результаты анализа биохимических показателей при применении энпитов свидетельствовали об их положительной динамике. Концентрация белка в плазме крови у больных в предоперационном периоде была достоверно ниже, чем в контрольной группе. Высокая концентрация мочевины и низкое содержание альбумина указывали на снижение белоксинтезирующей функции печеночной клетки в дооперационном периоде.
Отрицательный АБ у больных до операции свидетельствовал о существенном дефиците белка и его неполноценности по аминокислотному составу. Применение энпитов стабилизировало АБ или делало его положительным к окончанию послеоперационного периода. Ко 2-й неделе наблюдалась положительная динамика антропометрических показателей (МТ, ТКС, ОК). В результате корреляци-
Таблица 8
Результаты зондового питания в клинике челюстно-лицевой хирургии (М±т)
Примечание * статистически достоверное (рlt;0.05) различие с исходными данными
онного анализа биохимических и антропометрических показателей установлено, что у больных в дооперационном периоде и после лечения энпитами МТ коррелировала с концентрацией альбумина (Ч = +0,56; рlt;0,05). Содержание гемоглобина и мочевины, коэффициент Л/Г находились в прямой зависимости от эффективности терапии с помощью зондового питания.
У больных, перенесших реконструктивные операции, были выявлены энергетический дефицит, нарушения синтеза липидов, отрицательный АБ. Данные, полученные при исследовании (высокая концентрация мочевины, гипопротеинемия, нарушения кровотока в печени), указывали на выраженную катаболическую направленность обмена и нарушения утилизации субстратов потребления. Преобладание положительного АБ при зондовом питании свидетельствовало о тенденции к анаболизму; усилении протеи носи нтеза и улучшении клинических показателей по сравнению с контрольной группой (Klimberger G., Deutch Е., 1983).
Из осложнений, которые могут встретиться при применении зондового питания, следует указать на диарею и тошноту, т.е. осложнения, чаще связанные с техническими погрешностями и изменением темпа введения (быстрое) смеси в организм.
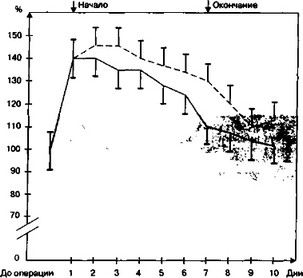
Количество энергетического материала, введенного при зондовом питании, должно покрывать основные потребности организма и компенсировать повышенные потери (рис. 28). Потребность в энергии при остеотомиях верхней и нижней челюсти возрастала в зависимости от индивидуальных особенностей больных (пол, возраст, масса тела, изменения основного обмена, операционная кровопотеря, степень травматичности вмешательства) и составила в среднем 2600 ккал.
Введение азота стимулирует анаболические реакции, ускоряет репаративные процессы в тканях и костях, обеспечивает эффективную консолидацию костных фрагментов. Однако уровень белка в послеоперационном периоде не должен быть выше 1,5 г/кг. Целесообразно обеспечить адекватное количество аскорбиновой кислоты, которой придают большое значение в восстановлении и образовании волокон
энтеральное питание контроль
Рис. 28. Изменения величины основного обмена при энтеральном питании (%)
коллогена (содержание в пище не менее 10 мг/сут). Количество минеральных веществ в составе энпита должно быть: Са — 1000 мг., Р — 1000 мг., Mq — до 500 мг.
Перечисленные особенности катаболической реакции дали вам основание считать целесообразным применение зондового питания, обеспечивающего организм веществами, необходимыми для коррекции послеоперационного катаболизма у больных после реконструктивных операций в челюстно-лицевой области. При зондовом питании (биосорб) ингредиенты в адекватных пропорциях поступают через стенку кишечника в кровь, в портальную зону, как при естественном питании. Ряд данных, полученных
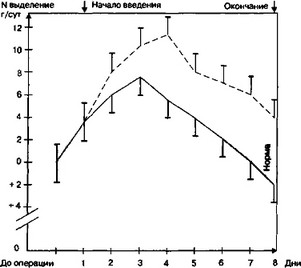
в результате исследования (рис. 29), указывали, что в контрольной группе имел место катаболнческий характер обмена и нарушение утилизации субстратов потребления (высокая концентрация мочевины, глюкозы, нарушения кровотока в печени).
Таким образом, в ближайшем послеоперационном периоде катаболические процессы приводят к быстрому истощению запасов белков, углеводов и жиров, резко тормозят пластические и репаративные процессы в костной ткани, способствуют увеличению основного обмена. Указанный комплекс патологических реакций и их сочетание с вторичными гемодинамическими расстройствами и циркуляторной гипоксией обусловливают необходимость
контроль биосорб
Рис 29 Экскреция азота у больных в послеоперационном периоде при энтеральном питании (г/сутки)
проведения патогенетически обусловленной терапии, основными звеньями которой являются коррекция общих метаболических потребностей и осуществление важнейших компонентов интенсивной терапии: обеспечение адекватного газообмена, сердечного выброса, ОПК, функции печени, почек. Это послужило основанием для применения зондового питания, способного обеспечить организм больного всеми необходимыми веществами и предупредить развитие осложнений (Williamson D.U., 1984).
Одними из основных причин дефицита калия в послеоперационном периоде являются катаболическая реакция и дефицит клеточных белков, обусловленный уменьшением их поступления с пищей. Послеоперационное усиление основного обмена в ответ на стрессовую реакцию — оперативное вмешательство — активизирует распад не только белков, но и углеводов.
При любых травматичных вмешательствах, как правило, отмечаются значительные потери азота в послеоперационном периоде. По нашим данным, в первые сутки после остеотомии верхней и нижней челюсти потери азота
составили 18 г, что в пересчете на белок составляет свыше 120 гили 475 г мышечной ткани. В белке содержится 16— 17 % а.юта, т.е. 1 г азота соответствует 6,25 г белка (в мышечной ткани содержится 25 % белка).
С 1-го дня голодания организм человека утилизирует структурный белок мышцы внутренних органов. Это приводит к нарушению регуляции обмена веществ, главным образом в печени. В 1-е сутки снижается синтез альбумина в печени, происходит снижение коллоидно-осмотичес- кого давления и водоудерживающей функции плазмы крови. При полном или частичном белковом голодании печень может потерять до 40 % белков. В то же время в ней происходит накопление жира, в результате чего ухудшается ее функциональное состояние, тормозится деятельность ферментных систем печени, осуществляющих синтез аминокислот. Таким образом, состояние процессов метаболизма в крови, оттекающей от печени, раскрывает сущность и динамику процессов, происходящих в органе после операции. Состояние кровотока в органах спланхни- ческого бассейна при проведении реконструктивных операций на костях черепа является важным показателем адекватности обмена в зависимости от функционального состояния печени, системного и регионального кровотока.
Исследования, проведенные нами у 48 больных, перенесших реконструктивные операции в черепно-лицевой области, позволили выявить нарушения обмена в послеоперационном периоде. У больных изучены биохимические показатели артериальной крови и крови в печеночной вене. Больные в возрасте от 18 до 38 лет были распределены на две группы: первая группа практически здоровые лица с косметическим дефектом челюстей, которым были проведены реконструктивные операции на челюстях; вторая группа — больные, перенесшие сложные реконструктивные операции в средней зоне лица и остеотомии с внутричерепным доступом. В послеоперационном периоде биохимические показатели крови, оттекающей от печени, претерпевали значительные изменения. В условиях целостного организма такой подход позволяет сделать вывод о состоянии обменных процессов в послеоперационном периоде.
У соматически здоровых пациентов (первая группа) снижение кровотока в печени после оперативного вмеша
тельства не приводило к изменению ее функциональной активности. У больных второй группы в послеоперационном периоде отмечались ухудшения показателей кровообращения, уменьшение систолического объема и минутного объема кровообращения, тахикардия. Травматичная операция и уменьшение ОЦК провоцировали возникновение патологических реакций со стороны рефлексогенных зон основания черепа, сопровождавшихся критическим повышением или снижением артериального давления, нарушением ритма сердца.
Возмещение кровопотери, составляющей в среднем 80 % ОЦК, проводили плазмозаменителями, свежецит- ратной кровью, эритроцитной массой в количествах до 80 % от объема утраченного ОЦК.
В послеоперационном периоде оксигенация крови в печеночной вене была достоверно ниже, чем в артериальной крови (см. табл. 3). Концентрация фибриногена в крови, оттекающей от печени, была значительно выше исходного уровня. Установлено, что артерио-венозная разница по кислороду крови, оттекающей от печени, резко возраставшая во время операции, постепенно стабилизировалась, но не достигла исходного уровня. По нашему мнению, этот факт объясняется снижением насыщения крови кислородом у больных второй группы, что свидетельствует о несоответствии между энергетическими затратами и кровотоком в печени. Нарушение газообмена в печени и изменения скорости кровотока в ней находят свое выражение в изменении обмена белка и нарушении синтеза аминокислот. Начиная с 1-х суток послеоперационного периода у больных наблюдаются отрицательный азотистый баланс, снижение концентрации белка, увеличение экскреции азота мочевины, уменьшение коэффициента А/Г. Закономерным отражением белковой недостаточности явилось изменение аминокислотного спектра в организме. В плазме увеличивалась концентрация аммиака, в моче содержание аммиака уменьшалось до 90 % по сравнению с дооперационным уровнем. Дефицит пластических и энергетических резервов вызывал ухудшение общего состояния больных и замедление репаративных процессов в ране. Из изложенного выше следует, что при лечении больного ботьшое значение имеют рациональное питание
и введение в организм дефицитных субстратов, обеспечить которыми больных в послеоперационном периоде естественным способом не представляется возможным (Silberman Н. et al., 1982).
Таким образом, результаты хирургической операции в области лицевого и мозгового черепа в значительной степени зависят от эффективности послеоперационной интенсивной терапии, которая нередко принимает характер реанимационных мероприятий. Приводим наблюдение, иллюстрирующее характер терапии после операции.
Больной Т., 35 лет, поступил в клинику с диагнозом: сочетанная деформация челюстей (верхняя микрогнатия и нижняя макрогнатия), синдром удлиненного лица.
Операция: плоскостная двусторонняя остеотомия нижней челюсти, остеотомия верхней челюсти по Безрукову, гениопластика.
Комбинированный эндотрахеальный наркоз: фента- нил, дроперидол, закись азота с кислородом, интубация трахеи через нос под контролем прямой ларингоскопии. В условиях нейролептаналгезии и ИВЛ проведена остеотомия верхней челюсти, двухсторонняя остеотомия нижней челюсти, гениопластика. Все оперативные вмешательства выполнены последовательно. Анестезия протекала гладко, продолжительность наркоза 4 ч. 35 мин. По ходу операции проводили управляемую гемодилюцию с использованием коллоидных и кристаллоидных растворов, аутогемотрансфузию (800 мл). Операционная кровопотеря составила 1 л 200 мл. По ходу операции перелито 800 мл поли- глюкина, 800 мл реополиглюкина, 400 мл лактасола, 800 мл аутокрови. К концу операции дефицит ОЦК составил более 20 % от расчетной нормы.
После пробуждения и восстановления спонтанного дыхания больной доставлен в послеоперационную палату, где за ним проводили мониторное динамическое наблюдение. Несмотря на тампонаду носовых ходов, выполненную с целью гемостаза, отмечено подтекание крови из носоглотки. Проведена задняя и передняя тампонада.
Спустя 2 ч. 50 мин. в момент осмотра больного отмечаются бледность кожных покровов, цианоз губ, дыхание поверхностное, не адекватно. В полости рта большое количество крови, пульсация на периферических сосудах от
сутствует, тоны сердца не выслушиваются. Незамедлительно начаты реанимационные мероприятия: удаление крови и сгустков из полости рта для обеспечения свободной проходимости верхних дыхательных путей; аппаратная вентиляция легких, закрытый массаж сердца (аппарат РО-6, минутный объем вентиляции 13 л/мин, дыхательный объем 750 мл, кислород 100 %; трансфузионная терапия с целью поддержания необходимого ОЦК и центральной гемодинамики. В подключичную вену введено 1 мл адреналина и 1 мл атропина. Спустя 2 мин. после начала реанимационных мероприятий кровообращение было восстановлено, АД 140/90 мм рт. ст., пульс 115 в минуту. Приняты меры для остановки кровотечения.
Гемотрансфузии и интенсивная трансфузионная терапия: 1500 мл консервированной донорской крови, 400 мл реополиглюкина, 400 мл лактасола, 600 мл плазмы, 20 мл 10 % раствора альбумина, 200 мл 20 % раствора глюкозы с инсулином, витамины группы В и С. Под влиянием терапии увеличился сердечный выброс, улучшился транскапиллярный обмен.
Больному наложена трахеостома. В конце дня объем перелитой жидкости составил 6 л, кровопотеря 3500 мл, диурез 3 л.
Второй этап лечения начали после ликвидации геморрагии и устранения непосредственной угрозы жизни больного. С целью доставки в организм пластических и энергетических веществ на следующий день, помимо корригирующих трансфузий, начали проводить парентеральное питание в режиме гипералиментации (продолжительность 7 дней с последующим переходом на смешанное питание. Расчет компонентов парентерального питания:
- раствор альвезина (аминокислоты Д-формы) применяли из расчета 0,57 г на 1 кг массы тела (всего 1—1,2 г условного белка);
- энергетические расходы покрывались растворами глюкозы (гипералиментация) из расчета 25— 30 ккал/кг(126 кдж) — 1500 мл 20 % раствора глюкозы, всего 2100 ккал.;
- минеральные вещества: калий в виде КИ вводили в дозе до 6 г/сут или в виде 7,4 % раствора аспирагината калия и магния. Применялся раствор Рингера, лактасол;
- анаболические стимуляторы: инсулин в расчетных дозировках, неробол 5 % раствор 1 мл через 3—4 дня. Витамины группы В, С.
Парентеральное питание проводили через подключичную вену в режиме до 40 капель в минуту в течение 8— 10 ч. С 3-го дня послеоперационного периода начато вспомогательное комбинированное питание, включавшее энтеральные средства, всасывающиеся в верхних отделах желудочно-кишечного тракта (сметана, яйца, спирт, молоко, сливки). На 8-й день больной переведен в общую палату. Дефицит массы тела к этому времени составил 1,2 кг по сравнению с исходным уровнем. На 35-й день больной выписан из стационара в удовлетворительном состоянии.
Парентеральное и энтеральное питание. Результаты операции часто больше зависят от эффективности интенсивной терапии, которую проводят в послеоперационный период, чем от мастерства хирурга, особенно при заболеваниях челюстно-лицевой области, пищеварительного тракта и смежных областей. Поиск оптимальных методов лечения по-прежнему остается актуальной проблемой (Roth Б., 1986; Karner J. et al., 1987).
Интенсивная трансфузионная терапия, парентеральное и энтеральное питание, проводимые в послеоперационном периоде, обеспечивают поддержание адекватных приспособительных реакций организма в ответ на операционную травму и способствуют восстановлению постоянства внутренней среды. Обеспечение жизнедеятельности основных систем организма должно идти по пути нормализации их работы, а компоненты вводимых смесей, воздействуя на обменные процессы, обеспечивают доставку к ним необходимых пластических и энергетических веществ.
Многообразные физико-химические и физиологические реакции объединяют термином «обмен». Обмен состоит из анаболитической фазы — доставка и усвоение питательных веществ — и катаболитической — расщепление, распад и выведение продуктов обмена из организма. Функция питания строится по принципу энергетического, пластического, ферментативного и резервного построения всей системы обменных реакций, происходящих в организме от момента зарождения и смерти.
Основные превращения белков, жиров и углеводов совершаются^в процессе ассимиляции и диссимиляции. Биологическое значение этих процессов состоит в том, что при расщеплении веществ освобождается энергия, которая обеспечивает все функции организма. В то же время при синтезе образуются видоспецифические субстраты: углеводы, жиры и белки, т.е. те структурные элементы, которые определяют целостность организма. Питательные вещества представляют собой крупные молекулы, и их распад на более простые соединения является необходимым условием дальнейшего использования в клетке источников энергии и пластического материала.
Ближайший послеоперационный период характеризуется увеличением потребностей организма в заменимых и незаменимых факторах питания, энергии возрастанием функциональной нагрузки на жизнеобеспечивающие системы организма (рис. 27).

Рис 27 Парентеральное питание в клинической стоматологии
Парентеральное питание. Парентеральное питание реализуется на клеточном и субклеточном ушgt;вне, минуя фазу пищеварения, именно ту фазу, которая у стоматологических больных наиболее часто бывает затруднена. При этом внутривенно вводимые субстраты поступают с кровью портальной вены в печень, где подвергаются химическим превращениям, после чего используются на построение клеток организма. Этот схематически представленный процесс в определенной мере объясняет основной принцип метода парентерального питания, необходимость его применения у стоматологических больных в отличие от больных с другими заболеваниями.
Важным фактором катаболической фазы обмена является усиление гликогенолиза с быстрым истощением запасов гликогена — одного из главных источников энергии в организме. В катаболической фазе существенно увеличиваются потери организмом азота, которые могут достигать 35—49 г в сутки. Содержание азота в белке составляет в среднем 16 %, т.е. 1 г азота соответствует 6,25 г белка. Следовательно, выделение 35—40 г азота эквивалентно потере 220—250 г белка в сутки (средние потери белка за сутки в состоянии относительного покоя составляют 60—70 г).
Важным энергетическим компонентом парентерального питания является глюкоза, которая подвергается качественной и количественной перестройке в случае развития патологического процесса. При парентеральном питании углеводы, попадая в печень, превращаются в сложный полисахарид — гликоген. Находящаяся в крови глюкоза выполняет роль основного биологического топлива и является составной частью полисахаридов и гликопротеидов.
Гликопротеиды входят в состав клеточной оболочки и циркулируют в кровяном русле в качестве транспортных молекул. К гликопротеидам относятся некоторые гормоны, ферменты, иммуноглобулины. В организме глюкоза является исходным продуктом для биосинтеза ряда сахаров, например фруктозы, галактозы, ксилозы и др.
Не менее важное значение в обмене играют жиры, являющиеся энергетической формой питательных веществ. Вместе с тем они используются в организме и как источники энергии.
Содержание общих липидов в плазме крови человека зависит от многих факторов, таких, как количество потребляемой пищи, физическая активность конституции. Из многочисленных функций жирных кислот наиболее важной является участие липидов в построении биологических мембран.
Обязательной составной частью парентерального питания являются витамины, различные соли, микроэлементы и другие химические вещества. Именно они поддерживают обмен белков, жиров и углеводов, обеспечивая необходимые для организма структурные перестройки.
Важная задача парентерального питания — не только восполнить дефицит питательных веществ, необходимых для жизнедеятельности организма, но и обеспечить течение процессов саморегуляции и функциональной системы питания и поддержание концентрации необходимых веществ в крови на оптимальном уровне.
Относительно обеспечения эффективного питания больных с опухолями до сих пор высказываются противоречивые мнения. По существу в послеоперационном периоде в зоне травмы необходимо создать максимальный покой, что не может быть выполнено у стоматологических больных. В то же время в этот период организм нуждается в достаточном количестве пластического и энергетического материала, способного обеспечить повышение регенеративных процессов в ране. Зондовое и парентеральное питание имеет своих противников и сторонников, которые достаточно аргументированно обосновали свои взгляды на тот или иной способ питания стоматологических больных в послеоперационном периоде.
Ряд исследователей убедительно доказали наличие прямой связи между нормализацией метаболизма, рациональным азотистым питанием и клиническим течением послеоперационного периода. Парентеральное питание в послеоперационном периоде может быть эффективным только после ликвидации грубых расстройств (восстановление КОР, водно-солевого равновесия, адекватного кислородного режима), возникших во время оперативного вмешательства.
Парентеральное питание назначают при ликвидации функциональных расстройств жизненно важных органов
и систем: нарушений деятельности сердечно-сосудистой и дыхательной систем, отека мозга и шокового состояния. Обязательными условиями являются ликвидация кровотечения и возмещение кровопотери. Эти положения особенно важны для онкологических больных, так как при их лечении анестезиологу нередко приходится решать вопросы борьбы с кровотечением, функциональными нарушениями и расстройствами метаболизма в ближайшем послеоперационном периоде (Jehn U., 1986).
В это время организм больного страдает от того, что не обеспечен полноценными питательными веществами (нутриентами), и от метаболических расстройств, явившихся следствием реакции на травму.
Выбор средств определялся катаболизмом белка, нарушениями обмена жиров, энергетической недостаточностью и невозможностью обеспечить физиологический режим доставки питательных ингредиентов в организм больного. Для восполнения пластического и энергетического дефицита использовали гидролизаты белка (казеин, аминозол), аминокислоты (вамин, левамин, жировая эмульсия (интралипид), растворы углеводов, раствор Рин- гера, витамины, стимуляторы анаболизма (неробол, рета- болил).
В зависимости от общего состояния больного и средней энергетической потребности (24 ккал/кг в сутки) у больных в послеоперационном периоде рекомендуется увеличить энергетический уровень на 10—20 % от должных показателей. Ряд авторов рекомендуют увеличивать объем парентерального питания на 5—8 % на каждый градус температуры тела сверх 37°С (Рябов Г.А., 1983).
Тесная взаимосвязь энергетических и пластических процессов в организме обусловливает введение энергетических компонентов в виде глюкозы или жировой эмульсии (чаще применяют оба компонента одновременно).
В 1-е сутки послеоперационного периода больному требуется от 30 до 40 ккал на 1 кг массы тела или 200-250 небелковых килокалорий на каждый грамм вводимого азота (2100—2300 ккал в сутки). Для этого необходимо 2100 : 4 = 525 г глюкозы (1 г глюкозы утилизируется с выделением 4,1 ккал). При повышении температуры на каж
дые 0,5 С (свыше 37 С) необходимо добавить еще 100 ккал. Таким образом, суточная потребность в глюкозе (вводимой через магистральную вену) составит:
^3«01QQ = 1750 мп 30 % глюкозы
В последние годы за рубежом выпускают 50 % оффи- цинальные растворы глюкозы с микроэлементами, предназначенные для введения через крупные сосуды. При этом общее количество вводимой жидкости уменьшается в несколько раз. Следует помнить, что концентрацию глюкозы необходимо повышать постепенно в связи с адаптацией инкреторного аппарата поджелудочной железы к большим дозам и высокой концентрации.
После оперативных вмешательств возможно снижение толерантности к глюкозе вследствие подавления инкреторной функции поджелудочной железы. Обязательным компонентом энергетической смеси является инсулин (Ollenschlager G., 1985; Green N.M., 1987). Если глю- козурия превышает 1—3 %, то следует увеличить дозу инсулина. Жировая эмульсия интралипид является энергетическим материалом (1 г жира считается эквивалентным 9,1 ккал), доза эмульсии составляет 1,5—2 г/кг в сутки.
Практический учет всех показателей дефицита должен быть индивидуальным в зависимости от биохимических показателей. Важную роль в обмене играют витамины группы В и С, являющиеся биологическими катализаторами метаболических процессов.
Зондовое (энтеральное) питание. Обеспечить нормальные процессы синтеза после операции можно лишь с помощью адекватного сбалансированного питания, т.е. путем введения в организм необходимых количеств пластических материалов, энергии, воды, электролитов, витаминов, микроэлементов. Использовать оральное питание далеко не всегда возможно, особенно в хирургии челюстно- лицевой области, глотки, полости рта. В связи с этим в до- и послеоперационном периодах особое значение приобретает энтеральное питание как единственное средство, способное нивелировать потери, вызванные катаболической направленностью обмена веществ в организме больного.
обусловленной влиянием заболевания и операционной травмы. Еще сравнительно недавно среди клиницистов было распространено мнение, что в первые 2—3 дня после оперативного вмешательства больной не нуждается в питании. Об этом в 1959 г. писал известный специалист по метаболизму и лечению больных после операции Д.Мур. Спустя несколько лет он признал необходимость питания хирургических больных с 1-го дня после операции (BablerK.H.et al., 1987).
При обычном питании белок поступает в желудочно- кишечный тракт с неизменной первичной структурой. В желудке он подвергается дальнейшей денатурации с помощью соляной кислоты желудочного сока и далее — ферментативному расщеплению до аминокислот. Аминокислоты всасываются в средних и нижних отделах кишечника, поступают в венозные сосуды кишечника, затем через систему воротной вены в печень, где и начинается их метаболический цикл в организме (Kommerell В., 1985).
При парентеральном питании препараты белка вводятся в сосудистое русло, как правило, в отделы, не связанные с портальной системой. Если для парентерального питания используют гидролизаты белка (наиболее употребительная лекарственная форма), то имеющиеся в ней аминокислоты, пройдя через малый круг кровообращения и попав в ткани, сразу вступают в обменные процессы. Почти то же самое происходит с остальными компонентами парентерального питания: углеводами, жирами, витаминами (Adibi S.A. et al., 1984).
У большинства хирургических больных имеется дефицит белка и энергии, причем его выраженность зависит от ряда причин. При дефиците потребления и затрудненной утилизации пищевых продуктов (деформации челюстей, опухоли, анкилозы височно-нижнечелюстного сустава и др.) у больных отмечается уменьшение массы тела до 50 % за счет скелетной мускулатуры и подкожной жировой клетчатки. Содержание альбумина в плазме у них может быть нормальным, а признаков повышения обмена не отмечается, при этом потери азота с мочой невелики. Сумма суточных энергетических потребностей хирургического больного резко возрастает при наличии сопутствующего патологического процесса или присоединении инфекции и достигает 43 ккал/кг, или 180 кДж/кг, в сутки.
Оперативное вмешательство в челюстно-лицевой области нарушает обычный путь поступления пищи в начальные отделы пищеварительной трубки при сохранной функции желудочно-кишечного тракта. Эффективным методом, позволяющим предупредить возникновение классической катаболической реакции после операции, является специальное питание — зондовое (энтеральное). В зондовом питании нуждаются стоматологические больные с пониженным статусом питания, пациенты с нарушениями белкового и водно-солевого обмена, у которых в послеоперационном периоде возникают осложнения, препятствующие адекватному питанию. Применение зондово- го питания оправдано в тех случаях, когда после операции поступление пищи через рот затруднено или невозможно. Питательную смесь вводят через тонкий пластмассовый зонд (через нос) с помощью помпы (насоса) либо обычной капельной системы без фильтра.
Перед началом операции определяют тактику питания больного, которому предполагают ввести зонд и проводить искусственное кормление:
- расчет диетической формулы питания;
- прогнозирование степени риска возникновения обменных нарушений;
- выявление питательного дефицита с помощью физических и лабораторных методов исследования;
- выбор метода введения энтеральной смеси;
- организация питания и наблюдение за больным.
Для зондового питания применяют энпиты, представляющие собой полимерные питательные модули или элементные диеты, т.е. питательные смеси, обеспечивающие потребность больных в повышенных количествах того или иного нутриента. С этой целью используют инцитан (СССР), терапин (ПНР), козелат (ВНР), биосорб (ФРГ). При раздельном применении этих препаратов выявлено недостоверное различие в их составляющих, а отсутствие изменений в биохимических показателях вследствие их относительной однотипности позволило нам оценить данные смеси как единый препарат для зондового питания (например, терапин содержит 1—1,5 ккал/мл, инпитан — 1,06 ккал/мл, козелат — 1 ккал/мл).
Белки в этих смесях представлены казеином, жиры — в форме масел (кукурузное, соевое). Энпиты имеют вид по
рошка, который разводят в воде, а затем вводят через эластичный полимерный зонд. Биосорб представлен и виде жидкости во флаконах заводской упаковки.
Суточную дозу препаратов мы рассчитывали на основании реальных энергетических потребностей, исходя из основного обмена:
00 - 66,4 * 13 7 X МТ + 50 Р - 6.7 х В где ОО — основной обмен, ккап/сут
МТ — масса тела, кг, Р — рост см, В — возраст, годы
Энергетическая ценность суточного рациона составила 2100 ккал, из которых на до побелка приходилось 15 '!'•, жира 35 'л , углеводов — 50 %. Зондовое питание проводили в течение 7 дней. Контрольная группа состояла m практически здоровых людей.
Для оценки эффективности проводимой терапии изучали антропометрические данные: Р, МТ, толщину кожной складки (ТКС) в области проекции трехглавой мышцы, окружность конечности (ОК). ТКС и ОК измеряли с помощью кали пера Align Arrows и измерительной линейки.
За стандартные показатели принимали данные, полученные в контрольной группе, и значения, рекомендованные ВОЗ. Кроме того, определяли концентрацию общего белка и альбумина в сыворотке крови, уровень гемоглобина, содержание мочевины в суточной моче, коэффициент альбумин/глобулин (А/Г), количество лимфоцитов. Суточную экскрецию азота (N) рассчитывали по Тодорозу (доклад ФАО, ВОЗ, 1987):
где V — количество выведенной мочевины (в моче), i/cyi,
МТ — масса тела, кг
Азотный баланс (АБ) определяли как разность между введенным и выведенным за сутки количеством азота + 4; дополнительные потери N (пот, мокрота и др.) принимали равными 4 г/сут.
Из отечественных смесей для лечения больных применяют белковый, низколактозный энпит и инпитан, разработанные в Институте питания АМН СССР. Инпитан не только сбалансирован по всем нутриентам, но частично гидролизован по белку, содержит 440 ккал на 100 г сухого вещества, или 1000 ккал в 1000 мл смеси.
Хорошо зарекомендовала себя смесь, состоящая из общедоступных продуктов: 500 мл молока, 250 г сухого молока, по 50 г сливочного масла, меда, сахара, 3 яйца, разведенные в 1000 мл воды; 2500 мл этой смеси содержат 2500 ккал.
Результаты анализа биохимических показателей при применении энпитов свидетельствовали об их положительной динамике. Концентрация белка в плазме крови у больных в предоперационном периоде была достоверно ниже, чем в контрольной группе. Высокая концентрация мочевины и низкое содержание альбумина указывали на снижение белоксинтезирующей функции печеночной клетки в дооперационном периоде.
Отрицательный АБ у больных до операции свидетельствовал о существенном дефиците белка и его неполноценности по аминокислотному составу. Применение энпитов стабилизировало АБ или делало его положительным к окончанию послеоперационного периода. Ко 2-й неделе наблюдалась положительная динамика антропометрических показателей (МТ, ТКС, ОК). В результате корреляци-
Таблица 8
Результаты зондового питания в клинике челюстно-лицевой хирургии (М±т)
|
Показатель |
Больные (п=15) |
Здоровые |
|
|
при поступлении |
после лечения |
(контроль, п=15) |
|
|
Альбумин, г/л |
36.5±0,5 |
40,7±0,9* |
42,8±0,8 |
|
Коэффициент А/Г |
0.6±0,03 |
0,8±0,0Г |
0,9±0,01 |
|
Общий белок, г/л |
72.711,3 |
75,1 ±2,3 |
78,0±1.2 |
|
Гемоглобин, г/л |
13111 |
141+8* |
14б±5 |
|
Выведение мочевины*, ммоль/сут |
556.8±18 1 |
360,4±24,1 * |
480,5±13.1 |
|
МТ, кг |
70,1 ±3,1 |
74,0±2.6* |
74,8±2,5 |
|
ТКС, мм |
I5 3t0 8 |
17,1 ±0,6* |
19,2±0,5 |
|
ОК, мм |
24,6+2 0 |
25.8±2,8 |
27 6±1,3 |
|
АБ, г/кг/сут |
-0,3 |
+ 0.8 |
— |
Примечание * статистически достоверное (рlt;0.05) различие с исходными данными
онного анализа биохимических и антропометрических показателей установлено, что у больных в дооперационном периоде и после лечения энпитами МТ коррелировала с концентрацией альбумина (Ч = +0,56; рlt;0,05). Содержание гемоглобина и мочевины, коэффициент Л/Г находились в прямой зависимости от эффективности терапии с помощью зондового питания.
У больных, перенесших реконструктивные операции, были выявлены энергетический дефицит, нарушения синтеза липидов, отрицательный АБ. Данные, полученные при исследовании (высокая концентрация мочевины, гипопротеинемия, нарушения кровотока в печени), указывали на выраженную катаболическую направленность обмена и нарушения утилизации субстратов потребления. Преобладание положительного АБ при зондовом питании свидетельствовало о тенденции к анаболизму; усилении протеи носи нтеза и улучшении клинических показателей по сравнению с контрольной группой (Klimberger G., Deutch Е., 1983).
Из осложнений, которые могут встретиться при применении зондового питания, следует указать на диарею и тошноту, т.е. осложнения, чаще связанные с техническими погрешностями и изменением темпа введения (быстрое) смеси в организм.
Количество энергетического материала, введенного при зондовом питании, должно покрывать основные потребности организма и компенсировать повышенные потери (рис. 28). Потребность в энергии при остеотомиях верхней и нижней челюсти возрастала в зависимости от индивидуальных особенностей больных (пол, возраст, масса тела, изменения основного обмена, операционная кровопотеря, степень травматичности вмешательства) и составила в среднем 2600 ккал.
Введение азота стимулирует анаболические реакции, ускоряет репаративные процессы в тканях и костях, обеспечивает эффективную консолидацию костных фрагментов. Однако уровень белка в послеоперационном периоде не должен быть выше 1,5 г/кг. Целесообразно обеспечить адекватное количество аскорбиновой кислоты, которой придают большое значение в восстановлении и образовании волокон

энтеральное питание контроль
Рис. 28. Изменения величины основного обмена при энтеральном питании (%)
коллогена (содержание в пище не менее 10 мг/сут). Количество минеральных веществ в составе энпита должно быть: Са — 1000 мг., Р — 1000 мг., Mq — до 500 мг.
Перечисленные особенности катаболической реакции дали вам основание считать целесообразным применение зондового питания, обеспечивающего организм веществами, необходимыми для коррекции послеоперационного катаболизма у больных после реконструктивных операций в челюстно-лицевой области. При зондовом питании (биосорб) ингредиенты в адекватных пропорциях поступают через стенку кишечника в кровь, в портальную зону, как при естественном питании. Ряд данных, полученных
в результате исследования (рис. 29), указывали, что в контрольной группе имел место катаболнческий характер обмена и нарушение утилизации субстратов потребления (высокая концентрация мочевины, глюкозы, нарушения кровотока в печени).
Таким образом, в ближайшем послеоперационном периоде катаболические процессы приводят к быстрому истощению запасов белков, углеводов и жиров, резко тормозят пластические и репаративные процессы в костной ткани, способствуют увеличению основного обмена. Указанный комплекс патологических реакций и их сочетание с вторичными гемодинамическими расстройствами и циркуляторной гипоксией обусловливают необходимость

контроль биосорб
Рис 29 Экскреция азота у больных в послеоперационном периоде при энтеральном питании (г/сутки)
проведения патогенетически обусловленной терапии, основными звеньями которой являются коррекция общих метаболических потребностей и осуществление важнейших компонентов интенсивной терапии: обеспечение адекватного газообмена, сердечного выброса, ОПК, функции печени, почек. Это послужило основанием для применения зондового питания, способного обеспечить организм больного всеми необходимыми веществами и предупредить развитие осложнений (Williamson D.U., 1984).
Источник: Грицук С.Ф., «Анестезия в стоматологии» 1998
А так же в разделе « Метаболическая коррекция (трансфузионная терапия, парентеральное и энтеральное питание) »
- Особенности анестезиологического обеспечения
- Анестезия в хирургии опухолей челюстно-лицевой области
- Анестезия у больных с деформациями черепно-лицевой области
- Анестезиологическое обеспечение реконструктивных и пластических операций с применением микрохирургической техники
- Обезболивание у больных с воспалительными заболеваниями челюстно-лицевой области
- Анестезиологическое обеспечение операций у больных пожилого и старческого возраста
- Хирургический стресс. Концепция адекватности анестезии и метаболической защиты пациента при реконструктивных операциях на лицевом и мозговом черепе
- ПОСЛЕОПЕРАЦИОННАЯ ИНТЕНСИВНАЯ ТЕРАПИЯ
- Профилактика и лечение дыхательной недостаточности
- Поддержание эффективной гемодинамики
- Интенсивная терапия у больных с острыми воспалительными заболеваниями челюстно-лицевой области
- Принципы трансфузионной терапии больных с флегмонами челюстно-лицевой области