В реализации наследственной информации на разных стадиях онтогенеза решающая роль принадлежит процессам молекулярной и надмолекулярной (эпигенетической) регуляции функции генома. Под эпигенетической изменчивостью понимают изменения дифференциальной экспрессии генов, наследуемые в ряду митотических делений клетки без нарушения нуклеотидной последовательности ДНК. В настоящее время описаны два молекулярных эпигенетических механизма: модификация гистонов и метилирование ДНК.
Метилирование — обратимая ковалентная модификация ДНК, происходящая в результате присоединения метильной группы к углероду в 5-м положении цитозинового нуклеотида с образованием 5-метилцитозина.
В геномах млекопитающих, в том числе у человека, 5-метилцитозин преимущественно входит в состав динуклеотидов 5'-CG-3' (так называемые CрG-динуклеотиды) — 70-80 % цитозина в составе CрG-динуклеотидов представлены 5-метилцитозином [231, 817]. Их небольшое число содержится в последовательностях 5'- CpNpGp-3' или асимметричных последовательностях 5'-СрА-3' и 5'-СрТ-3' [673]. В процессе эволюции происходит постепенная элиминация CрG-динуклеотидов, в результате чего их доля в геномах высших эукариот составляет только 5-10 % от теоретически ожидаемой [232]. Метилирование играет важную роль в этом процессе, т. к. потеря большинства CрG-сайтов обусловлена превращением метилированного цитозина в тимин в результате спонтанного дезаминирования (рис. 10.6).
Распределение CрG-динуклеотидов по различным участкам генома млекопитающих неравномерно. В транскрипционно инертном хроматине (гетерохроматине) CрG-динуклеотиды расположены с частотой приблизительно 1 : 80. Гетерохроматин характеризуется наличием метилированной, поздно реплицирующейся ДНК, труднодо-
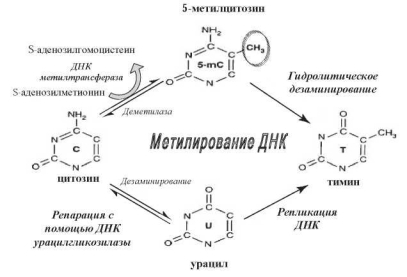
Рис. 10.6. Схема взаимного превращения цитозина и 5-метилцитозина и их мутационные изменения
ступной для транскрипционных факторов, а также соответствующим набором гистонов и специфической нуклеосомной организацией. Для функционально активного хроматина (эухроматина) более характерны участки ДНК (500-5000 п. н.), называемые CрG-островка- ми, в которых плотность CрG-динуклеотидов в пять раз больше, чем в среднем по геному. Цитозин в эухроматине, как правило, находится в неметилированном состоянии. Хроматин, содержащий CрG-остров- ки, мало спирализован, отличается высокой степенью ацетилирования коровых гистонов, практически полным отсутствием гистона Н1 и слабо выраженной нуклеосомной организацией. Все эти особенности строения ДНК эухроматина позволяют ему активно взаимодействовать с транскрипционными факторами. Согласно последним данным, в геноме человека насчитывается около 29 000 CрG-островков, которые в основном расположены в промоторных областях и/или экзонах всех генов «домашнего хозяйства» (house keeping genes) и некоторых тканеспецифичных генов [326, 869].
Основными ферментами, обеспечивающими процесс метилирования в эукариотической клетке, являются метилтрансферазы. На сегодняшний день идентифицировано три метилтрансферазы: DNMT1, DNMT3A, DNMT3B. Ген метилтрансферазы-1 мыши (Dnmt1) высококонсервативен [256], и его ортологи идентифицированы у разных видов, в том числе и у человека (DNMT1) [512]. Продукт гена Dnmt1 поддерживает метилированное состояние ДНК в делящихся клетках. Метилируя вновь синтезированную ДНК, метилтрансфераза-1 обеспечивает воспроизведение родительского паттерна метилирования в дочерних цепях ДНК после каждого раунда репликации (рис. 10.7). Отсутствие фермента приводит к снижению общего уровня метилирования и гибели эмбрионов [572]. Однако эмбриональные стволовые клетки таких мышей жизнеспособны и сохраняют способность к метилированию de novo, что указывает на наличие других метилаз [349]. Именно к таким метилазам относятся ферменты Dnmt3a и Dnmt3b [689]. Совместное действие метилаз приводит к метилированию CрG- динуклеотидов в неметилированной и полуметилированной ДНК in vitro [688] (рис. 10.7).
Мутации в гене DNMT3B человека, приводящие к инактивации каталитического домена фермента, идентифицированы у пациентов с ICF-синдромом (Immunodeficiency, Centromeric instability, Facial anomalies) Синдром ICF — аутосомно-доминантное заболевание, ос-
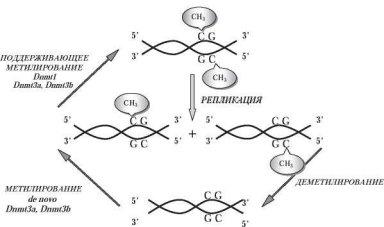
Рис. 10.7. Метилирование de novo и сохранение родительских схем метилирования в раундах репликации
новными клиническими признаками которого являются лицевые аномалии, дефицит IgA и Т-клеток, инфекции верхних дыхательных путей и склонность к злокачественным новообразованиям. Цитогенетической характеристикой синдрома является нестабильность центромерных гетерохроматиновых районов хромосом 1, 9, 16 и реже 2 и 10, возникающая вследствие их гипометилированного состояния [306].
Статус метилирования в клетке может изменяться под влиянием вредных факторов окружающей среды, в частности, тяжелых металлов. Так, внутриклеточное накопление никеля вызывает нарушение в структуре гетерохроматина, что, в свою очередь, приводит к гиперметилированию ДНК и инактивации близлежащих генов [333]. Малые дозы кадмия при краткосрочном воздействии вызывают ингибирование метилтрансферазы и гипометилирование ДНК, в то время как при его долгосрочном воздействии наблюдается обратный эффект, т. е. активация метилтрансферазы и гиперметилирование ДНК [390].
Таким образом, эпигенетические изменения ДНК могут являться одним из способов ответа организма на постоянно изменяющиеся факторы окружающей среды.
Корреляция между экспрессией генов и степенью метилирования ДНК выявлена в начале 1980-х годов [261, 372, 745]. Установлено, что метилирование может влиять на интенсивность транскрипции как путем изменения эффективности связывания позитивных и негативных факторов транскрипции с регуляторными участками генов, так и через формирование неактивных участков хроматина (рис. 10.8) [262, 660].
Согласно первому механизму, 5-метилцитозин ингибирует связывание c ДНК некоторых факторов транскрипции (АР-2, c-Myc/Myn, цAMP-зависимый активатор CREB, E2F, NF-kB), мишенями для которых являются последовательности, содержащие CpG-нуклеотиды. Однако некоторые транскрипционные факторы (SF-1, CTF) не чувствительны к метилированию и связываются с участками ДНК, лишенными CpG-динуклеотидов (рис. 10.8) [829].
В реализации второго механизма участвуют белки, которые специфично связываются с метилированными СрG-динуклеотидами и ингибируют присоединение к ДНК факторов транскрипции (рис. 10.8) [466, 660]. Основная роль в этом процессе принадлежит метилцито- зинсвязывающему комплексу (МЦСК), состоящему из 5 основных белков: MBD1, MBD2, MBD3, MBD4 и MeCP2. Все белки этого комп-
1) Прямое взаимодействие 2) Специфические транскрипционные
с транскрипционным фактором репрессоры
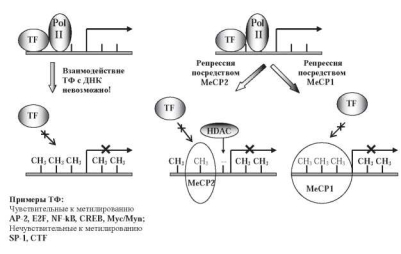
Рис. 10.8. Возможные механизмы репрессии транскрипции посредством изменения метилирования цитозина [792]
лекса, за исключением MBD4, выполняют репрессорную функцию путем изменения структуры хроматина. Белок MBD4 участвует в репарации и предотвращает мутационные изменения метилцитозина [466].
MeCP2 является основным репрессорным белком комплекса МЦСК. При его связывании с одиночными CpG-динуклеотидами репрессорный эффект распространяется на несколько сот пар нуклеотидов. Белок состоит из двух доменов: метилцитозинсвязывающего (MBD), отвечающего за узнавание 5-метилцитозина, и репрессорного (TRD), имеющего сродство к гистондеацетилазе и обеспечивающего блок транскрипции [661]. Взаимодействие ацетилаз с белком MeCP2 определяет ацетилирование около 20 % гистонов. Считается, что именно деацетилирование гистонов лежит в основе инактивации гетерохроматина. При помощи специфических антител было установлено, что белок МеСР2 локализован преимущественно в G-сегментах метафазных хромосом. Эмбрионы мыши, гомозиготные
по делеции гена МеСР2, погибают до рождения, что указывает на важную роль белка МеСР2 в эмбриональном развитии [828].
Мутация в гене MеCP2, локализованном в X-хромосоме человека, приводит к развитию прогрессирующего нейродегенеративного заболевания — синдрому Ретта. Характерные симптомы у пациенток начинают проявляться в возрасте от 6 до 18 месяцев в виде прогрессирующей умственной отсталости с утратой речевых способностей, аутизма и атаксии. Мальчики с мутацией этого гена нежизнеспособны и умирают вскоре после рождения [760].
Вторым метилцитозинсвязывающим белком является MBD2. Этот белок, как и гистондеацетилазы HDAC1, HDAC2 и гистонсвязывающие белки RbAp46, RbAp48, входит в состав комплекса MeCP1. В отличие от МеСР2, для связывания с ДНК ему необходимо несколько CpG-динуклеотидов. Учитывая слабое сродство комплекса MeCP1 к метилированной ДНК предполагается, что он выполняет вспомогательные функции в процессе генной репрессии [611].
В настоящее время установлено, что для репрессии транскрипции необходимо как метилирование ДНК, так и деацетилирование гистонов. Остается, однако, неясным, что является первичным, т. е. определяет ли метилирование ДНК изменения в компактизации хроматина, либо изменения в упаковке хроматина маркируют участки ДНК, где должно происходить метилирование de novo (рис. 10.9). С одной стороны, специфические последовательности ДНК могут взаимодействовать с метилтрансферазами, a последующее присоединение к ДНК метилцитозинсвязывающих белков и гистонацетилазного комплекса приводит к стабилизации хроматина и невозможности присоединения к ДНК транскрипционного комплекса (рис. 10.9, а). С другой стороны, сама структура хроматина может определять последовательности генома, которые должны подвергаться метилированию de novo (рис. 10.9, б). Более вероятно, что вначале осуществляется метилирование определенных последовательностей ДНК, а затем изменяется структура хроматина, в состав которого они входят [666, 744]. Не исключено также, что обе программы просто дополняют друг друга, обеспечивая в процессе клеточной дифференцировки как длительное (перманентное) выключение крупных информационных блоков активного хроматина (конформаци- онные изменения), так и более лабильное (транзиторное) выключение отдельных генов (метилирование).
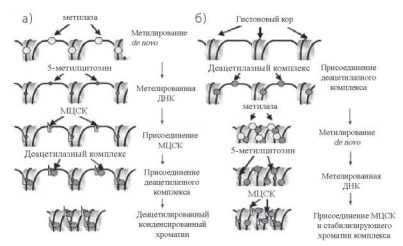
Рис. 10.9. Взаимосвязь между метилированием цитозина в молекуле ДНК и ацетилированием гистонов: а — метилированные участки ДНК определяют локализацию сайтов связывания деацетилазного комплекса; б — присоединение деацетилазного комплекса детерминирует участки, в которых должно происходить метилирование ДНК [666]
Таким образом, метилирование ДНК, влияя на функциональную активность генов и на конформацию хроматина, выполняет множество функций, одни из которых доказаны, другие активно обсуждаются. Так, показана важная роль метилирования в регуляции экспрессии тканеспецифичных генов, в клеточной дифференцировке, в процессах репликации и репарации ДНК, в поддержании геномной стабильности [127]. Предполагается, что метилирование играет важную роль в защите генома от мобильных генетических элементов [256, 682], а также в супрессии «чужеродных» генов, доставленных в клетки с целью коррекции наследственных дефектов [78]. Метилирование в районах с малой плотностью генов, в частности, в участках прицентро- мерного гетерохроматина, по-видимому, необходимо для стабилизации структуры, поддержания конформации и целостности хромосом [392]. В то же время, метилирование цитозина в составе CpG-динуклеотидов в регуляторных элементах генов, как правило, подавляет экспрессию. Наиболее подробно механизмы репрессии генов, обусловленные метилированием, изучены в отношении такого феномена как геномный импринтинг — одного из вариантов эпигенетической наследствен
ности, при котором специфический характер дифференциальной активности генов определяется полом организма, от которого эти гены унаследованы [19, 20].
