Как уже отмечалось, доступность районов конститутивного гетерохроматина в клетках цитотрофобласта для рестрикции эндонуклеазами в значительной степени определяется их деконденсированным состоянием. Учитывая наличие корреляции между конденсацией и метилированием [899], есть основания предполагать, что гипометилированное состояние хромосом должно сопровождаться их деконденсацией. В таком случае, морфометрические характеристики отдельных сегментов хромосом могут быть использованы в качестве критерия для оценки состояния при различных условиях. В этой связи представлялось целесообразным охарактеризовать морфометрические особенности гетерохроматиновых районов хромосом у эмбрионов и плодов человека разных сроков развития.
Единичные работы, выполненные на культурах фибробластов и лимфоцитов человека, показали наличие определенной динамики линейных размеров и селективную нейтральность гетерохроматиновых районов в эмбриогенезе человека [2, 117]. Между тем, условия клеточных культур вряд ли адекватны для суждения о нативном состоянии гетерохроматина в эмбриональных клетках. Такая информация может быть получена только при изучении гетерохроматина in situ или на прямых хромосомных препаратах.
Нами проведено морфометрическое исследование гетерохроматиновых районов хромосом 1, 9 и 16 в спонтанно делящихся клетках цитотрофобласта хориона у эмбрионов и плодов человека 6-20 недель развития. Значительная вариабельность размеров блоков гетерохроматина на «прямых» препаратах не вызывает сомнения. Эти различия особенно резко выражены при сравнении гетерохроматиновых блоков хромосом из хориона с вариантами qh+ в культурах лимфоцитов пуповинной крови плода (табл. 10.6). Обращает на себя внимание факт высокой частоты варианта 9qh+ в клетках цитотрофобласта по сравнению с лимфоцитами, а также тенденция к снижению частоты вариантов qh+ для каждой хромосомы по мере развития плода.
Таблица 10.6. Частоты увеличенных гетерохроматиновых блоков * (qh+) хромосом 1, 9, 16у эмбрионов и плодов человека на разных сроках эмбрионального развития
|
Срок развития, нед. |
Всего клеток |
Хромосома 1 |
Хромосома 9 |
Хромосома 16 |
|||
|
Число qh+ |
% |
Число qh+ |
% |
Число qh+ |
% |
||
|
Клетки цитотрофобласта (прямые препараты) |
|||||||
|
12 |
111 |
18 |
16,2 % |
57 |
51,5 % |
16 |
15,3 % |
|
14-15 |
82 |
21 |
25,6 % |
41 |
50 % |
13 |
15,9 % |
|
18-20 |
199 |
29 |
14,6 % |
89 |
44,7 % |
27 |
14,6 % |
|
ФГА-стимулированные лимфоциты пуповинной крови |
|||||||
|
20-29 |
80 |
10 |
12,5 % |
14 |
17,5 % |
8 |
10 % |
* Размеры блоков оценивались визуально на препаратах метафазных хромосом, окрашенных флуорохромом Hoechst 33258 с контрастированием актиномицином D. Препараты приготовлены стандартными методами из материала, полученного с целью пренатальной диагностики хромосомных болезней
Морфометрические исследования гетерохроматиновых районов проведены на препаратах хориона плодов 6-20 недель развития. Абсолютные и относительные размеры С-блоков хромосом 1, 9 и 16 измеряли на проекции с изображений метафазных пластинок, окрашенных С-методом [148]. От каждого эмбриона анализировали по 10-20 метафазных пластинок в интервале спирализации хромосомы 2 от 6,4 до 11 мкм (в этом интервале, согласно коэффициентам линейной регрессии, не было выявлено отклонений от линейной зависимости).
Характер распределения абсолютных и относительных размеров С-блоков для всех хромосом соответствовал нормальному. Средние значения размеров С-блоков варьировали для каждой хромосомы и не зависели от стадии развития (табл.10.7).
При сравнении полигонов частот абсолютных размеров С-блоков хромосомы 1 обнаружено смещение распределения в сторону больших значений для эмбрионов раннего (6-8 недель) по отношению к поздним (18-20 недель) срокам развития (рис. 10.33, а) Для гетерохроматиновых районов хромосом 9 и 16 такая зависимость не прослеживается (табл.10.6).
Морфометрический анализ этих же сегментов хромосом 1, 9 и 16 в клетках цитотрофобласта был продолжен на препаратах, окрашенных H33258/AcD. Выявляемые при таком способе окраски гетерохроматиновые Q-сегменты исследовали при помощи полуавтомата-
Таблица 10.7. Абсолютные размеры С-сегментов хромосом 1, 9 и 16 в клетках цито- трофобласта на разных стадиях эмбрионального развития
|
Хромосома |
Срок развития, нед. |
Число эмбрионов |
Число хромосом |
Размер С-сегментов Х ± S х, мкм |
|
1 |
6-8 |
9 |
18 |
1,61 ±0,07 |
|
1 |
12 |
4 |
8 |
1,48 ± 0,08 |
|
1 |
14-15 |
5 |
10 |
1,64 ±0,14 |
|
1 |
18-20 |
7 |
14 |
1,39 ± 0,06 |
|
9 |
6-8 |
4 |
8 |
1,24 ±0,04 |
|
9 |
12 |
4 |
8 |
1,29 ±0,13 |
|
9 |
14-15 |
4 |
8 |
1,24 ±0,10 |
|
9 |
18-20 |
5 |
10 |
1,31 ±0,09 |
|
16 |
6-8 |
4 |
8 |
1,09 ± 0,03 |
|
16 |
12 |
4 |
8 |
1,03 ± 0,05 |
|
16 |
14-15 |
4 |
8 |
1,16 ± 0,07 |
|
16 |
18-20 |
5 |
10 |
1,08 ± 0,03 |
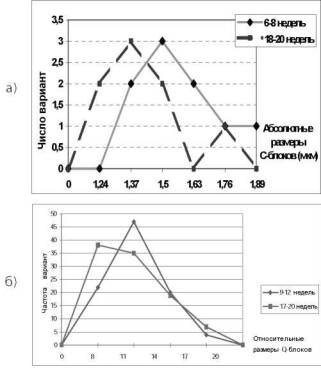
Рис. 10.33. Распределение абсолютных (а) и относительных (б) размеров района 1qh метафазных хромосом в клетках цитотрофобласта хор-иона и плаценты ческой системы анализа изображений с программным обеспечением, позволяющим точно измерять линейные размеры сегментов хромосом (Видео-Тест, Карио 1.5). Для исключения межклеточного полиморфизма от каждого из 129 эмбрионов исследовали по 1 метафазной пластинке, на которых измеряли длину хромосом и соответствующих Q-блоков. Уточнение границ блоков проводили по экстремумам производной кривой яркости. Длину гетерохроматинового сегмента определяли в процентах от длины хромосомы.
Установлено, что характер распределения размеров Q-сегментов гетерохроматина хромосом 1, 9, 16 достоверно отличается от нормального (Гауссового) распределения (tAs gt; 3) и аналогичен полученному на первом этапе исследований С-сегментов (рис. 10.33, б). Вместе с тем,
интересно отметить, что при статистической обработке с использованием дисперсионного анализа двухфакторных неравномерных комплексов зависимость размеров гетерохроматиновых районов от стадии развития оказалась значимой только для блоков 9qh и 16qh (F = 1,00, P gt; 0,05; F = 10,82, P lt; 0,05; F = 3,10, P lt; 0,01 соответственно). Размеры этих же блоков достоверно отличались в цитотрофобласте и тканях зародышевого происхождения у эмбрионов 6-10 недель развития (табл. 10.8). Полученные нами результаты подтверждают полученные ранее данные об увеличении размеров С-блоков хромосом 1, 9 и 16 в экстраэмбриональных тканях по сравнению с эмбриональными [119].
Учитывая очевидные недостатки морфометрического подхода, обусловленные выраженными межиндивидуальными различиями размеров гетерохроматиновых блоков, зависимости их размеров от степени спи- рализации хромосом и способов их окраски, а также от субъективных факторов (способы измерений, пределы допускаемых погрешностей и т. д.), данный подход едва ли может рассматриваться как перспектив-
Таблица 10.8. Сравнение относительных размеров Q-гетерохроматиновых блоков в различных тканях плода (Т-критерий Уайта)
|
Хромосома |
№ эмбриона |
Число проанализированных хромосом |
Т э |
|
|
Эмбриональные клетки |
Клетки цитотрофобласта |
|||
|
1 |
1 |
24 |
5 |
23,5* |
|
1 |
2 |
30 |
2 |
23,5** |
|
1 |
3 |
16 |
7 |
119,5 ** |
|
1 |
4 |
11 |
2 |
15 5 *** |
|
1 |
5 |
1 |
4 |
2 *** |
|
1 |
6 |
10 |
4 |
23,5 ** |
|
9 |
1 |
17 |
3 |
37 ** |
|
9 |
2 |
6 |
6 |
37 ** |
|
9 |
3 |
7 |
4 |
20,5 ** |
|
16 |
4 |
24 |
4 |
59 5 ** |
|
16 |
2 |
28 |
2 |
47 5 ** |
|
16 |
3 |
18 |
9 |
98 ** |
|
16 |
4 |
11 |
4 |
25,5 ** |
|
16 |
5 |
12 |
3 |
21 ** |
p gt; 0,05.
p lt; 0,01.
Нет критического значения.
ный в цитогенетике развития человека. Тем не менее, он позволил установить различия в размерах гетерохроматиновых блоков хромосом 1, 9 и 16 в клетках хориона по сравнению с клетками собственно эмбриональных тканей и тенденцию к уменьшению линейных размеров этих блоков с 6-й по 20-ю неделю внутриутробного развития.
Результаты морфометрического анализа в целом хорошо согласуются с данными по структурно-функциональной организации хромосом, полученными с помощью других, более чувствительных и более специфичных методов (см. раздел 10.3, 10.4). Наличие крупных и, соответственно, менее спирализованных блоков гетерохроматина в ци- тотрофобласте хориона ранних зародышей человека хорошо согласуется с их гипометилированным состоянием в клетках цитотрофобласта и может свидетельствовать в пользу наличия функционально активных «ранних» генов в гетерохроматиновых районах этих хромосом. Выявленная в ходе эмбрионального развития тенденция к уменьшению размеров гетерохроматиновых блоков, которое сопровождается их конденсацией и метилированием, подтверждается молекулярными и иммуноцитохимическими методами. Эти данные служат косвенным доказательством роли конститутивного гетерохроматина в инактивации «ранних» генов.
