ПАТОМОРФОЛОГИЯ
Острое воспаление пульпы характеризуется отеком пульпы, появлением круглоклеточных, гистиоцитарных ограниченных либо диффузных, сливающихся в обширные поля инфильтратов. Затем наступает дистрофия коллагеновых волокон. В стенках сосудов откладывается фибрин. Толща стенок их пронизана лимфоидно-гистио- цитарными элементами и фибробластами, видны гистио- цитарные инфильтраты и по ходу сосудов.
Происходит дезорганизация одонтобластов, при которой характерное плотное расположение рядов клеток полностью утрачивается. При остром воспалении в неодинаковой степени выражены вакуолизация цитоплазмы клеточных элементов, кариопикноз, кариорексис и ка- риолиз.
В ряде препаратов обнаруживается погружение ядер одонтобластов в дентинные канальцы. Из цитоплазмы отдельных одонтобластов полностью исчезает гликоген. Однако острое воспаление существенно не отражается на содержании гистохимически определяемого гликогена в других клетках пульпы. Даже в случаях значительной клеточной инфильтрации в цитоплазме содержатся мелкие и даже крупные зерна и глыбки гликогена, ничем не отличающиеся от обычных, локализующихся в неизмененных гистиоцитах. Количество гликогена в целом снижается. Иногда заметны лишь следы гликогена или он полностью отсутствует.
На ранних этапах воспаления нами [Урбанович Л. И.,
- прослежены дистрофические изменения почти во
всех ультраструктурах фибробластов и гистиоцитов пульпы. Изменения носят в целом обратимый характер, однако при выраженных формах острого воспаления заметна деструкция важных составных органоидов клетки. Такие клетки не способны к активной жизнедеятельности.
Динамика развития патологического процесса показывает, что происходят набухание ультраструктур, гидро- тическая, вакуольная дистрофия, а затем распад элементов и целых конструкций гетерогенной интрацеллюлярной системы.
Вначале изменяется матрикс митохондрий, затем мембранные формирования. В самый поздний период повреждаются структуры ядер. Заметны изменения митохондрий гистиоцитов и фибробластов. По-видимому, они увеличиваются из-за того, что кристы раздвигаются и укорачиваются. Увеличен объем митохондрий. При остром воспалении обнаруживается набухание митохондрий с полным разрушением крист. По нашему мнению, при значительных изменениях эти структуры не способны восстанавливаться. Предполагают, что причиной набухания митохондриального аппарата является нарушение воднобелкового обмена в матриксе гистиоцитов и фибробластов: на электронограммах отечный, просветленный эндо- плазматический ретикулум раздвинут, а в отдельных местах цитоплазма вакуолизирована. В ряде клеток «пустоты» заметно увеличены, слиты в сплошные, сотовидные поля, а органоиды хаотично распределены.
На ранних стадиях острого воспаления в эндоплаз- матической сети расширяются цистерны и уменьшается число рибосом, прикрепленных к мембранам. Извилисты контуры расширений; иногда заметны пузырьки (фрагментация канальцев). Очаги в эндоплазматической сети гистиоцитарных элементов можно трактовать как обратимые явления нарушения белкового метаболизма. Обращают на себя внимание гипертрофия и гиперплазия аппарата Гольджи, выражающиеся в усилении образования мелких пузырьков. Последние скапливаются и окружают уплощенные диктосомы.
При остром воспалении в увеличенных клетках не удается наблюдать рибосомы, гранулы гликогена, липиды и т. д. Отмечается множество базофильных клеток, активация образования макрофагов, очаговая пролиферация клеток и полиморфно-клеточная инфильтрация соединительной ткани по ходу сосудов. Возникают мелкие
А
очаги кровоизлияний на фоне гиперемии пульпы у больных с общими заболеваниями.
Повышена активность ферментов окислительно-восстановительного цикла в цитоплазме клеточных инфильтратов и в клетках периферических отделов коронковой пульпы. Активность их в центральном и перицентральном слоях пульпы умеренная. Наиболее высока активность цитохромоксидазы в очагах воспалительной инфильтрации.
Для острого воспаления пульпы характерно повышение активности сукцинатдегидрогеназы NAD- и NADH- диафоразы и цитохромоксидазы, особенно на участках воспалительной инфильтрации в проекции дна кариозной полости. Повышена активность щелочной фосфатазы, особенно в стенках сосудов.
Характерно состояние основного вещества пульпы: не выявляется гепарин, отсутствуют низкосульфатирован- ные мукополисахариды типа гиалуроновой кислоты. Однако заметно очаговое накопление хондроитинсульфа- тов А и С. Коллагеновые волокна диффузно поражены.
Сосуды коронковой и корневой пульпы полнокровны. В области проекции дна кариозной полости отмечается тромбоз сосудов. Наблюдаются и кровоизлияния, чаще у пожилых людей. Гликопротсиды определяются в виде скоплений в сосудистых стенках.
Нами отмечено, что сосудистые расстройства не всегда тождественны. В одних случаях выявляются гнездовые, ограниченные сосудистые реакции, в других -- диффузные расстройства, распространенные на значительную часть пульпы.
Изменения клеточных органелл в серозно воспаленной пульпе можно считать неглубокими; они носят обратимый характер (набухание митохондрий, деструкция крист, просветление цитоплазмы и пр.). В начальных фазах острого воспаления нервные волокна остаются без особых изменений. Позднее в них появляются реактивные изменения, например в виде аргирофилии (наиболее ранний признак). Отчетливее становится структура нервных волокон, импрегнированных в интенсивно-черный цвет. Из-за гидрофильности вещества и нейроплазмы волокно набухает, появляются варикозные вздутия круглой или овальной формы. Помимо признаков гиперимпрегнации, можно заметить наплывы и натеки нейроплазмы, гомогенизацию и начало фрагментации нервных волокон. Обнаруживаются участки «голых» осевых цилиндров (не вос-
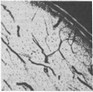
Рис. 11. Серозно-гнойный пульпит. Окраска гематоксилин-эозином. X 60.
принимающих нитрат серебра); белковая их дистрофия. В целом состояние нервных элементов укладывается в рамки реактивных и дистрофических изменений. На некоторых препаратах видна не только деформация, но и гомогенизация нервного волокна.
Для острого серозно-гнойного и гнойного пульпитов характерна лейкоцитарная инфильтрация очагового или диффузного характера (лимфоидные, гистоцитарные элементы) (рис. 11). Заметны фибриноидные изменения в основном веществе (местами фибриноидный некроз вокруг сосудов), участки полного распада ткани. Волокнистые структуры набухшие, «отечные», гомогенизированные. В стенках кровеносных сосудов определяются скопления гликозаминогликанов. В ткани видно образование фибриноида. Нервные волокна представляют пеструю картину: одни интактны, резистентны, другие подвержены деструкции вплоть до полного распада конечных отделов нервных волокон.
Развитие микроциркуляторных расстройств при остром пульпите демонстрирует классическую динамику сосудистой патологии при воспалении, обладая вместе с тем определенной спецификой. Согласно Н. Berman (1962), в плане сосудистых сдвигов наиболее уязвимы те органы, в которых регистрируется «функциональный
тип концевых артерий». Как указывалось выше, пульпа зуба не относится к их числу, но условия ее васкуляриза- ции в достаточной мере благоприятствуют быстрой декомпенсации микроциркуляции при воспалительном процессе. Прежде всего, развиваясь в замкнутой полости, воспаление вскрывает несоответствие между высоким уровнем развития капиллярной сети и потенциями дренажной системы пульпы. Относительная недостаточность последней при патологии связана с особенностями циркуляции тканевой жидкости в пульпе, практически лишенной лимфатических микрососудов, с «легкостью» сдавления экссудатом тонкостенных венулярных коллекторов, проходящих в узком корневом канале, и т. д. При диффузных глубоких повреждениях пульпы эти факторы резко повышают функциональную нагрузку системы и способствуют ее дизадаптации.
Очевидно, что пусковым механизмом сосудистой реакции при остром пульпите является выброс вазоактивных веществ, высвобождающихся (или активирующихся) в результате альтерации ткани пульпы и жизнедеятельности вирулентной флоры (бактериальные эндотоксины). Последовательное, «каскадное» включение различных механизмов тканевой системы медиации воспаления (гистамин, серотонин, лизосомальные гидролазы, кинины, контактный фактор Хагемана, производные активации комплемента, простагландины и пр.) обусловливает сочетанное проявление изменений гемодинамики, реологических свойств крови и сосудистой проницаемости. Их комбинация реализует развитие экссудативной фазы воспаления, повышение гидростатического давления в полости зуба и как следствие возникновение боли. В генезе этого симптома важную роль играет также раздражение рецепторных окончаний продуктами анаэробного гликолиза (результат развившейся гипоксии ткани) и повышение их болевой чувствительности медиаторами воспаления, в частности брадикинином [Струков А. И., Серов В. В.,
- . Кроме того, как уже говорилось, пульсирующий характер боли может быть связан с периодическим шунтированием кровотока по артериоло-венулярным анастомозам как приспособительной реакции на изменение гемодинамических констант в капиллярном русле.
Существование различных форм острого пульпита может отражать варианты течения воспалительного процесса. Предполагается, что острое воспаление в пульпе, как правило, протекает по гиперергическому типу [Рыба
ков А. И., Иванов В. С., 1980], т. е. носит характер воспаления на иммунной основе (аллергическое воспаление) . Пра вомерность этого заключения обусловлена, во-первых, возможностью сенсибилизации пульпы микроорганизмами и продуктами их обмена, во-вторых, скоростью распространения экссудативно-некротических явлений, приводящих к гибели пульпы. Характер сосудистых сдвигов с ярко выраженным в большинстве случаев геморрагическим компонентом дополняет эту аргументацию.
В патогенезе реакций гиперчувствительности немедленного типа ведущее место занимают иммунные комплексы, осаждающиеся на клеточных мембранах, в том числе на мембранах эндотелия, и активирующих систему комплемента с выделением всех медиаторов воспаления и производных комплемента (в частности, хемо- таксических факторов, анафилотоксина и др.), потенцирующих повреждение сосудистой стенки и ее «пороз- ность» [Хорст А., 1982].
Независимо от формы острого пульпита патология микроциркуляции проявляется комплексом изменений во всех трех компонентах системы кровь - сосудистая стенка — интерстициальное пространство. Внутрисосу- дистые нарушения манифестируются морфологическими признаками реологических расстройств, режима гемодинамики. На фоне выраженной дилатации микрососудов, с максимумом в венулярном звене наблюдается изменение агрегатного состояния крови: краевое состояние (адгезия) лейкоцитов и тромбоцитов, агрегация форменных элементов крови (преимущественно эритроцитов), стаз, микротромбозы. Агрегация эритроцитов по типу «сладж» может привести к блокаде обширных сегментов русла. Эти явления первоначально развиваются в посткапилляр- ных сосудах и венулах и затем распространяются на капиллярное звено.
Степень выраженности воспалительной гиперемии зависит от формы пульпита, но ее следствием всегда является замедление кровотока и как результат недостаточная перфузия микроциркуляторного русла. Этот механизм является ведущим патогенетическим фактором в развитии гипоксии ткани пульпы и прогрессировании ее дистрофических изменений. Застойные явления, общее изменение тканевого гомеостаза вызывают значительную перестройку геометрии микроциркуляторного русла. Изменение калибра сосудов, увеличение их извилистости
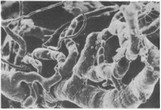
Рис. 12. Микроварикозность и извилистость микрососудов. Острый гнойный пульпит, коронковая пульпа.X200.
и появление микроварикозностей (рис. 12) в свою очередь усугубляют расстройства гемодинамики.
Нарушения терминального кровообращения с падением линейной скорости кровотока и изменением реологических свойств крови сопряжены с глубоким повреждением гематотканевых барьеров, повышением сосудистой проницаемости, проявляющейся плазморрагиями и экстраваскулярной миграцией клеток крови (лейко- и эритродиапедез). Характерно, что процесс экссудации охватывает все звенья микроциркуляторного русла, но степень «порозности» сосудистой стенки прогрессивно возрастает от артериолярного к венулярному отделу. Это находит отражение в некоторых особенностях изменения структуры отдельных типов микрососудов.
Атериолярные микрососуды в участке воспаления отличаются вариабельностью просвета, величина которого в определенной мере коррелирует со степенью дистрофических изменений сосудистой стенки. Значительная часть этих сосудов приобретает вид неравномерно суженных трубок с резко утолщенной вследствие плазматического пропитывания стенкой, утратившей характерную струк- туру (рис. 13). Часто наблюдаются набухание и десквама- ция эндотелиальных клеток, периваскулярные инфильтра-
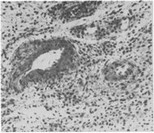
Рис. 13. Плазматическое пропитывание и деструкция стенок артерио- лирных микрососудов. Острый серо.чно-гнойный пульпит.X200.
ты. Субмикроскопически выявляются резкое изменение конфигурации эндотелия, его деструкция с «оголением» отечной базальной мембраны, разобщение миоэндотели- альных и миомиоцитарных контактов, повреждение органелл (рис. 14). Аналогичным изменениям подвергаются и прекапиллярные микрососуды. Несмотря на глубокое повреждение структуры, стенка артериол, как правило, остается непроницаемой для клеток крови, пери васкулярный отек здесь также не достигает значительного уровня.
Более яркие проявления повышения сосудистой про ницаемости регистрируются в капиллярном и посткапил- лярном отделах русла. В большинстве этих микрососудов расширение просвета сопровождается резким истончением эндотелия, появлением в нем множества везикул и вакуолей, набуханием митохондрий, активацией лизо сомального аппарата (рис. 15). Ядросодержащие зоны эндотелиоцитов часто выбухают в просвет сосуда, как бы сокращая его емкость (рис. 16). Везикулы и вакуоли в
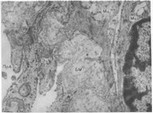
Рис. 14. Дистрофические изменения ультраструктуры артериолы.Х X Ю ООО.
ПрА — просвет артериолы; Эп — эндотелиоцит; ЬМ базальная мембрана; Мц — миоцит.
эндотелиальных клетках проявляют тенденцию к слиянию с образованием трансэндотелиальных каналов. В комплексе с формированием межклеточных щелей эти каналы составляют основу «дефектности» эндотелиальной выстилки, образования «локусов утечки» [Rhodin A. G. et а 11974; Casley-Smith U., Window J., 1976]. Наличие «дефектов» в стенке капилляров и венул открывает широкую возможность экстраваскулярного транспорта макромолекул и клеток крови. Следствием массированного выхода плазменных белков и, соответственно, повышения онкотического давления в интерстиции является усиление фильтрации жидкости с нарастанием периваскулярного отека.
По мнению А. М. Чернуха и соавт. (1975), в условиях патологии процесс микровезикуляции и вакуолизации эндотелия играет двойную роль: с одной стороны, защитную и адаптационно-компенсаторную как механизм дегидратации эндотелия и перикапиллярных тканей, с другой — патогенетическую, связанную с образованием трансэндотелиальных течей и деструкцией клеток. Очевидно, что исход мобилизации этого приспособительного
Рис. 15. Изменение конфигурации стенки посткапилляра, локальная облитерация просвета клапаноподобной складки эндотелия с отложением фибрина (указано стрелкой), вакуолизация цитоплазмы эндоте- лиоцитов. Острый серозно-гнойный пульпит.X 15 ООО.
Эц — эндотелиоцит; БМ — базальная мембрана; В — вакуоль; AB — агрегаты везикул.
Рис. 16. Выбухание ядросодержащих зон эндотелия в просвет ляра, краевое стояние тромбоцитов, перикапиллярный отек, серозно-гнойный пульпит.X9000.
Эц — эндотелиоцит; Тц — тромбоцит; БМ базальная мембрана.
механизма предрешает способность системы микроциркуляции в целом преодолеть последствия функциональных перегрузок. Возможно, с позиций адаптации русла следует оценивать и формирование клапаноподобных складок эндотелия посткапилляров и венул как дополнительных регуляторов кровенаполнения сосудов. Вместе с тем на этих структурах часто обнаруживаются преципитаты плазменных белков, т. е. их появление увеличивает опасность тромбообразования и облитерации просвета микрососуда (см. рис. 15).
Степень повреждения базальной мембраны варьирует в различных микрососудах (интактная, истонченная и частично фрагментированная и т. д.). Часто, преимущественно в венулах, отмечается резкое утолщение и уплотнение базальной мембраны с локальным отслоением ее от эндотелия (рис. 17). Очевидно, этот феномен является следствием плазматического пропитывания сосудистой стенки, распространяющегося на периваскулярные структуры. При экспериментальном пульпите выявлено изменение химических параметров базальной мембраны [Григорьян А. С., 1965]. Как правило, в таких сосудах параллельно наблюдается утолщение эндотелия, выраженное повышение осмиофилии цитоплазмы, обилие в ней микрофиламент. Рельеф люминальной поверхности искажается, просвет сосуда суживается; в просвете и на плазмолемме эндотелиоцитов откладывается фибриллярный материал. Прогрессирование перечисленных процессов приводит к глубоким дистрофическим изменениям структуры эндотелиальных клеток, полной или частичной облитерации просвета сосуда тромботическими массами (рис. 18). Это вызывает выключение из циркуляции значительной части капилляров и мелких венул и способствует дальнейшему нарушению трофики пульпарной ткани.
Снижение тканевого давления кислорода, нарастание давления СО? и накопление кислых метаболитов усиливают ацидоз и неблагоприятно влияют на состояние сосудистой стенки, т. е. создается ситуация «порочного круга». Кроме того, прекращение пассажа крови через отдельные сегменты емкостного звена русла результируется ростом посткапиллярного сопротивления с повышением гидростатического давления в обменных сосудах. Комбинация пролонгированного повышения внутрикапилляр- ного давления и проницаемости сосудов поддерживает активную экссудацию.
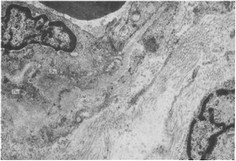
Рис. 17. Утолщение и локальное отслоение базальной мембраны венулы вследствие плазморрагии, плазматическое пропитывание периваскулярных структур. Острый гнойный пульпит.X7000.
Эц — эндотелиоцит; Пц — перицит; БМ — базальная мембрана.
Рис. 18. Резкое утолщение н уплотнение эндотелия и базальной мембраны венулы, деструкция органелл, формирование гиалиновых масс в просвете сосуда.X 12 ООО.
Эц — эндотелиоцит; МФ — микрофиламенты; БМ — базальная мембрана.
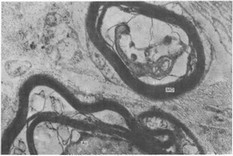
Рис. 19. Дистрофические изменения нервных проводников при остром серозно-гнойном пульпите.Х9000. Ас — аксон; МО — миелиновая оболочка; Л — леммоцит; БВ — безмякотное волокно.
Общепризнано, что решающим условием ликвидации отека является восстановление динамического равновесия между фильтрацией и реабсорбцией жидкости. Как уже подчеркивалось, дренажная система пульпы недостаточно совершенна. Эффективный дренаж пульпарной ткани при отеке в определенной мере блокируется нарушением архитектоники внесосудистых транспортных коммуникаций, что связано с изменением структурно-химических параметров волокнистого каркаса пульпы и дезинтеграцией межклеточных путей циркуляции лимфы в одонтобластическом слое. Узость корневого канала, сдавление экссудатом ткани и сосудов корневой пульпы препятствуют свободному оттоку крови и лимфы из отечной пульпы в сосуды периодонта.
В результате «сбоя» компенсаторно-приспособительных механизмов системы микроциркуляции пульпа быстро заполняется экссудатом, клеточный состав которого зависит от формы воспаления. Постоянно определяются эритроциты и сегментоядерные лйкоциты; при гнойном воспалении последние буквально пронизывают ткань пульпы, маскируя ее структуру. Лейкоцитарная инфильтрация ткани пульпы сопровождается активной макро- фагальной реакцией, особенно выраженной в периваску- лярных пространствах; здесь же часто встречаются лаб- роциты. При описании морфологии интактной пульпы упоминалось, что лаброциты не являются ее постоянным клеточным компонентом. Выявление их при остром пульпите интересно в плане обсуждения вопроса о происхождении этих клеток и их миграционных потенциях. Высокая концентрация в пульпе микро- и макрофагальных элементов является защитным механизмом, направленным на резорбцию воспалительного инфильтрата. Ультраструктура макрофагов свидетельствует о значительном функциональном напряжении клеток.
Характеризуя состояние микроциркуляторной системы при остром пульпите, нельзя обойти вниманием вероятность ее вовлечения в нейродистрофический процесс. Основанием для этого служат сообщения о распространенном повреждении нервных проводников пульпы вплоть до полной дегенерации. Дистрофическим изменениям в равной мере подвержены мякотные и безмякотные волокна (рис. 19). В безмякотных волокнах дегенерация протекает по «светлому» типу [Давыдова Г. Д., Мазурская П. 3., 1973] с резким просветлением матрикса нейроплазмы, набуханием митохондрий, дезориентацией
и редукцией нейрофибрилл. В мякотных волокнах дегенерация проявляется разволокнением и частичной гомогенизацией миелиновой оболочки, формированием миелиноподобных структур, деформацией и дистрофическими изменениями аксона. Очевидно, что нарушение иннервации пульпы может быть еще одной причиной быстрой дизадаптации системы микроциркуляции в условиях острого воспаления.
В заключение отметим, что сосудистая реакция наиболее активна в коронковой пульпе и лишь при неблагоприятном течении воспалительного процесса распространяется на корневую пульпу и периодонт. Эта особенность связана с различиями уровня васкуляризации и тканевого состава названных отделов пульпы.
Источник: Иванов В. С, «Воспаление пульпы зуба» 1990
А так же в разделе «ПАТОМОРФОЛОГИЯ »
- МЕСТО ПУЛЬПЫ ЗУБА СРЕДИ ДРУГИХ СОЕДИНИТЕЛЬНОТКАННЫХ ОБРАЗОВАНИЙ
- БИОЛОГИЯ ПУЛЬПЫ
- ОСОБЕННОСТИ ФУНКЦИЙ ПУЛЬПЫ
- ОСТРОЕ ВОСПАЛЕНИЕ ПУЛЬПЫ ЗУБА
- ЭПИДЕМИОЛОГИЯ
- этиология
- ПАТОГЕНЕЗ
- КЛАССИФИКАЦИЯ И КЛИНИКА ПУЛЬПИТОВ
- ДИАГНОСТИКА И ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА
- Симптоматика
- Объективное исследование
- КЛИНИКА
- Гиперемия пульпы.
- Серозный диффузный пульпит.
- Серозно-гнойный очаговый пульпит.
- Гнойный диффузный пульпит.