Необходимость внедрения в практику здравоохранения клинической иммунодиагностики и целенаправленной оценки иммунного с гатуса обусловлена первичными формами иммунодефицитов, часто своевременно не диагностируемых и тяжело протекающих, значительной распространенностью вторичной иммунной недостаточности, которая развивается при многих хронических заболеваниях, после оперативных вмешательств, тяжелых травм, стресса, на фоне почечной недостаточности и становится причиной гнойно-септических осложнений, более тяжелого течения хронической патологии, неэффективности традиционной терапии, развития аутоиммунных заболеваний. Различные стрессовые состояния и экстремальные ситуации, нарушение сбалансированности питания с дефицитом белков, витаминов, микроэлементов, длительная антибиотико-хи- миолучевая терапия также сопровождаются вторичной иммунной недостаточностью.
Развитие иммунной системы у детей. Становление и развитие иммунной системы служат основой возрастной устойчивости или подверженности детского организма определенным заболеваниям бактериальной, вирусной, грибковой, паразитарной природы, реакции на операционную травму и уремическую интоксикацию, что также приводит к им.мунодефициту.
Во время беременности устанавливаются сложные иммуноге- нетические взаимоотношения между организмом матери и плода, назначение которых состоит в обеспечении сосуществования двух различных организмов, так как половину антигенных белков ребенок наследует от отца. Иммунная система беременной проявляет известную толерантность по отношению к антигенам плода (т.е. отца), что в значительной мере обеспечивается плацентарным барьером. Клетки трофоблаота отличаются почти полным отсутствием антигенов тканевой совместимости FILA И класса, поэтому не способны индуцировать реакции отторжения. Кроме того, во время беременности женский организм, плацента и плод синтезируют ряд гуморальных супрессорных факторов: хорионический гонадотропин, белки беременности — супрессорные факторы трофобласта, альфа-фетопротеин, уромодулкн и белок Тамма-Хорсфолла, супрессорные опиоидные пептиды, стероидные гормоны.
Синтез собственных иммуноглобулинов у плода начинается между 10-й и 12-й неделями гестации. Плод синтезирует незначительные количества IgG, но его синтез резко повышается в последние недели гестации. Плазматическая концентрация у новорожденного может быть даже выше, чем в крови матери, в результате активного транспорта материнского IgG через плаценту. При внутриутробном контакте с антигенами иммунная система плода отвечает нарастанием синтеза IgM. Повышенная концентрация IgM в пуповинной крови (более 0,3 г/л) свидетельствует об антигенной стимуляции плода или о внутриутробном инфицировании. Материнские антитела, относящиеся к классу IgM, через плаценту не переходят, что объясняет недостаточную защищенность новорожденных против грамотрицательных бактерии (кишечная палочка, сальмонелла). IgA и IgE также не поступают плоду от матери. Продукция IgE осуществляется самим плодом, что создаст условия для его сенсибилизации аллергенами, проникшими из материнского кровотока через плаценту. Синтез IgA начинается только после рождения.
Зачатки вил очков ой железы обнаруживаются у эмбриона в возрасте 6 недель, Т-лимфоциты появляются в тимусе плода на 12-й неделе внутриутробной жизни, а между 12-й и 16-й неделей становится различимой супрессорная и хелперная функции субпопуляций Т- клеток. В начале II триместра на лимфоцитах плода удается выявить Н LA-антигены. Способность к реакциям бластной трансформации в ответ на митогены появляется на 12-14-й неделе, примерно в эти же сроки, с 16-й недели, начинают проявляться реакции гиперчувствительности замедленного типа (ГЗТ).
В процессе созревания Т-лимфоциты проходят несколько стадий: сначала это пре-Т-лимфоциты, выявляемые по маркерам CD2 (эпитопы, связывающие эритроциты барана in vitro). В вилочковой железе прс-Т-клетки приобретают дополнительные антигены CD1 (маркер незрелых тимоцитов), CD4 (хелперы) и CD8 (супрессоры). Окончательное созревание сопровождается появлением общих маркеров Т-лимфоцитов CD3 и CD5, при этом эпитоп CD1 исчезает.
Абсолютное число лимфоцитов в криви ниворождениых резко возрастает после 5-го дня жизни, а процентное содержание отдельных субпопулиций нс имеет существенных различий по сравнению с показателем у взрослых. У новорожденных маркировка субпопуляций [to иммунофенотипам CD не всегда соответствует их функциям (Хлыстова З.С., 1987; Вельтищев Ю.Е., 1991, 2004).
Иммунная система новорожденных находится в состоянии физиологической депрессии.
Биологический смысл супрессорной направленности иммунных реакций в периоде новорожденное!и состоит в предупреждении риска тяжелой иммунокомплексной патологии и других иммунопатологических реакций, неизбежных при контакте родившегося ребенка с огромным лиспом антигенов. Особенности межклеточного взаимодействия в иммунном ответе новорожденных обусловлены также низкой чувствительностью Т-клеточных рецепторов к интерлейкину-2 и цитокинам. Низкая продукция интерферона (гамма) определяет слабую противовирусную защиту.
У новорожденных недостаточны реакции активации системы комплемента, что отражает низкие плазматические концентрации отдельных компонентов классического пути активации — Cl г, С2, СЗ, С4 (в 2 раза ниже уровня взрослых). Во многом это объясняет низкую опсоническую активность крови новорожденных и слабость
3 Досиня VfXJjIOl им
фагоцитарной ант ибакгериальной защиты. У них установлена также недостаточность альтернативного пути активации комплемента.
Материнские антитела класса IgG защищают новорожденных и детей первых месяцев жизни от дифтерийного токсина, вирусов полиомиелита, кори, краснухи, менингококков и стрептококков, отчасти от возбудителя столбняка Пйл у период элиминации (или катаболизма) материнских антител класса IgG составляет 21 сутки. При крайне ограниченном синтезе TgG организмом ребенка это ведет к существенному снижению концентрации IgG в крови между 3-м и 6-м месяцем жизни.
Первый контакт с незнакомым антигеном у ребенка 1-го года жизни проявляется как первичный иммунный ответ через повышение синтеза антител класса IgM. Иммунологическая память в этом случае не сформируется. Лишь в процессе роста ребенка происходит переключение 1уморальных реакций иммунного ответа с синтеза IgM на синтез IgG-антител, что обеспечивается генами переключения иммунного ответа или swirch-генами.
К концу 1-го года жизни в крови количество IgG соответствует примерно 50%, IgA — только 30% средних значений у взрослых. К концу 2-го года жизни содержание IgM и IgG составляет уже около 80% значений взрослых, a IgA — около 40%. Содержание IgM в крови достигает уровня у взрослых к 3 годам жизни. Собственные секреторные IgA и секреторный фрагмент sc отсутствуют в секретах слизистых оболочек у новорожденных и появляются после 3-го месяца жизни На протяжении первых 3-4 лет жизни их концентрация в слюне, назальных секретах в 4-5 раз ниже, чем у взрослых. Это дает основание говорить о физиологической недостаточности системы местного иммунитета у детей раннего возраста. Эта недостаточность частично компенсируется при грудном вскармливании.
Недостаточность IgA в слизистой оболочке кишечника, наряду с повышенной проницаемостью кишечной стенки, предопределяет высокую частоту кишечных инфекций и пищевой аллергии у грудных детей.
С возрастом ребенка мало изменяются иммунофенотипы лейкоцитов и лимфоцитов, циркулирующих в крови, но изменениям подвергается их чувствительность к цитокинам и интерлейкинам. На 2-м году жизни проявляется отчетливая активизация функций Т-лимфоцитов-хелперов (CD4) способностью к развитию аутоиммунных процессов. До этого периода существует относительная недостаточность функций Т-хелперов (Вельтищев Ю.Е., 1991, 2004; Hitzig W.H., 1986; Marsh D.G. et ah, 1990).
И препубертатном периоде происходит второй перекрест в формуле белой крови: количество циркулирующих лимфоцитов снижайся, начинают преобладать нейтрофилы. Циркулирующие в крови ребенка лимфоциты обладают большой иммунологической памя- п.ю, поэтому сокращается пролиферация неспециализированных лимфоцитов. Органы иммунной системы, прежде всего вилочковая железа, начинают претерпевать обратное развитие — инволюцию. II процессе роста ребенка существуют определенные «критическиеgt;gt; периоды развития иммунобиологической реактивности, когда на ант игенные воздействия иммунная система дает неадекватный или даже парадоксальный ответ: он может оказаться недостаточным для защиты либо чрезмерным — гиперергическим (рплерлячеекм).
Первый критический период — период новорожденное™ (первые А педели, или 28 дней, жизни). Иммунитет пассивный (материнские антитела), собственная иммунная система находится в состоянии супрессии. Система фагоцитоза не развита. Новорожденный проявляет слабую резистентность к условно патогенной, гноеродной, грамотрицательной флоре. Организм ребенка склонен к генерализации микробно-воспалительных процессов, а также септическим состояниям. Очень высока чувствительность к вирусным инфекциям, против которых ребенок не защищен материнскими антителами. Примерно на 5-е сутки жизни осуществляется первый перекрест в формуле белой крови, устанавливается абсолютное и относительное и рсобладание лимфоцитов.
Шорой критический период — 4-6 месяцев жизни. Происходит ослабление пассивного гуморального иммунитета в связи с катаболизмом материнских антител. Сохраняется супрессорная направленность иммунный реакций при выраженном лимфоцитозе в крови. Содержание иммуноглобулинов в крови падает до критических значений. На большинство антигенов (инфекции) развивается первичный иммунный ответ с преимущественным синтезом IgM-анти- тгл, не оставляющим иммунологической памяти. Иммунный ответ такого типа наступает также при вакцинации против инфекционных шболеваштй и только ревакцинации формируют вторичный иммунный ответ с продукцией антител класса IgG. Вакцинация может не повлечь за собой развития первичного иммунного ответа, если в крови детей еще циркулируют материнские антитела или перед вакцинацией дети получал и препараты кропи, гамма-глобулина. В таких случаях первичный нестойкий иммунный ответ развивается лишь мосле ревакцинации (Вельтищеь Ю.В., 2004).
Проявляется недостаточность системы местного иммунитета (повторные ОРВИ, кишечные инфекции и дисбактериоз, кожные заболевания). Дети высокочувствительны к респираторному синцитиальному вирусу, ротавирусу, вирусам парагриппа, аденовирусам (высокая подверженность воспалительным процессам органов дыхания, кишечные инфекции). Вирус гепатита В редко вызывает желтушные формы болезни и чаще служит причиной акродерматита (синдрома Крости-Джанотти). Атипично протекают коклюш, корь, не оставляя иммунитета. Дебютируют многие наследственные болезни, включая первичные иммунодефициты. Резко нарастает частота пищевой аллергии, маскирующей у части детей атопический (реаги- новый) диатез (Всльтишев Ю.Е., 1988).
Третий критический период —• 2-й год жизни. В этот период значительно расширяются контакты ребенка с внешним миром (свобода передвижения, социализация). Сохраняется первичный иммунный ответ на многие антитела (синтез IgM), хотя иммунный ответ в большей степени переключается на образование антител класса IgG, однако синтез антител субклассов IgG2 и IgG1 ограничен. Супрессорная направленность иммунной системы сменяется постепенным преобладанием функций хелперов, что связывается нс столько с созреванием Т-лимфоцитов хелперов, сколько с повышением чувствительности В-лимфоцитов к интерлейкинам. Система местного иммунитета остается неразвитой, дети чувствительны к вирусным и микробным инфекциям. Полисахаридные антигены отдельных серотипов пневмококка (гемофилус) не индуцируют гуморального иммунитета Он не вырабатывается и по отношению к па точке инфлюэнцы у ЗО?^ детей в связи с физиологическим дефицитом lgG2. В этот период впервые проявляются многие первичные иммунодефициты, минорные аномалии иммунитета, аутоиммунные и иммунокомплексные болезни (гломерулонефоит, васкулиты и др.). Дети склонны к повторным вирусным и микробно-воспалительным заболеваниям органов дыхания, ЛОР-органов.
Становятся более четкими признаки иммунодиатезов (атопического, лимфатического, аутоаллергического), проявления пищевой аллергии постепенно ослабевают. По иммунобиологическим характеристикам значительная часть детей 2-го года жизни не готова к пребыванию в детском коллективе.
Четвертый критический период — 6-7-й год жизни. В содержании форменных элементов крови происходит второй перекрест, абсолютное и относительное количество лимфоцитов уменьшается. Средйяя
концентрация IgG и IgM в крови соответствует уровню взрослых, но плазматический уровень IgA еще не достигает окончательных значений. Содержание IgE в плазме крови максимальное по сравнению с показателем в других возрастных периодах, что отчасти обусловлено довольно частыми в этом возрасте паразитарными инфекциями — лямблиозом, гельминтозами. Соотношение хелперной и супрессорное функций Т-лимфоцитов соответствует зрелым реакциям организма. Система местного иммунитета у большинства детей все еще не завершает своего развития. Нарастает частота атопических, иммунокомплексных, паразитарных заболеваний, проявлений поздних иммунодефицитов. Формируются многие хронические заболевания полигонной природы (Marsh D.G. et al., 1990).
Пятый критический период — подростковый возраст (у девочек г 12-13 лет, у мальчиков с 14-15 лет). Пубертатный скачок роста сочетается с уменьшением массы лимфоидных органов. Секреция половых гормонов (андрогенов) ведет к подавлению клеточного звена иммунитета и стимуляции его гуморального звена. Содержание IgE в крови снижается. Окончательно формируется сильный и слабый ч ины иммунного ответа (экспрессия 1г- и Is-генов). Нарастает воздействие экзогенных факторов (курение, ксенобиотики идр.) на иммунную систему. Повышается чувствительность к микобактери-
Таблица 4.12
Нормальная концентрация иммуноглобулинов в сыворотке крови новорожденных, детей до 16 лет и взрослых (мг/мл)
|
Возраст |
IgG |
IgA |
IgM |
|
1-15 сут |
5,73-12,68 |
Нет |
0,01-0,94 |
|
16 сут-3 мес |
2,23-6,56 |
0,08-0,69 |
0,22-1,07 |
|
4-6 мес |
2,22 6,98 |
0,33-1,51 |
0,49-1,5 |
|
7-12 мес |
3,39-11,99 |
0,37-1,61 |
0,58-1,57 |
|
13-24 мес |
4,98-12,50 |
0,35-2,05 |
0,47-1,78 |
|
24-36 мес |
5,70-11,85 |
0,74-2,07 |
0,49-1,28 |
|
4-5 лет |
5,50-14,18 |
0,73-2,8 |
0,51-1,38 |
|
6-8 лет |
6,53-14,32 |
1,06-3,13 |
0,63-1,64 |
|
9-11 лет |
6,25-14,76 |
1,03-4,61 |
0,61-1,43 |
|
12—16 лет |
6.04-14,32 |
1,41-4,69 |
0,51-1,6 |
|
Взрослые |
7,20-16,37 |
1,92-5,38 |
0,61-1,6 |
ям (туберкулез). После некоторого спада отмечается новый подъем частоты хронических воспалительных, а также аутоиммунных и ч 11 мфопролиферативных заболеваний.
Учитывая изложенное, практически любой ребенок, проходящий лечение в урологическом стационаре, должен пройти иммунологическое обследование. Иммунокоррекция должна быть необходимой составляющей комбинированного лечения.
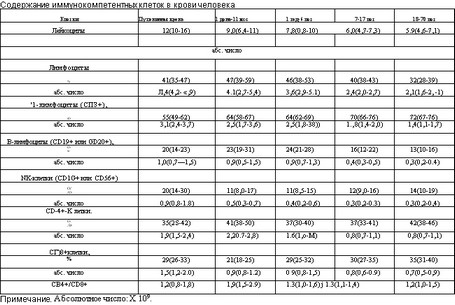
Важное место при обследован иг. ребен ка с урологическими заболеваниями занимают: количественное определение субпопуляции лимфоцитов, фагоцитарная активность крови, окислительно-восстановительная активность нейтрофилов, количественное определение иммуноглобулинов (табл. 4.12, 4.13).
Количественное определение субпопуляций лимфоцитов с помощью проточной лазерной цитометрии с использованием моноклональных антител с двойной меткой
Лимфоциты человека подразделяются на три основные популяции: Т-лимфоциты, В-лимфоциты и натуральные киллеры. Эта классификация основана на их биологических функциях и экспрессии поверхностных клеточных антигенов. Фенотипирование лимфоцитов, т.е. определение уровня экспрессии поверхностных дпфференцвровочных антигенов лимфоцитов, широко используется и иммунодиагностике и иммунокоррекции. Диагностическую значимость имеет как процент клеток, несущих на своей поверхности искомый антиген, так и интенсивность свечения позитивных клеток, характеризующая выраженность экспрессии антигена на поверхности клеточной мембраны.
Процентный состан 'Г- и В-лимфоиитон определяют при характеристике некоторых форм нммунодефицитных, аутоиммунных п дпмфопролиферативных состояний. Содержание активированных Т-лимфоцитов может повышаться при иммунной активации, вызванной мочевой инфекцией или отторжением трансплантата. Количественная оценка хелперов/индукторов и цитотоксических Т-лимфоцитов, а также определение их соотношения (иммуноре- гуляторный индекс) важны при исследовании иммунного статуса пациентов с иммунодефицитными состояниями, аутоиммунными заболеваниями или иммунными реакциями, такими как реакция отторжения трансплантата или реакция «трансплантат против хозяина». Натуральные киллеры обладают цитотоксическими свойствами по отношению к опухолям и к клеткам, пораженным вирусами.
При количественной оценке субпопуляций лимфоцитов в клинической практике следует учесть, что результаты, не соответствующие нормативным показателям, еще не свидетельствуют о наличии патологического состояния, и, наоборот, нормальные значения субпопу- лмций лимфоцитов могут наблюдаться и у пациентов с отклонениями в функционировании иммунной системы, поэтому лечащий врач должен больше обращать внимание не на отклонение показателей от нормы, а на соответствие отклонения показателя, значимого при той или иной патологии, клинической картине заболевания Иными с ловами, фенотитшрование лимфоцитов используется для подтверждения или опровержения диагноза, а также для мониторинга состояния иммунной системы пациента в процессе лечения.
Определение общей окислительно-восстановительной активности нейтрофилов в тесте восстановления нитросинего тетразолия (НСТ)
У здоровых людей нейтрофилов, спонтанно восстанавливающих НСТ до диформазана. не более 10%.
Поскольку способность к спонтанному восстановлению НСТ свидетельствует о «метаболическом взрыве», возникающем ь нейтрофиле в связи с фагоцитозом, этот тест можно использовать для дифференциальной диагностики бактериальных (высокие результаты НСТ-теста) и небактериальных (нормальные результаты НСТ-теста) заболеваний, протекающих с лихорадкой, лейкоцитозом, высокой СОЭ и другими клинико-лабораторными проявлениями воспалительных процессов. В то же время следует помнить, что число НСТ- положительных нейтрофилов увеличивается также при грибковых поражениях, туберкулезе. Кроме того, высокие результаты ПСТ-теста наблюдаются при многих пебактериальных процессах, связанных с интенсивной резорбцией и внутриклеточным расщеплением: обширных оперативных вмешательствах, онкологической патологии.
НСТ-тест не только выявляет фагоцитирующие нейтрофилы, но и характеризует их ферментные системы, поскольку интенсивность восстановления НСТ (СЦК) отражает энергетические процессы, обеспечивающие наработку биоокислигелей бактерицидного действия (перекись водорода, супероксидный анион кислорода, синг- летпый кислород). В связи с этим СЦК НСТ-теста может служить дополнительным критерием оценки бактерицидной функции нейтрофилов.
Непредвиденные отрицательные или низкие результаты спонтанного НСТ-теста, расходящиеся с клиническими данными, рас- сматривиютс я как показание для выполнения стимудцрованного ИСТ-теста.
В норме число НСТ-положите пьных нейтрофилов в результате стимуляции возрастает до 40-80%, индекс стимуляции составляет
- 10.
Снижение показателей НСТ-теста, свидетельствующее 0 сниже_ пии спонтанной и стимулированной фагоцитарной и бактерицидной функции, может быть обусловлено патологией самих Нейтрофилов (хронический гранулематоз, дефицит миелопероксидазы Или гпюк0_ зо-6-фосфат-дегидрогеназы нейтрофилов) и/или дефицИТом гумо. раЛЬных факторов, обеспечивающих нормальный фагоцитоз (агам. мнглобулинемия врожденная или приобретенная, у ослабленных больных хроническими заболеваниями, в результате hmv , сивной терапии и т.д.). В комплексе с другими методами стимулированный НСТ-тест позволяет прогнозировать течение заболевания •дефективность проводимой терапии.
Исследование фагоцитарной активности крови
Метод основан па определении положительной и гц- ариваю- щей способности нейтрофилов крови по отношению к микробной тест-кул ьтуре после их совместной инкубации.
__ , Таблица 4.14
Нормальные показатели фагоцитоза
|
Фагицитиз, % |
Фагоцитарное число (ФЧ) |
КАФхЮ/л |
АФПхЮ/л |
|
72,8±4,2 |
4,8±0,2 |
2,7±0,2 |
13,0то 6 |
|
94,2±1,6 |
9,4 ± 1,0 |
|
|
Изучение показателей фагоцитоза имеет значение а ко\ , ч с I0V анализе и диагностике иммунодефицитных состояний- часто рецидивирующих воспалительных процессов в мочевой системе склонности к послеоперационным осложнениям. Помогает в вторичных иммунодефицитных состояний, вызванных лекарственной терапией, а также в оценке эффективности различцЬгх фармакологических препаратов при инспекционных заболеваниях Фагоциты участвуют в элиминации иммунных комплексов, и активность фагоцитов тесно связана с активностью системы кэмплеменТа а именно СЗ, и концентрацией IgG, поэтому исследование фgt;агоцИтоза ИГрает роль в диагностике, оценке активности процесса и эффективности терапии при урологических болезнях. Определение количества иммуноглобулинов позволяет наряду с другими методами исследования иммунной системы определять степень ее изменения и эффективность проводимого лечения.
Литература
Велътищев Ю.Е. Местный иммунитет и его нарушения у детей. БМЭ. Изд. 3-е. - Т. 29. - 1988. - С 249-254.
Велътищев Ю.Е. Становление и развитие иммунной системы у детей. Иммунная недостаточность. Иммунодиатезы, — Российский вестник перинатологии и педиатрии. Приложение. — М. — 2004. — 75 с.
Габуния Д.Д. Ферментативные исследования при заболеваниях почек // Урол. и нефрол. — 1979. — N° 4. — С. 61-62.
Лавренова Т.П. Ферменты мочи и их значение для диагностики поражения почек (обзор литературы) // Лабор. дело. — 1990. — № 7. —
С. 4-10.
Мищенко Б.П., Длин В.В., Фокеева В.В. Значение ферментурии при заболеваниях почек у детей // Лабор. дело. — 1989. — № 5. —
С. 39-43.
Пугачева В.И. Значение ферментурии при заболеваниях почек у детей. Канд. диссертация. — М., 1972
Ситникова В.П., Логвинова И.И., Степанова Т.В. Некоторые показатели функциональной активности лейкоцитов в крови и моче у больных пиелонефритом. — В кн.: Хронический пиелонефрит у детей. - М., 1980. - С. 157-198.
Фоменко Г.В. Липицкая И.Я., Арабидзе Г.Г., Титов В.Н. Диагностическое значение ферментурии (обзор литературы) // Клин, лаб. диагностика — 1994. —№ 4. — С. 3-7.
Хлыстова З.С. Становление системы иммуногенеза плода человека. — М.:, Медицина, 1996. -- 385 с.
Branten AJ., Mulder Т.Р., Peters W.H., Ass man n K.J., WetzelsJ .F. Urinary excretion of glutathione S transferases alpha and pi in patients with proteinuria: reflection of the site of tubular injury // Nephron — 2000. — Jun. — Vol.85, № 2. -P.120-126.
Burchardt U., Scherberich J.E. Mechanisms of Enzyme Release and Causes of Altered Enzyme Excretion // Urinary Enzymes / Eds. K. Jung, H. Mattenheimer, U. Burchardt. — Berlin, Heidelberg: Springer-Verlag, 1992. - P. 21-41.
Decker D., Schondorf М., Bxdhngmaieг F. et at. // Surgery. — 1996. — 119. - P. 316-325.
Dienck PJ., Noble E. Purification and characterisation of rhe soluble glutathione S-trasnferase isoenzymes in rat Kidney derived NRK cells // Biochcm. Mol. Biol. Int. — 1997. — Apr. — Vol. 41, № 5. — P. 1013-1023.
Donadio C., Tramonti G., Lucchesi AGionlani R , Lucchetti Am Bianchi C. Gamma-glutamyltransferasc is a reliable marker for tubular effects of contrast media // Ren. Fail. — 1998. — Mar. — Vol. 20, № 2. — P 319-324.
Chatterjee P.K., Cuzzocrea S., В wren P.A., Zacharowski K., Stewart К A., Mota Filipe H., Thiemermann C. Tcmpol, a inembranc-permcabie radical scavenger, reduced oxidant stress-med.atcd renal dysfunction and injury in the rat // Kidney Int. — 2000. Aug. — Vol. 58, № 2. — P. 658-673.
Clemo F.A. Urinary enzyme evaluation of nephrotoxicity in the dog // Toxicol. Pathol. — 1998. — jan-Fcb. — Vol. 26, 1. — P. 29- 32.
Ertel W., Keel M., Steckhdze} U. et al. // Arch/ Surg — 1996.— 131. — P.51-56.
Ertel W, KeelM., Neidhardt R. etal. // Blood. — 1997. — 89. — P. 1612-1620.
Farsi E., Schinkel C„ Zimmer S // World J. Surg. — 1996. — 20. — P. 454-459.
Edelstein C.L., Shi V, Schrier R.W. Role of caspases in hypoxia-induced necrosis of rat renal proximal tubules // J. Am. Soc.. Nephrol. — 1999. — Sep. - Vol. 10, No 9. - P. 1940-1949.
Kharasch E.D.,Fiink. EJ.Jr., Zager R., Bowdle Y.A., Artru A., Nogami W M. Assessment of low-flow sevoflurane and isoflurane effects on renal function using sensitive markers of tubular toxicity (see comments) // Anesthesiology. — 1997. — Jun, — Vol. 86, № 6. — P. 1238-1253.
Khundmiri S.J., Asghar AT, Khan F„ Salim S., Yusufi A.N. Effect of reversible and irreversible ischemia on marker enzymes of BBM from renal cortical PT subpopulations // Am. ]. Physiol. — 1997.— Vol. 273, № 6, Pt 2. -P.849-856.
Kocaoglu 5., Karan. A., Berkan T, Basdemir G., Akpmar R. Urinary gamma-glutamyl transferase drug-induced nephrotoxicity // Arch. Immunol. Ther. Exp. Warsz. - 1997. - Vol. 45, № 1. - P. 73-77.
Kossmann S., Mugner-Krezel Z., Sohieraj R., Szwed Z. The asswssment of nephrotoxic effect od organophosphorous pesticides based on the determination on the activity of some selected enzymes in urine // Przegl. Eek. - 1997. - Vol. 54, № 10. - P. 707-711.
Ten Kate R.W., Pals G., Ericsson AAV., Donker A.J.M., Meuwissen S.G.M. The renal metabolism of pepsinogen A and C in man // Nephron. — 1989. — Vol. 31. - P. 103-106
Kabore A.F., Denis М., Bergeron M.G. Association of nitric oxide production by kidney proximal tubular cells in response to lipupolysaccharide and cytokines with cellular damage // Antimicrob. Agents. Chemother. — 1997. - Mar. - Vol. 41, № 3. - P. 557-562.
Lochhead K.M., Kharasch E.D., Zager R.A. Spectrum and subcellular determinants of fluorinated anesthetic-mediated proximal tubular injury // Am. J. Pathol. - 1997. - Jun. - Vol. 150, № 6. - P 2209-2221.
Massicot E, LamouriA., Martin C., Pham-Huy C., Heymans F., War- netJ.M., GodfomdJ.J,, ClaudeJ.R. Preventive effects of two PAF-antagonists, PMS 536 and PMS 549, on cyclosporin-induccd LLC-PK1 oxidative injury //J. Lipid. Mcdiat.. Cell. Signal. — 1997. — Jan. — Vol. 15, № 2. — P 302— 214,
Muthukumar A., Selvan R. Renal injury mediated calcium oxalate nephrolithoasis: role of lipid peroxidation // Ren. Fail. — 1997. — Vol. 19, № 3. - P. 401-408.
Nurnb' P,, Pullen M., Wa H.L., Prahhakar U., Hersh L., GeUai M. Down regulation of kidney neutral endopeptidase mRNA. Protein and activity during acute renal failure: possible mechanisms for ischemia-induced acute renal failure in rats? // Mol. Cell. Biochem. — 1999. — Vol. 197, № 1-2. — P. 53-59.
Obatomi D.K., Thanh N T, Brant Bach P.H. The tixic mechanism and metabolic effects of atractyloside in precision-cut pig kidney and liver slices // Arch/ Toxicol/ - 1998. - Jul-Aug. - Vol. 72, № 8. - P 524-530.
Poelstra K., Bakker W.W., Klok P.A., Ilardonk M.J., Meijer D.K. A physiologic function for alkaline phosphatase: endotoxin detoxification // Lab. Invest. - 1997 - Mar. - Vol. 76, № 3. - P. 319-327.
Portilla D. Carnitine palmitoyl-transferasc enzyme inhibition protects proximal tubules during hypoxia // Kidney Int. — 1997. — Aug. — Vol. 52, № 2. - P. 429-437.
Fashola TO., Obatomi D.K., Plummer D.T. The combined effect of cyclosporine a and gentamicin on enzymuria in the Sprague-Dawley rat // Ren. Fail. - 2000. - May. - Vol. 22, № 3. - P 283-295.
Fmtconne.au B., FavrehereS., PariatC., GenevrierA., CourtoisP., Pinou A., BouquetS. Nephrotoxicity of gentamicin and vancomycin given alone and in combination as determined by enzymuria and cortical antibiotic levels in rats // Ren. Fail. — 1997. — Jan. — Vol. 19, № 1. — P. 15-22.
Gupta A., Sharma S., Nain C.K., Sharma B.K., Ganguly N.K. Reactive oxygen species-mediated tissue injury in experimental ascending pyelonephritis // Kidney Int. — 1996. — Jan. — Vol. 49, № 1. — P 26-33.
Stain A,, Zikic R.V., Ognjanovic В., Saicic Z.S., Pavlovic S.'Z., Kostic M.M., Petroxnc V.M. Effect of cadmium and selenium in the antioxidant defense system in rat kidneys // Comp Biochem Physiol. C. Pharmacol. Toxicol. Endocrinol. — 1997. — Jun. — Vol. 117, Me 2. — P. 167-172
Ryhanen P., Surc.el H M., I'lonen J. // Acta V65. Anaesthesiol. Scand. — 1991'.- 35.-P.453-456.
Hauser C.J ,Joshi P., Zhou X. et al. // Shock. — 1996. — 6. — P. 3-6.
Hauser CJ.,Joshi P., Xhou X. er al. // frauma. — 1997. — 42. — P. 895- 903.
ШЬегamp;к M, Babst R.,Juretic A. et al. // Nutrition. — 1996. — 12 (11-12 Suppl.). — S71-S72.
Marsh D.G., BlumenthalM.N. (Eds.). Genetic and environmental factors in clinical allergy. Umv. Minnesota. Press. 1990.
Mizutani K, Terachi T., Okacla V., Yoshida 0. // Tnt. f. Urol — 1996. — 3. - P. 426-434.
WilliamsJ.M., Boyd B., NutillaA., Lingwood C.A., Barnett-Foster D.E., Miljord D.V., Taylor C.M. A comparison of the effects of verocytotoxin-1 on primary renal cell cultures // Axicoi. Lett. — 1999. — Mar 8. — Vol. 105, № 1 - P. 46-57.
Yu P.H., Zuo D.M. Aminoguanidinc inhibits scmicarbazide-sensitivc amine oxidase activity; implications for advanced glycation and diabetic complications // Diabetologia. — 1997. — Vol. 10. X 11. — P. 1243-1250.
Jan C.R., Chen W.C., Wu S.N., Tseng C.J. Nifedipine, verapamil and dilfia- zciii block shock-wavc-induced rises in cytosolic calcium in MDCK cells // Chin. J. Physiol, - 1998. - Dec 31. - Vol. 41, № 4. - P. 181-188.
