БИОЛОГИЧЕСКИЕ ПОСЛЕДСТВИЯ АКТИВАЦИИ СИСТЕМЫ КОМПЛЕМЕНТА
Из приведенных выше данных видно, что активация системы комплемента приводит к образованию большого количества биологически активных компонентов. Какие же они? На схеме 3 представлены этапы активации комплемента по классическому и альтернативному пути и приведены ее основные биологические последствия. Прежде всего следует упомянуть о биологически активных компонентах, которые образуются при расщеплении СЗ и С5. Они являются анафило- токсинами и приводят к высвобождению вазоактивных аминов, прежде всего гистамина, из тканевых базофилов (тучных клеток) и базо- фильных гранулоцитов крови. В свою очередь это сопровождается сокращением гладкой мускулатуры и усилением сосудистой проницаемости. Интересно, что СЗа и С5а обладают способностью вызывать сокращения гладкой мускулатуры и повышать проницаемость капилляров непосредственно, без предварительного разрушения базофилов обоих типов, т. е. в данной ситуации проявляется двоякий эффект действия СЗа и С5а — прямой и опосредованный через тканевые базофилы и базофильные гранулоциты. СЗа способен функционировать как иммунорегуляторная молекула, демонстрируя иммунодепрессивную активность как в антигенспецифичном, так и в митогениндуцирован- ном иммуноглобулиновом синтезе. С5а способен: 1) выступать в роли хемотаксического фактора, вызывая миграцию нейтрофилов по направлению к месту его высвобождения; 2) индуцировать прикрепление нейтрофилов к эндотелию сосудов и друг к другу и, таким образом, приводить к нейтропении; 3) активировать нейтрофилы, вызывая в них развитие дыхательного взрыва и дегрануляцию; 4) стимулировать продукцию нейтрофилами лейкотриенов. Несмотря на потерю своей
Этапы активации комплемента по классическому и альтернативному пути, биологические последствия
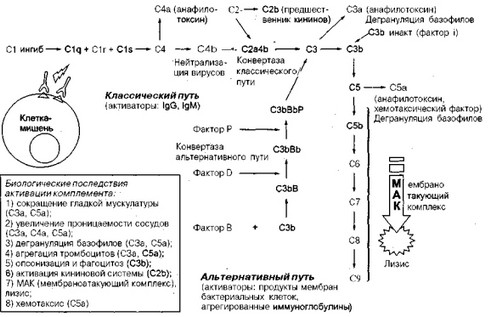
анафилактической активности под влиянием инактиватора анафило- токсинов, С5а все же продолжает сохранять хемотаксическую активность и способность активировать нейтрофилы.
Следующий биологически активный компонент — СЗЬ. Его образование и покрытие им клеток-мишеней является одним из наиболее важных этапов активации системы комплемента. Кроме того, СЗЬ играет важнейшую роль в активации альтернативного пути системы комплемента, а также в явлениях опсонизации. Наличие на поверхности фагоцитирующих клеток (нейтрофилов, эозинофилов, моноцитов, В- клеток, базофилов, макрофагов и эритроцитов) рецептора к СЗЬ усиливает их прикрепление к опсонизированным бактериям и активирует процесс поглощения. Такое более тесное прикрепление СЗЬ-связан- ных клеток, или иммунных комплексов, к фагоцитирующим клеткам, получило название феномена иммунного прикрепления.
Фактор СЗе, образующийся при расщеплении фактора СЗЬ, обладает способностью вызывать миграцию нейтрофилов из костного мозга, и в таком случае быть причиной лейкоцитоза.
Необходимо упомянуть о существовании так называемого СЗ-не- фритического фактора, который представляет собой антитела против активированного СЗЬВЬ, т. е. СЗ-эстеразы альтернативного пути активации комплемента. Эти антитела, связываясь с СЗ-эстеразой, приводят к развитию гипокомплементемии, особенно у больных с ангиокапиллярным гломерулонефритом.
Среди биологически активных компонентов комплемента следует отметить комплекс С5Ь67, обладающий хемотаксической активностью. Однако в организме он быстро разрушается, поэтому нельзя утверждать, что этот хемотаксический эффект играет важную роль.
Следующий компонент комплемента — С4, продукты его расщепления выполняют важную биологическую функцию. Так, его субкомпонент С4Ь остается на мембране клетки-мишени, на которой проис- ' ходит активация системы комплемента, и откладывается вблизи от активированного С1. Эти два компонента комплемента— С1 и С4 — обладают способностью связывать иммунный комплекс, в состав которого входит вирус, и приводить к нейтрализации вирусной активности. Предполагается, что таким образом молекула С4 (в частности С4Ь), предотвращает прикрепление вирусной частицы к клетке-мишени. С4а — еще один фрагмент активации С4, который переходит в растворимое состояние, также как СЗа и С5а, обладает анафилоток- сической активностью, приводя к высвобождению гистамина из базофилов обоих типов.
Следующий компонент комплемента — С2. Известно, что при его расщеплении C2b переходит в растворимое состояние и тесно связан с продукцией кининоподобных молекул, которые в свою очередь усиливают сосудистую проницаемость без сокращения гладкой мускулатуры. Этот эффект и лежит в основе развития врожденного ангионевротического отека — заболевания, которое контролируется присутствием в организме ингибитора С1.
Следующий фактор — это фактор В альтернативного пути активации комплемента. Он расщепляется на два фрагмента: Ва и ВЬ. Фрагмент Ва, который переходит в растворенное состояние, является хемо- таксическим фактором для нейтрофилов. Фрагмент ВЬ активирует макрофаги и способствует их прикреплению и распластыванию на поверхности клеток.
Конечные компоненты системы комплемента вызывают бактериолиз, цитолиз и виролиз, т. е. разрушение клеток, входящих в состав иммунных комплексов.
Важную роль играет система комплемента в патогенезе болезней иммунных комплексов, способствуя локализации и скорейшей элиминации антигена. Накопление же мелкодисперсных иммунных комплексов на базальных мембранах микроциркуляторного русла создает условия для длительной активации системы комплемента, приводит к отложению иммунных комплексов на мембранах и развитию воспаления.
В заключении раздела о системе комплемента следует более подробно охарактеризовать механизмы опсонизации, учитывая исключительно важное значение этого процесса в защитных реакциях организма.
Термин "опсонизация" означает процесс присоединения к микроорганизму различных молекул, выступающих впоследствии в роли лигандов (контррецепторов), к которым прикрепляются мононуклеар- ные клетки, имеющие на своей поверхности рецепторы к этим лигандам. Впервые процесс опсонизации был описан Райтом и Дугласом в 1903 г., однако, долгие годы его молекулярные основы оставались неизвестными. В настоящее время этот процесс представляется довольно сложным, в нем участвуют по меньшей мере две большие группы опсонинов: 1) молекулы некоторых иммуноглобулинов; 2) 3-ий компонент комплемента (СЗ).
На сегодняшний день описаны несколько рецепторов на фагоцитирующих клетках, которые способны связываться с Fc-фрагментами иммуноглобулинов. Так, например, Fc-raMMa-Rl-рецептор на моно- нуклеарных клетках связывается с Ig G,, G3 и G4. Другой рецептор — Fc-raMMa-R2 с низкой афинностью имеется на многих типах клеток, включая нейтрофилы; он распознает Ig G3 и G4 и связывается с ними. Имеется также рецептор Fc-raMMa-R3. Он также отличается низкой афинностью, выявляется на нейтрофилах и макрофагах, взаимодействует с Fc-фрагментом Ig G, и G3. Недавно был описан Fc-альфа- рецептор для IgA. По имеющимся данным этот рецептор может связываться с Fc-фрагментом Ig А, и А,.
Таким образом, первая большая группа опсонинов — это молекулы иммуноглобулинов, прежде всего Ig G и его изотипов, а также Ig A.
Другая большая группа молекул опсонинов представлена СЗ компонентом комплемента. В настоящее время описано по крайней мере три рецептора к СЗ, имеющиеся на мембране различных клеток (табл. 1), — CR,, CR2 и CR3. Доказано, что CR, связывается с активированным СЗ (СЗЬ); CR2 с C3d, a CR3 — с инактивированным СЗ (СЗЫ). Но во всех случаях такое связывание приводит к усилению фагоцитоза опсонизированных микроорганизмов. Сложные взаимодействия между всеми этими опсонинами и соответствующими им рецепторами на клетках представляют собой главный защитный механизм, который играет важнейшую роль в антимикробном иммунитете. Антитела и комплемент проявляют как индивидуальную защиту, так и действуют синергически, дополняя друг друга и в некоторых случаях компенсируя недостаточность друг друга.
Таблица 1. Рецепторы к СЗ на мембране различных клеток человека
|
Тип клеток |
Рецептор |
||
|
CR, |
CR, |
CR, |
|
|
Эритроциты |
+ |
- |
- |
|
Моноциты |
+ |
- |
+ |
|
Эозинофилы |
+ |
- |
- |
|
Нейтрофилы |
+ |
- |
+ |
|
Эпителиальные клетки почечных клубочков |
+ |
- |
- |
|
В-лимфоциты |
+ |
+ |
+ |
Кроме описанных выше механизмов опсонизации в последние годы открыт еще один, способствующий этому процессу. Он имеет отношение к маннозосвязывающему белку. Установлено, что маннозосвязывающий белок является кальцийзависимым лектином, который секрети- руется печенью некоторых видов животных, в том числе и человека. При полимеризации, по структуре,он начинает напоминать первый субкомпонент системы комплемента— Clq. Подобно Clq, маннозосвязывающий белок способен взаимодействовать с С1г и Cls комплемента и активировать классический путь активации комплемента независимо от присутствия антител. Происходит это следующим образом: на мембране довольно большого количества различных инфекционных агентов, в том числе грамотрицательных бактерий, микобактерий, грибов, имеются манноза и N-ацетилглюкозоаминогликаны, к которым этот маннозосвязывающий белок за счет своей углеводородной группы может присоединяться. Кроме того, он может присоединяться и к сальмонеллам, на поверхности которых также есть манноза. Присоединившись к указанным инфекционным агентам, маннозосвязывающий белок, который, как указано выше, структурно напоминает Сlq, присоединяет С1г и Cls и таким образом запускает классический путь активации комплемента, что в конце концов приводит к опсонизации тех бактерий, к которым он присоединился.
В настоящее время считается, что активация классического пути комплемента за счет маннозосвязывающего белка представляет собой яркий пример неспецифических факторов защиты иммунной системы, в отсутствие которых могут развиваться различного рода нарушения в защитных реакциях организма. Например в раннем послеродовом периоде, после того, как количество ¦ материнских иммуноглобулинов в организме ребенка начинает снижаться, он становится подверженным различного рода инфекциям. У него в организме имеется недостаточный репертуар (набор) антител и сравнительно низкий уровень IgG, являющегося, как известно, опсонином и тем иммуноглобулином, который способен активировать систему комплемента и усилить опсониче- ский эффект. Если в этот период у ребенка будет еще и снижен уровень маннозосвязывающего белка, что явится дополнительным фактором риска, то у большинства таких детей возможно развитие различного рода инфекционных осложнений (средний отит, воспаление верхних дыхательных путей и др.), особенно в возрасте от 6 месяцев до 2 лет. Вполне возможно, что после этого транзиторного периода повышенной чувствительности к инфекционным агентам в организме ребенка появится достаточный репертуар зрелых антител, которые будут способны осуществить опсонический эффект. Тогда эффективность этих опсонических механизмов настолько повысится, что частота инфекционных осложнений у данного конкретного ребенка будет снижаться.
Существует еще один первичный дефект в иммунной системе (конкретно в системе комплемента), который, даже несмотря на наличие в достаточном количестве опсонизирующих молекул иммуноглобулинов и манозосвязывающего белка, будет проявляться у детей большей частотой инфекционных осложнений. Такой дефект выявлен приблизительно у 8% людей белой расы в виде недостаточности двух из четырех возможных функционирующих генов С4 комплемента, а стало быть недостаточности классического пути активации комплемента. Установлено, что продукты генного локуса С4Ь функционально работают в четыре раза активнее, чем белки, ассоциирующиеся с генным локу-
сом С4а. Исходя из этого, гомозиготный дефицит по белковым продуктам С4Ь локусов будет реализовываться у детей в виде различных инфекционных осложнений, прежде всего бактериального менингита.
Существуют две гипотезы, объясняющие причины низкой сывороточной концентрации маннозосвязывающего белка. Согласно одной из них, нормальный белок синтезируется, однако в низких количествах, что связано с ненормальным контролем экспрессии гена маннозосвязывающего белка. В соответствии со второй гипотезой, ген маннозосвязывающего белка у больных кодирует дефективный белок.
В последнее время на основе изучения структуры гена маннозосвязывающего белка сделан вывод, что он является белком острой фазы и, по всей вероятности, продуцируется в ответ на такие цитокины, как ИЛ-1 и ИЛ-6.
Источник: Г. Н. Дранник, «КЛИНИЧЕСКАЯ ИММУНОЛОГИЯ и АЛЛЕРГОЛОГИЯ» 1999
А так же в разделе «БИОЛОГИЧЕСКИЕ ПОСЛЕДСТВИЯ АКТИВАЦИИ СИСТЕМЫ КОМПЛЕМЕНТА »
- Глава 1 ОСНОВНЫЕ ЗАДАЧИ И ПРОБЛЕМЫ КЛИНИЧЕСКОЙ ИММУНОЛОГИИ
- Глава 2 ВРОЖДЕННЫЙ НЕСПЕЦИФИЧЕСКИЙ (ЕСТЕСТВЕННЫЙ) ИММУНИТЕТ
- Глава 3 СИСТЕМА КОМПЛЕМЕНТА
- КЛАССИЧЕСКИЙ ПУТЬ АКТИВАЦИИ СИСТЕМЫ КОМПЛЕМЕНТА
- АЛЬТЕРНАТИВНЫЙ ПУТЬ АКТИВАЦИИ СИСТЕМЫ КОМПЛЕМЕНТА
- Глава 4 АНТИГЕНЫ
- Глава 5 ПРИОБРЕТЕННЫЙ СПЕЦИФИЧЕСКИЙ (АДАПТИВНЫЙ) ИММУНИТЕТ
- ОСНОВНЫЕ СВЕДЕНИЯ О СТРУКТУРЕ И ФУНКЦИИ СПЕЦИФИЧЕСКОГО (АДАПТИВНОГО) ИММУНИТЕТА
- СОЗРЕВАНИЕ Т- И В-ЛИМФОЦИТОВ
- ОТБОР (СЕЛЕКЦИЯ) ЛИМФОЦИТАРНОГО НАБОРА (РЕПЕРТУАРА); ОТБОР ЛИМФОЦИТОВ, НЕ РЕАГИРУЮЩИХ НА СОБСТВЕННЫЕ (SELF) АНТИГЕНЫ. СОЗДАНИЕ ТОЛЕРАНТНОСТИ
- Т-ЛИМФОЦИТЫ
- АПОПТОЗ
- Т-ЛИМФОЦИТЫ-СУПРЕССОРЫ
- В-ЛИМФОЦИТЫ
- Т-НЕЗАВИСИМАЯ ПРОДУКЦИЯ АНТИТЕЛ
- Т-ЗАВИСИМАЯ ПРОДУКЦИЯ АНТИТЕЛ
- ДИФФЕРЕНЦИРОВКА Т-ЛИМФОЦИТОВ
- ДИФФЕРЕНЦИРОВКА В-ЛИМФОЦИТОВ
- Глава 6 ИММУНОГЛОБУЛИНЫ
- ИММУНОГЛОБУЛИН
- ИММУНОГЛОБУЛИН G
- ИММУНОГЛОБУЛИН А
- ИММУНОГЛОБУЛИН Е
- ИММУНОГЛОБУЛИН D
- Глава 7 ИММУННЫЕ КОМПЛЕКСЫ
- Глава 8 ЦИТОКИНЫ - РЕГУЛЯТОРЫ И ЭФФЕКТОРЫ ИММУННОЙ СИСТЕМЫ
- ИНТЕРЛЕЙКИНЫ
- РОСТОВЫЕ ФАКТОРЫ
- ОПУХОЛЬНЕКРОТИЗИРУЮЩИЕ ФАКТОРЫ
- ХЕМОКИНЫ
- КРАТКАЯ ХАРАКТЕРИСТИКА НАИБОЛЕЕ ВАЖНЫХ ХЕМОКИНОВ
- Глава 9 ИНТЕРФЕРОНЫ
- Глава 10 МОЛЕКУЛЫ КЛЕТОЧНОЙ АДГЕЗИИ (АДГЕЗИВНЫЕ МОЛЕКУЛЫ)
- Глава 11 ИММУННАЯ СИСТЕМА СЛИЗИСТЫХ ОБОЛОЧЕК
- ЛИМФОИДНАЯ ТКАНЬ, АССОЦИИРОВАННАЯ С ЖЕЛУДКОМ И КИШЕЧНИКОМ
- МИГРАЦИЯ ЛИМФОЦИТОВ ПРИ РАЗВИТИИ ИММУННОГО ОТВЕТА В ОБЛАСТИ СЛИЗИСТЫХ ОБОЛОЧЕК
- ТОЛЕРАНТНОСТЬ, ИНДУЦИРУЕМАЯ ВВЕДЕНИЕМ АНТИГЕНА per os
- СЕКРЕЦИЯ IgA
- ТРАНСПОРТ СЕКРЕТОРНОГО IgA
- ФУНКЦИОНАЛЬНОЕ ЗНАЧЕНИЕ СЕКРЕТОРНОГО IgA
- ГАММА-, ДЕЛЬТА-Т-ЛИМФОЦИТЫ
- Глава 12 ГЛАВНЫЙ КОМПЛЕКС ГИСТОСОВМЕСТИМОСТИ: СТРУКТУРА И ФУНКЦИИ
- ВЗАИМОСВЯЗЬ АНТИГЕНОВ СИСТЕМЫ HLA С ПРЕДРАСПОЛОЖЕННОСТЬЮ К ЗАБОЛЕВАНИЯМ
- ОПРЕДЕЛЕНИЕ HLA-ФЕНОТИПА