Глава 6 ИММУНОГЛОБУЛИНЫ
Иммуноглобулины (Ig), выполняющие в организме функцию антител, синтезируются плазматическими клетками, которые являются конечным этапом дифференцировки В-лимфоцита, наступившей в результате антигенного стимула и хелперного сигнала.
Иммуноглобулины представляют собой белки плазмы, которые при электрофорезе мигрируют как гамма-глобулины и образуют диффузную полосу в гамма-области электрофореграммы, что подтверждает их гетерогенность. Иммуноглобулины относятся к полифункциональным белкам и реализуют следующие основные функции: 1) специфически распознают самые разнообразные антигены и гаптены (неполные антигены); 2) взаимодействуют с другими иммунокомпетентными клетками, имеющими к ним соответствующие рецепторы; 3)активируют систему комплемента. Структуры, ответственные за различные функции иммуноглобулинов, находятся на разных участках молекул этих белков.
В настоящее время известно пять основных классов иммуноглобулинов человека: IgA, IgM, IgG, IgE и IgD.
На рис. 5 представлена структура молекулы иммуноглобулина G. Как видно из рисунка, мономерные единицы каждого из пяти классов иммуноглобулинов состоят из двух идентичных тяжелых (Н) (от англ. heavy — тяжелый) и двух идентичных легких (L) (от англ. light — легкий) цепей, которые удерживаются вместе дисульфидными (ковалентными) и нековалентными связями. Легкие цепи (L-цепи) представле-
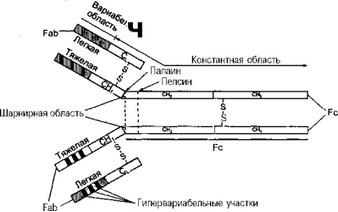
Рис. 5. Структура молекулы иммуноглобулина G и функциональные свойства ее различных частей (по И. Ройту, 1991):
Fab — специфический участок, антигенсвязывающий фрагмент; Fc — неспецифический участок, функционально активная часть молекулы Ig: фиксация на мембранах клеток, связывание комплемента, проникновение через мембраны.
ны двумя типами: лямбда (X) и каппа (к), а тяжелые (Н-цепи) — пятью: альфа (а), мю (р,), гамма (у), дельта (б) и эпсилон (е). Тяжелые цепи определяют класс иммуноглобулинов — А, М, G, D, и Е. ¦ Легкие цепи имеют молекулярную массу приблизительно 2,3 • 104 D и состоят примерно из 200 аминокислотных остатков. Отдельно взятая молекула иммуноглобулина любого класса может содержать идентичные либо каппа-, либо лямбда- цепи, но никогда — обе.
Тяжелые цепи имеют молекулярную массу приблизительно вдвое большую (0,005—7 МО4 D) и состоят примерно из 400 аминокислотных остатков.
Как видно из рис. 5, молекулы иммуноглобулинов состоят из двух видов фрагментов: Fab {fragment antigen binding, англ.) — антигенсвя- зывающего и Fc {fragment crystalline, англ.) — кристаллизующегося. Если на молекулу IgG воздействовать папаином, она распадется на три фрагмента: два Fab-фрагмента и один Fc-фрагмент. Область, в которой соединяются Fab- и Fc-фрагменты молекул иммуноглобулинов, называется шарнирной. За счет шарнирной области субъединицы молекул иммуноглобулинов (цепи) обладают способностью к вращению по отношению друг к другу, что обусловливает гибкость молекул иммуноглобулинов.
По первичной структуре тяжелых цепей Ig делятся на подклассы. У человека обнаружено четыре подкласса IgG и два подкласса IgM и IgA. У каждого человека одновременно могут присутствовать все классы и подклассы Ig, что само по себе уже обусловливает гетерогенность всей популяции Ig, не касающейся, однако, их специфичности к антигенам.
В то же время между L- и Н-цепями есть определенное сходство, очень важное для всего комплекса иммунологических реакций: обе они имеют вариабельную и константную область (см. рис. 5).
Вариабельная область Ig состоит из легких и тяжелых цепей, различна для разных Ig, и именно она отвечает за специфичность Ig в отношении определенного антигена. Принадлежность Ig к тому или иному классу не влияет на их специфичность к антигенам, но степень специфичности различна у разных классов Ig: наиболее специфичны IgG, менее IgA и еще меньше IgM.
После соединения с антигеном и образования иммунного комплекса (ИК) молекула Ig сохраняет достаточно выраженную активность за счет второго, неспецифического, участка молекулы — Fc. Fc-константная область молекулы Ig состоит только из тяжелых цепей, не имеет отношения к специфичности, но обусловливает ряд важных биологических свойств Ig, получивших название эффекторных.
Сложная и многогранная роль Ig, их функциональная неоднозначность еще раз заставляют обратить внимание на особенности их синтеза. Как указывалось выше, синтез иммуноглобулинов, осуществляемый В-лимфоцитами, напрямую с действием какого-либо антигена не связан. Так, в организме еще до появления того или иного антигена существуют клоны В-лимфоцитов, которые способны продуцировать разнообразные по специфичности Ig. Синтез Ig происходит постоянно и в определенной степени не зависит от действия конкретного антигена.
При расщеплении молекул иммуноглобулина пепсином образуются два фрагмента: F(ab)2 и Fc. Двухвалентный Р(аЬ)2-фрагмент вследствие своей двухвалентности действует как полное антитело и обладает способностью преципитировать или агглютинировать специфические антигены.
Специфичность антител обусловлена первичной последовательностью расположения аминокислот в вариабельной области Fab-фрагмента, которая, собственно, и обеспечивает связь с антигеном и поэтому считается активным центром молекулы Ig. Зоны повышенной изменчивости аминокислот в вариабельных областях тяжелых и легких цепей названы гипервариабельными участками ("горячие точки") (см. рис. 5). Считается, что этим обеспечивается разнообразие спектра специфичности антител.
В Fc-фрагменте молекул Ig расположены центры, ответственные за их разнообразные биологические функции: 1)фиксацию на лимфоцитах и фагоцитах; 2) связывание первого компонента системы комплемента; 3)транспорт через плаценту и другие биологические мембраны.
Способность Ig связываться с антигенами характеризуется следующими их свойствами: авидностью и аффинностью (или аффинитетом).
Прочность связи антитела с соответствующим антигеном называется авидностью. Авидность (жадность) антител в процессе иммунного ответа меняется и зависит от их валентности. В свою очередь, валентность антител зависит от числа их активных центров. Так, например, молекула IgG двухвалентна, a IgM — десятивалентна. Антитела с двумя валентностями более полноценно связывают антиген, в отличие от моновалентных антител (неполных или блокирующих), которые не способны самостоятельно вызвать агглютинацию или преципитацию антигенов.
Точность совпадения (сродства) пространственной конфигурации активного центра иммуноглобулина с конфигурацией антигенной детерминанты обозначается термином "аффинитет", или "аффинность антитела”. Ее определяют как сумму межмолёкулярных сил притяжения и отталкивания, возникающих при взаимодействии антигенсвя- зывающего центра антител и антигенной детерминанты. Аффинность антител в процессе иммунизации нарастает и обеспечивает более полную связь с антигеном.
Таким образом, прочность связи антител зависит как от аффинности, так и от валентности, приходящейся в среднем на одну молекулу иммуноглобулинов. При равной аффинности авидность IgM будет больше, чем IgG, поскольку молекула IgM десятивалентна, a IgG — двухвалентна.
Разнообразие иммуноглобулинов вытекает из особенности их структуры. Иммуноглобулины имеют изотипические, аллотипические и идио- типические характеристики.
Изотипы отражают классоспецифические особенности иммуноглобулина данного биологического вида. Изотипические различия иммуноглобулинов обусловлены структурой тяжелых цепей, что как уже говорилось, позволяет выделить пять классов иммуноглобулинов разных изотипов: М, G, А, Е и D.
Иммуноглобулины представляют собой белки плазмы, которые при электрофорезе мигрируют как гамма-глобулины и образуют диффузную полосу в гамма-области электрофореграммы, что подтверждает их гетерогенность. Иммуноглобулины относятся к полифункциональным белкам и реализуют следующие основные функции: 1) специфически распознают самые разнообразные антигены и гаптены (неполные антигены); 2) взаимодействуют с другими иммунокомпетентными клетками, имеющими к ним соответствующие рецепторы; 3)активируют систему комплемента. Структуры, ответственные за различные функции иммуноглобулинов, находятся на разных участках молекул этих белков.
В настоящее время известно пять основных классов иммуноглобулинов человека: IgA, IgM, IgG, IgE и IgD.
На рис. 5 представлена структура молекулы иммуноглобулина G. Как видно из рисунка, мономерные единицы каждого из пяти классов иммуноглобулинов состоят из двух идентичных тяжелых (Н) (от англ. heavy — тяжелый) и двух идентичных легких (L) (от англ. light — легкий) цепей, которые удерживаются вместе дисульфидными (ковалентными) и нековалентными связями. Легкие цепи (L-цепи) представле-

Рис. 5. Структура молекулы иммуноглобулина G и функциональные свойства ее различных частей (по И. Ройту, 1991):
Fab — специфический участок, антигенсвязывающий фрагмент; Fc — неспецифический участок, функционально активная часть молекулы Ig: фиксация на мембранах клеток, связывание комплемента, проникновение через мембраны.
ны двумя типами: лямбда (X) и каппа (к), а тяжелые (Н-цепи) — пятью: альфа (а), мю (р,), гамма (у), дельта (б) и эпсилон (е). Тяжелые цепи определяют класс иммуноглобулинов — А, М, G, D, и Е. ¦ Легкие цепи имеют молекулярную массу приблизительно 2,3 • 104 D и состоят примерно из 200 аминокислотных остатков. Отдельно взятая молекула иммуноглобулина любого класса может содержать идентичные либо каппа-, либо лямбда- цепи, но никогда — обе.
Тяжелые цепи имеют молекулярную массу приблизительно вдвое большую (0,005—7 МО4 D) и состоят примерно из 400 аминокислотных остатков.
Как видно из рис. 5, молекулы иммуноглобулинов состоят из двух видов фрагментов: Fab {fragment antigen binding, англ.) — антигенсвя- зывающего и Fc {fragment crystalline, англ.) — кристаллизующегося. Если на молекулу IgG воздействовать папаином, она распадется на три фрагмента: два Fab-фрагмента и один Fc-фрагмент. Область, в которой соединяются Fab- и Fc-фрагменты молекул иммуноглобулинов, называется шарнирной. За счет шарнирной области субъединицы молекул иммуноглобулинов (цепи) обладают способностью к вращению по отношению друг к другу, что обусловливает гибкость молекул иммуноглобулинов.
По первичной структуре тяжелых цепей Ig делятся на подклассы. У человека обнаружено четыре подкласса IgG и два подкласса IgM и IgA. У каждого человека одновременно могут присутствовать все классы и подклассы Ig, что само по себе уже обусловливает гетерогенность всей популяции Ig, не касающейся, однако, их специфичности к антигенам.
В то же время между L- и Н-цепями есть определенное сходство, очень важное для всего комплекса иммунологических реакций: обе они имеют вариабельную и константную область (см. рис. 5).
Вариабельная область Ig состоит из легких и тяжелых цепей, различна для разных Ig, и именно она отвечает за специфичность Ig в отношении определенного антигена. Принадлежность Ig к тому или иному классу не влияет на их специфичность к антигенам, но степень специфичности различна у разных классов Ig: наиболее специфичны IgG, менее IgA и еще меньше IgM.
После соединения с антигеном и образования иммунного комплекса (ИК) молекула Ig сохраняет достаточно выраженную активность за счет второго, неспецифического, участка молекулы — Fc. Fc-константная область молекулы Ig состоит только из тяжелых цепей, не имеет отношения к специфичности, но обусловливает ряд важных биологических свойств Ig, получивших название эффекторных.
Сложная и многогранная роль Ig, их функциональная неоднозначность еще раз заставляют обратить внимание на особенности их синтеза. Как указывалось выше, синтез иммуноглобулинов, осуществляемый В-лимфоцитами, напрямую с действием какого-либо антигена не связан. Так, в организме еще до появления того или иного антигена существуют клоны В-лимфоцитов, которые способны продуцировать разнообразные по специфичности Ig. Синтез Ig происходит постоянно и в определенной степени не зависит от действия конкретного антигена.
При расщеплении молекул иммуноглобулина пепсином образуются два фрагмента: F(ab)2 и Fc. Двухвалентный Р(аЬ)2-фрагмент вследствие своей двухвалентности действует как полное антитело и обладает способностью преципитировать или агглютинировать специфические антигены.
Специфичность антител обусловлена первичной последовательностью расположения аминокислот в вариабельной области Fab-фрагмента, которая, собственно, и обеспечивает связь с антигеном и поэтому считается активным центром молекулы Ig. Зоны повышенной изменчивости аминокислот в вариабельных областях тяжелых и легких цепей названы гипервариабельными участками ("горячие точки") (см. рис. 5). Считается, что этим обеспечивается разнообразие спектра специфичности антител.
В Fc-фрагменте молекул Ig расположены центры, ответственные за их разнообразные биологические функции: 1)фиксацию на лимфоцитах и фагоцитах; 2) связывание первого компонента системы комплемента; 3)транспорт через плаценту и другие биологические мембраны.
Способность Ig связываться с антигенами характеризуется следующими их свойствами: авидностью и аффинностью (или аффинитетом).
Прочность связи антитела с соответствующим антигеном называется авидностью. Авидность (жадность) антител в процессе иммунного ответа меняется и зависит от их валентности. В свою очередь, валентность антител зависит от числа их активных центров. Так, например, молекула IgG двухвалентна, a IgM — десятивалентна. Антитела с двумя валентностями более полноценно связывают антиген, в отличие от моновалентных антител (неполных или блокирующих), которые не способны самостоятельно вызвать агглютинацию или преципитацию антигенов.
Точность совпадения (сродства) пространственной конфигурации активного центра иммуноглобулина с конфигурацией антигенной детерминанты обозначается термином "аффинитет", или "аффинность антитела”. Ее определяют как сумму межмолёкулярных сил притяжения и отталкивания, возникающих при взаимодействии антигенсвя- зывающего центра антител и антигенной детерминанты. Аффинность антител в процессе иммунизации нарастает и обеспечивает более полную связь с антигеном.
Таким образом, прочность связи антител зависит как от аффинности, так и от валентности, приходящейся в среднем на одну молекулу иммуноглобулинов. При равной аффинности авидность IgM будет больше, чем IgG, поскольку молекула IgM десятивалентна, a IgG — двухвалентна.
Разнообразие иммуноглобулинов вытекает из особенности их структуры. Иммуноглобулины имеют изотипические, аллотипические и идио- типические характеристики.
Изотипы отражают классоспецифические особенности иммуноглобулина данного биологического вида. Изотипические различия иммуноглобулинов обусловлены структурой тяжелых цепей, что как уже говорилось, позволяет выделить пять классов иммуноглобулинов разных изотипов: М, G, А, Е и D.
Источник: Г. Н. Дранник, «КЛИНИЧЕСКАЯ ИММУНОЛОГИЯ и АЛЛЕРГОЛОГИЯ» 1999
А так же в разделе « Глава 6 ИММУНОГЛОБУЛИНЫ »
- Глава 1 ОСНОВНЫЕ ЗАДАЧИ И ПРОБЛЕМЫ КЛИНИЧЕСКОЙ ИММУНОЛОГИИ
- Глава 2 ВРОЖДЕННЫЙ НЕСПЕЦИФИЧЕСКИЙ (ЕСТЕСТВЕННЫЙ) ИММУНИТЕТ
- Глава 3 СИСТЕМА КОМПЛЕМЕНТА
- КЛАССИЧЕСКИЙ ПУТЬ АКТИВАЦИИ СИСТЕМЫ КОМПЛЕМЕНТА
- АЛЬТЕРНАТИВНЫЙ ПУТЬ АКТИВАЦИИ СИСТЕМЫ КОМПЛЕМЕНТА
- БИОЛОГИЧЕСКИЕ ПОСЛЕДСТВИЯ АКТИВАЦИИ СИСТЕМЫ КОМПЛЕМЕНТА
- Глава 4 АНТИГЕНЫ
- Глава 5 ПРИОБРЕТЕННЫЙ СПЕЦИФИЧЕСКИЙ (АДАПТИВНЫЙ) ИММУНИТЕТ
- ОСНОВНЫЕ СВЕДЕНИЯ О СТРУКТУРЕ И ФУНКЦИИ СПЕЦИФИЧЕСКОГО (АДАПТИВНОГО) ИММУНИТЕТА
- СОЗРЕВАНИЕ Т- И В-ЛИМФОЦИТОВ
- ОТБОР (СЕЛЕКЦИЯ) ЛИМФОЦИТАРНОГО НАБОРА (РЕПЕРТУАРА); ОТБОР ЛИМФОЦИТОВ, НЕ РЕАГИРУЮЩИХ НА СОБСТВЕННЫЕ (SELF) АНТИГЕНЫ. СОЗДАНИЕ ТОЛЕРАНТНОСТИ
- Т-ЛИМФОЦИТЫ
- АПОПТОЗ
- Т-ЛИМФОЦИТЫ-СУПРЕССОРЫ
- В-ЛИМФОЦИТЫ
- Т-НЕЗАВИСИМАЯ ПРОДУКЦИЯ АНТИТЕЛ
- Т-ЗАВИСИМАЯ ПРОДУКЦИЯ АНТИТЕЛ
- ДИФФЕРЕНЦИРОВКА Т-ЛИМФОЦИТОВ
- ДИФФЕРЕНЦИРОВКА В-ЛИМФОЦИТОВ
- ИММУНОГЛОБУЛИН
- ИММУНОГЛОБУЛИН G
- ИММУНОГЛОБУЛИН А
- ИММУНОГЛОБУЛИН Е
- ИММУНОГЛОБУЛИН D
- Глава 7 ИММУННЫЕ КОМПЛЕКСЫ
- Глава 8 ЦИТОКИНЫ - РЕГУЛЯТОРЫ И ЭФФЕКТОРЫ ИММУННОЙ СИСТЕМЫ
- ИНТЕРЛЕЙКИНЫ
- РОСТОВЫЕ ФАКТОРЫ
- ОПУХОЛЬНЕКРОТИЗИРУЮЩИЕ ФАКТОРЫ
- ХЕМОКИНЫ
- КРАТКАЯ ХАРАКТЕРИСТИКА НАИБОЛЕЕ ВАЖНЫХ ХЕМОКИНОВ
- Глава 9 ИНТЕРФЕРОНЫ
- Глава 10 МОЛЕКУЛЫ КЛЕТОЧНОЙ АДГЕЗИИ (АДГЕЗИВНЫЕ МОЛЕКУЛЫ)
- Глава 11 ИММУННАЯ СИСТЕМА СЛИЗИСТЫХ ОБОЛОЧЕК
- ЛИМФОИДНАЯ ТКАНЬ, АССОЦИИРОВАННАЯ С ЖЕЛУДКОМ И КИШЕЧНИКОМ
- МИГРАЦИЯ ЛИМФОЦИТОВ ПРИ РАЗВИТИИ ИММУННОГО ОТВЕТА В ОБЛАСТИ СЛИЗИСТЫХ ОБОЛОЧЕК
- ТОЛЕРАНТНОСТЬ, ИНДУЦИРУЕМАЯ ВВЕДЕНИЕМ АНТИГЕНА per os
- СЕКРЕЦИЯ IgA
- ТРАНСПОРТ СЕКРЕТОРНОГО IgA
- ФУНКЦИОНАЛЬНОЕ ЗНАЧЕНИЕ СЕКРЕТОРНОГО IgA
- ГАММА-, ДЕЛЬТА-Т-ЛИМФОЦИТЫ
- Глава 12 ГЛАВНЫЙ КОМПЛЕКС ГИСТОСОВМЕСТИМОСТИ: СТРУКТУРА И ФУНКЦИИ
- ВЗАИМОСВЯЗЬ АНТИГЕНОВ СИСТЕМЫ HLA С ПРЕДРАСПОЛОЖЕННОСТЬЮ К ЗАБОЛЕВАНИЯМ
- ОПРЕДЕЛЕНИЕ HLA-ФЕНОТИПА