Глава 12 ГЛАВНЫЙ КОМПЛЕКС ГИСТОСОВМЕСТИМОСТИ: СТРУКТУРА И ФУНКЦИИ
Учение о главном комплексе гистосовместимости (ГКГ) является стержневым в фундаментальной и прикладной иммунологии. Выше уже неоднократно упоминалось о молекулах ГКГ, в частности, при описании особенностей презентации чужеродного материала для распознавания Т-лимфоцитам при развитии иммунного ответа. Роль молекул ГКГ чрезвычайно важна. Набор этих молекул для каждого человека абсолютно специфичен, они делают нас индивидуальными во многих отношениях, вплоть до поведенческих реакций.
Первые работы, свидетельствующие о том, что у млекопитающих существуют гены, детерминирующие выраженность трансплантационной реакции отторжения, появились более 40 лет тому назад, с началом активной пересадки органов. Впоследствии эта группа генов получила название "главный комплекс гистосовместимости" (Major Histocompatibility Complex — МНС). Самим названием была подчеркнута их определяющая роль в развитии трансплантационного иммунитета. У человека этот комплекс генов получил название системы HLA (Human Leukocyte Antigen). Таким образом, аббревиатуры ГКГ, МНС и HLA для человека являются синонимами обозначения главного комплекса гистосовместимости.
Действительно, до недавнего времени изучение проблем, связанных с антигенами системы HLA (трансплантационными, или тканевыми, антигенами), диктовалось в основном их очевидным практическим значением в пересадке органов, прежде всего — в пересадке почки. Первичная биологическая функция трансплантационных антигенов была неизвестна. Однако достижения последних лет в исследовании генетической структуры и биологической роли ГКГ позволили определить, по крайней мере, две основные его функции, которые имеют общебиологическое значение. К ним относятся: 1) роль трансплантационных антигенов в межклеточных взаимодействиях при реализации иммунного ответа; 2) функция HLA-региона, связанная с иммунологической реактивностью организма в целом. В первом случае речь идет о том, что молекулы ГКГ являются теми структурами, с помощью которых осуществляется презентация чужеродного антигенного материала для последующего распознавания Т-клеточным антигенраспознающим рецептором. Во втором случае речь идет о существовании в HLA-регионе специального гена иммунного ответа (1г — immune response), наличие которого определяет способность данного организма развивать иммунный ответ на конкретный антиген; эта же функция HLA-региона связана с предрасположенностью к ряду заболеваний.
Началом изучения антигенов гистосовместимости человека можно считать работу G. Dausset (1957), в которой был описан первый антиген гистосовместимости человека, названный Мае (сейчас это HLA-A2).
Некоторые исследователи называют антигены ГКГ "иммунным паспортом, группой белой крови", с помощью которых иммунная система способна различать ''свое'' —self от "чужого" —non-self. Индивидуальный набор и свойства молекул ГКГ во многом определяют силу иммунного ответа конкретного человека на конкретный антиген.
Отметив, что клетки гомозиготных близнецов реагируют с набором тест-сывороток одинаково, а гетерозиготных — по разному, G. Dausset высказал подтвердившееся впоследствии предположение о генетической детерминированности антигенов гистосовместимости: т. е. о том, что каждый из генов, входящих в HLA-комплекс, имеет свое представительство в виде антигена гистосовместимости, экспрессируемого на мембране клетки.
В настоящее время ГКГ (HLA) человека является одним из наиболее хорошо изученных и вместе с тем наиболее сложных генетических структур в геноме человека.
Обозначение HLA-специфичностей включает три компонента: 1) аббревиатуру всей системы; 2) локус, содержащий данную специфичность; 3) номер антигена (например HLA-B12). В том случае, когда генетическая позиция антигена еще недостаточно ясна или недостаточно уточнена, перед его порядковым номером ставят символ "w" (workshop).
На рис МО представлена несколько упрощенная схема системы HLA человека. Установлено, что гены HLA-системы расположены на коротком плече хромосомы 6. Все они разделены на три группы: гены гистосовместимости класса I, класса II и класса III; также сгруппированы и молекулы (антигены), которые контролируются этими генами.
В настоящее время гены системы HLA класса I включают локусы
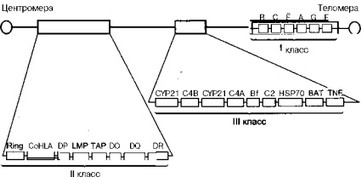
Рис. 10. Схематическое изображение генного комплекса HLA на С6 хромосоме.
В, С, Е, A, G, F (по направлению к теломере). Часть из них — локусы В, С и А — относят к так называемым "классическим", кодирующим традиционные трансплантационные антигены. Что касается недавно открытых локусов Е, G, F, то биологическая функция их самих и их продуктов в настоящее время уточняется. Возможно, некоторые из них принимают участие в презентации антигена для распознавания интраэпителиальными Т-лимфоцитами-киллерами, несущими гамма-, дельта-цепи в антиген-распознающем рецепторе; другие определяют взаимоотношения в системе "мать-плод" (например антигены локуса G).
В норме "классические" антигены системы HLA класса I присутствуют на всех ядерных клетках, отличаясь лишь степенью интенсивности их экспрессии. Доказано наиболее низкое содержание их на миокарди- оцитах, скелетных мышцах, эндотелии роговицы; не установлено их присутствие на нитях трофобласта. Степень выраженности антигенов системы HLA как I, так и II класса — непостоянна и зависит от воздействия, прежде всего, так называемых эндогенных факторов модификации иммунного ответа, к которым относят интерлейкины, интерферо- ны, опухольнекротизирующий фактор, простагландины и др.
Одной из важнейших характеристик генов системы HLA является их разнообразие и полиморфизм, т. е. существование в пределах каждого локуса большого количества различных специфичностей HLA- генов (или множественных аллельных вариантов), отличающихся между собой по аминокислотным последовательностям, входящим в вариабельный участок ДНК, что определяет их полиморфизм. В настоящее время описано более 40 специфичностей в локусе А, более 60 специ-
фичностей в локусе В и около 20 — в локусе С (R. Lechler, 1994). Кроме того, показано, что некоторые специфичности (гены) имеют по несколько аллельных вариантов. Так, например, HLA-A2 специфичность имеет 12 аллелей, В35 — 6, а В27 — 7 аллелей. Наличие аллельного полиморфизма HLA молекул лежит в основе строгой индивидуализации набора трансплантационных антигенов у каждого конкретного человека, делая его неповторимым в этом плане.
Очень важным этапом в развитии учения о системе HLA и в понимании функции молекул HLA класса I стали работы, в которых было описано их тонкое строение.
На рис. 11 представлено схематическое изображение структуры молекулы (антигена) HLA класса I (I. Roitt, 1994). По современным представлениям, молекула HLA класса I является гетеродимером, состоящим из тяжелой альфа-полипептидной цепи и нековалентно связанной с ней легкой бета-полипептидной цепи.
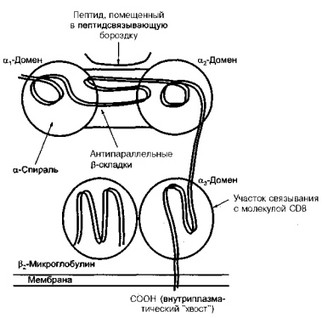
Рис. 11. Схематическое изображение молекулы (антигена) HLA класса I (объяснение в тексте).
Альфа-цепи молекул класса 'I содержат приблизительно 340 аминокислотных остатков, которые формируют три внеклеточных домена (альфа 1, альфа2, альфаЗ), одну трансмембранную часть и внутрицитоплазматический "хвост". Они кодируются генами локусов А, В и С комплекса HLA, расположенного на 6-ой хромосоме, и как упоминалось, являются высокополиморфными. Бета-цепь молекулы класса I представляет собой бета-2-микроглобулин, который состоит из внеклеточного домена, включающего 100 аминокислотных остатков, он кодируется геном, расположенным на 15-ой хромосоме и является неполиморфным.
Серия работ, выполненная P. Bjorkman и др. (1987), впервые позволила понять природу пространственного взаимодействия HLA-mo- лекул и антигенных пептидов.
Оказалось, что взаимное расположение альфа 1- и альфа2-доменов в молекуле HLA класса I создают некий "желоб", "карман", в формировании которого принимают участие две альфа-спирали — "стены" и антипараллельные бета-складки — "дно"; эта структура получила название "пептидсвязывающая бороздка". Определенная аминокислотная последовательность этой бороздки служит своеобразным "якорем" удержания в нем пептида. Именно таким образом HLA-молекула класса I презентирует (представляет) специфический пептид для его дальнейшего распознавания альфа- и бета-цепями Т-клеточного антиген- распознающего рецептора.
Как упоминалось выше, пептид представляет собой процессированный антиген (чужеродный или собственный), состоящий из небольшого числа аминокислотных остатков. Так называемый линейный пептид, который находится в пептидсвязывающей бороздке молекулы HLA класса I, состоит всего из 4—9 аминокислотных остатков. Несколько больше (до 20) их содержат пептиды, которые находятся в "бороздках" молекул класса И. По сути дела пептид представляет собой антигенную детерминанту — эпитоп. Сложный антиген может содержать сотни пептидов.
Как же образуется пептид, как он попадает в пептидсвязывающую бороздку молекулы гистосовместимости класса I и как она появляется на поверхности клетки? Это стало понятным после обнаружения двух новых локусов — LMP и ТАР, отнесенных к классу II (см. рис. 10).
Гены локуса LMP кодируют большой пептидазный комплекс, названный протеасомой. Протеасома является внутриклеточным комплексом, вовлеченным в протеолиз цитозольных белков, что обеспечивает продукцию эндогенных пептидов (рис. 12).
В свою очередь, эти пептиды с помощью трансмембранных белков, которые контролируются генами локуса ТАР, доставляются в
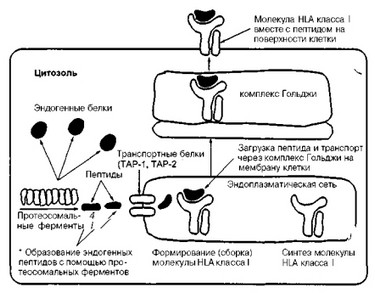
Рис. 12. Схема механизма презентации антигена с помощью молекулы HLA класса I (объяснение в тексте).
В цитозоле, кроме эндогенных пептидов, образуются также некоторые экзогенные пептиды, в частности вирусные.
эндоплазматическую сеть и там "загружаются" в пептидсвязывающую бороздку антигенов системы HLA класса I, затем транспортируются на поверхность клетки и далее представляются для распознавания предшественникам Т-лимфоцитов-киллеров/супрессоров (CD8+ клетки).
Важно помнить, что к антигенам, подвергающимся воздействию про- теасом, относятся не только собственные цитозольные белки, но и продукты многих вирусных, бактериальных или протозойных патогенов, которые индуцируют развитие клеточного ответа и созревание Т-лим- фоцитов-киллеров (CD8+ клеток).
Таким образом, пептиды, презентируемые молекулами HLA класса I, несут информацию о всех цитозольных эндогенных белках, как нормальных, так и измененных либо в результате мутации, либо вследствие модификации вирусами, а также иными внутриклеточными паразитами. Поскольку "классические" антигены ГКГ класса I представлены, как уже упоминалось, на всех клетках организма, становится понятным насколько важен подобный цензорный механизм за изме-
ненными клетками организма, индуцирующии активацию цитотоксических Т-лимфоцитов-киллеров (CD8+ клетки).
Гены системы HLA класса II (см. рис. 10) расположены непосредственно вблизи центромеры и включают несколько локусов, часть из которых — DR, DP, DQ — можно отнести к "классическим", транс-. плантационным или непосредственно принимающим участие в презентации чужеродного антигена при его распознавании; другие же несут хоть и чрезвычайно важную, но все же вспомогательную функцию.
Антигены, кодируемые генами системы HLA класса II локусов DR, DP и DQ, экспрессируются, в противоположность молекулам HLA класса I, не столь широко. Они обнаружены в норме лишь на В-лим- фоцитах, макрофагах и дендритных клетках (т. е. на клетках, способных презентировать антиген). При воздействии таких цитокинов, как гамма-интерферон, молекулы HLA класса II могут экспрессироваться и на других клетках, например Т-лимфоцитах, эндотелиальных и эпителиальных клетках.
Молекулы HLAкласса II (рис. 13) несколько отличаются по структуре от молекул HLA класса I. Являясь гетеродимерами, альфа- и бета-
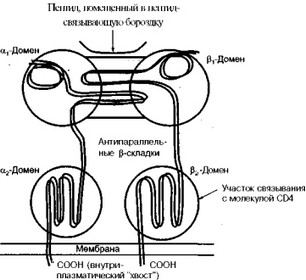
Рис. 13. Схематическое изображение молекулы (антигена) HLA класса II (объяснение в тексте).
цепи состоят приблизительно из 230 аминокислотных остатков, каждая из которых формирует два внеклеточных домена (альфа 1 и аль- фа2, бета1 и бета2), трансмембранную часть и внутриплазматический "хвост"; бета-цепь является высокополиморфной. Молекулы HLA класса II также имеют пептидсвязывающую бороздку, в формировании которой принимают участие поровну альфа 1 и бета1 домены альфа- и бета-полипептидных цепей: их альфа-спирали ("стены" бороздки) и антипараллельные бета-складки ("дно" бороздки).
В пептидсвязывающих бороздках антигенов системы HLA класса II также имеются пептиды, но в основе их образования (продукции) лежит принципиально иной внутриклеточный механизм. В этом случае пептиды! происходят из экзогенных антигенов, поглощенных антигенпред- ставляющими клетками с помощью, например, эндоцитоза (рис. 14).
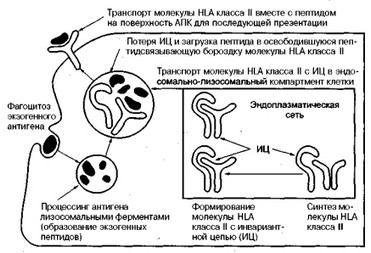
Рис. 14. Схема механизма презентации антигена с помощью молекулы HLA класса II (объяснение в тексте).
После эндоцитоза чужеродный антиген' подвергается деградации (протеолизу) в ранних и поздних эндосомах (лизосомах), в результате чего образуются пептиды. Однако "загрузка" этих пептидов в пептидсвязывающую бороздку молекул HLA класса II происходит не в эндоплазматической сети. Дело в том, что хотя сборка молекул HLA класса II и происходит в эндоплазматической сети, но в этом компарт-
менте клетки указанные молекулы имеют дополнительную цепь, названную инвариантной цепью (ИЦ), которая как бы "прикрывает" собой пептидсвязывающую бороздку. Такой комплекс — молекулы HLA класса II + инвариантная цепь — транспортируется через комплекс Гольджи в эндосомальный компартмент клетки, где находится пептид, образовавшийся из чужеродного антигена. Здесь под влиянием катепсинов В и D происходит разрушение инвариантной цепи и "загрузка" пептидов в открывшуюся пептидсвязывающую бороздку. На следующем этапе образовавшийся комплекс — молекула HLA класса II + пептид — транспортируется на поверхность клетки и представляется для распознавания Т-лимфоцитам-хелперам (CD4+ клеткам). Активированные таким образом Т-лимфоциты-хелперы в свою очередь участвуют в реализации иммунного ответа.
Говоря об основной роли молекул HLA класса I и II в реализации иммунного ответа, следует подчеркнуть их необходимость для антигенной активации Т-клеток. В отличие от В-клеток, которые непосредственно распознают антиген за счет своих иммуноглобулиновых рецепторов, Т-клетки могут распознавать его только в том случае, если антиген в виде пептида экспрессирован на клеточной мембране в комплексе с собственной HLA-молекулой — феномен HLA-рестрикции (ограничение распознавания антигенных пептидов молекулами HLA; рис. 15).
Установлено, что субпопуляция Т-лимфоцитов-хелперов (CD4+ клетки) распознают чужеродный пептид, который презентируется молекулами HLA класса II, а субпопуляция Т-лимфоцитов-киллеров/суп- рессоров (CD8+ клетки) распознает пептид, который презентируется молекулами HLA класса I (поэтому говорят, что функция Т-хелперов ограничена (рестриктирована) молекулами HLA класса II, а функция Т-киллеров/супрессоров — молекулами HLA класса I). Доказано, что структуры CD4 и CD8, имеющиеся на Т-хелперах и Т-киллерах/суп- рессорах соответственно, представляют собой дополнительные, адгезивные, молекулы, которые стабилизируют присоединение Т-клеток хелперов и киллеров к антигенпредставляющим клеткам с помощью специфического взаимодействия с неполиморфными частями соответственно молекул HLA класса II (бета2-домен) и класса I (альфаЗ-до- мен). Они специфически распознают аутологичные молекулы ГКГ и к!ак бы "удерживают" вместе антигенпредставляющую клетку и Т-лим- фоцит, обеспечивая тем самым достаточный контакт клеток в процессе распознавания. Кроме того, CD4 и CD8 молекулы относятся к так называемым костимуляционным молекулам, способствуя трансдукции сигнала внутрь Т-лимфоцита. Еще одним важным костимуляционным сигналом для активации Т-лимфоцита является взаимодействие его ре-
цептора CD28 с белками на поверхности антигенпредставляющей клетки, которые относятся к семейству молекул CD80. В процессе этого взаимодействия усиливается передача сигнала внутрь Т-лимфоцита, в результате чего происходит его активация. Без костимуляционных сигналов активация Т-лимфоцитов не наступит; возможна его гибель по механизмам апоптоза. ,
В табл. 5 приведена краткая сравнительная характеристика антигенов (молекул) системы HLA классов I и II.
Важным является также возможность изменения степени экспрессии молекул HLA. Установлено, что молекулы класса И, имеющиеся в норме только на антигенпредставляющих клетках, могут индуцироваться на многих (если не на всех) клетках под влиянием инкубации с гамма-интерфероном, который включает транскрипцию генов II класса в этих клетках. Кроме того, обработка гамма-интерфероном клеток, на которых обычно обнаруживаются молекулы HLA класса II, будет усиливать их экспрессию, тогда как простагландин Е будет снижать этот эффект. Отсюда следует, что количественная и качественная экспрессия молекул HLA классов I и II может критически зависеть от различных регуляторных механизмов, которые способны ее как усиливать, так и ослаблять. Это обстоятельство имеет важное значение.
Таблица 5. Краткая характеристика классических антигенов системы HLA
класса I и II
Так, клетки, являющиеся в норме класс-П-негативными, в присутствии гамма-интерферона (продуцируемого активированными Т-клетками- хелперами) могут становиться класс-И-позитивными и приобретать способность индуцировать антигенспецифический ответ. Поскольку степень Т-клеточной активации (до определенного предела) прямо пропорциональна концентрации HLA-молекул, количественные вариации в экспрессии молекул HLAI и II классов могут оказывать иммунорегуляторное воздействие, усиливая (или ослабляя) иммунный ответ.
Гены системы HLA класса III (см. рис. 10) занимают на 6-ой хромосоме промежуточное положение между генами класса I и класса II. Они не кодируют классические антигены гистосовместимости, но их продукты выполняют целый ряд важнейших биологических функций.
Одним из генов системы HLA класса III, привлекающих наибольшее внимание, является ген CYP21, основной функцией которого является контроль активности ферментов цитохрома Р450. Дефект этого гена приводит к развитию синдрома конгенетальной адреналовой гиперплазии, частота которой составляет в популяции .европеоидов 1/10000. "Нормально" функцию ферментов кодирует ген CYP21; тогда как CYP21P является псевдогеном.
Гены С4 (С4А и С4В) кодируют 4-й компонент комплемента.
В популяции европеоидов наличие "С4А нулевой аллели" в большинстве случаев ассоциировано с предрасположенностью к системной красной волчанке и другой аутоиммунной патологии. Что касается ассоциации системной красной волчанки с HLA гаплотипом (совокупность генов, расположенных на одной хромосоме) в целом, то наиболее сильная связь с предрасположенностью к системной красной волчанке установлена для гаплотипа HLA-A1, В8, Cw4, DR3.
Ген В (Bf) функционирует в значительной степени совместно с геном С2, принимая участие в "запуске" альтернативного пути активации. Дефицит гена В описан только в гетерозиготе. В гомозиготе дефицит этого гена не описан и, по-видимому, является летальным.
Дефицит С2 является наиболее частой формой недостаточности системы комплемента у человека (частота отсутствия С2 в гомозиготе 1:10000). У 40% больных системной красной волчанкой обнаружен дефицит С2.
Следующим после локуса С2 в сторону от центромеры является локус генов теплового шока 70 (HSP70). Белковые продукты этих генов обладают протективной функцией при развитии так называемого клеточного стресса (повышение температуры тела, изменение рН и ос- мотичности внутри- и внеклеточной среды). Не исключено, что продукты этих генов могут обусловливать ассоциацию определенных аллельных вариантов HLA-генов с заболеваниями человека.
Крайним в сторону теломеры среди генов системы HLA класса III является локус опухольнекротизирующего фактора (TNF), состоящий из двух генов А и В, которые кодируют ОНФ-адьфа и ОНФ-бета. Оба белка секретируются активированными макрофагами и Т-лимфоци- тами и оказывают плейотропное действие на различные типы клеток, включая различные субпопуляции лимфоцитов, нейтрофилы и эндо- телиоииты сосудов.
Указанные механизмы действия белков ОНФ, а также их влияние на воспалительный процесс, опосредованный ими цитолитический и цитотоксический эффект против раковых клеток, обеспечивает важнейшую биологическую функцию ОНФ. Помимо этого, белки ОНФ участвуют в регуляции экспрессии антигенов HLA класса I на эндотелии сосудов, что свидетельствует об участии ОНФ в развитии аутоиммунной патологии и реакции отторжения трансплантации.
HLA-гены наследуются по кодоминантному типу, что означает одинаковое проявление у гибридов аллоантигенов, определяемых обоими родительскими аллелями данного локуса. Поскольку каждый индивидуум получает от своих родителей по одной хромосоме, у человека имеется два гаплотипа, которые в совокупности составляют генотип.
Антигены, выявленные при изучении клеток конкретного человека, составляют его фенотип; такое лабораторное обследование называют фенотипированием. В отличие от фенотипа в генотипе известна последовательность расположения генов на хромосоме. Генотип (два гаплотипа) может быть определен с помощью семейных исследований, при которых выявляются фенотипы родителей и детей (родные сестры и братья — сибсы). Таким образом, определяя фенотипы членов семьи, можно установить гаплотипы.
Для решения важных вопросов, связанных с изучением ГКГ человека, организуются и проводятся Международные рабочие совещания (Международные воркшопы). Решение об упорядочении специфичностей, особенно об отмене "w", принимается при корреляции всех данных рабочего совещания (результатов исследований локальных лабораторий, с одной стороны, и данных, полученных при окончательном компьютерном анализе, — с другой).
Эксперименты на животных, а также результаты, полученные прежде всего после пересадки аллогенных органов, показали, что в целом млекопитающие по способности развивать иммунный ответ на конкретный антиген делятся условно на три группы: 1) респондеры
(to respond — отвечать), развивающие сильную иммунную реакцию; 2) нонреспондеры — реагирующие на тот же антиген слабо; 3) часть популяции, реагирующих средне. Было высказано предположение о существовании гена иммунного ответа (1г — Immune response), который предопределяет индивидуальную специфику иммунного реагирования. Действительно, в 1972 г. McDevitt и соавт. сообщили о том, что им удалось картировать ген иммунного ответа у мышей именно в области ГКГ. Попытки обнаружить Ir-ген у человека пока не увенчались успехом. Вместе с тем, достижения фундаментальной иммунологии последних лет позволили сформировать представление об 1г-гене у человека, как о некой интегральной функции, в которой принимают участие "главные действующие лица" процесса распознавания: чужеродный пептид, молекулы HLA класса I и II и Т-клеточный антиген- распознающий рецептор. R. Lechler (1994) описывает участие упомянутых структур в реализации интегральной функции иммунного распознавания следующим образом:
Во-первых, необходимо, чтобы антигенпредставляющая клетка могла "сделать" оптимальное количество пептидов из чужеродного антигенного материала, а ее пептидсвязывающие бороздки смогли связать эти пептиды; этот этап назван селекцией антигенных детерминант.
Во-вторых, необходимо, чтобы иммунная система конкретного человека имела достаточный репертуар Т-лимфоцитов с антигенрас- познающим рецептором, способным распознать чужеродный пептид. Если же такие Т-лимфоциты отсутствуют, (т. е. имеют место "дыры" в репертуаре Т-лимфоцитов), то создаются условия, при которых иммунная система не способна распознать некоторые экзогенные антигены.
В-третьих, предполагается, что на конечном этапе распознавания включаются (с помощью все того же пептида) разные механизмы, приводящие в одном случае к индукции иммунного ответа, а в другом — к его супрессии.
На практике это подтверждается доказательством существования двух субпопуляций Т-хелперов: 1-го и 2-го типов. Т-хелперы 1-го типа, продуцируя ИЛ-2, гамма-интерферон, индуцируют клеточный ответ, реализуемый специфическими Т-киллерами (CD8+ клетками). Т-Хел- перы 2-го типа индуцируют гуморальный ответ за счет продукции ИЛ-4, ИЛ-5. Интенсивность и клеточного, и гуморального ответа находится под контролем супрессорного цитокина— ИЛ-10, который продуцируется Т-хелперами 2-го типа. По какому "сценарию" будет развиваться иммунный ответ зависит от многих факторов, большинство из которых пока неизвестно.
Еще раз подчеркнем, что информацию об антигене, представляемую молекулами HLA класса I, "считывают" Т-лимфоциты-киллеры (CD8+ клетки), а молекулами HLA класса II — Т-лимфоциты-хелпе- ры (CD4+ клетки).
Весьма важно помнить, что "считывание" информации об антигене Т-лимфоцитами (как CD8+, так и CD4+) возможно лишь в том случае, если она представляется им аутологичными HLA-молекулами. Эта закономерность составляет основное правило иммунного распознавания и сущность феномена HLA-рестрикции (т.е. ограничения функции распознавания собственными молекулами гистосовместимости). За открытие феномена HLA-рестрикции была присуждена Нобелевская премия американским ученым Дохерти и Цинкернагель.
Первые работы, свидетельствующие о том, что у млекопитающих существуют гены, детерминирующие выраженность трансплантационной реакции отторжения, появились более 40 лет тому назад, с началом активной пересадки органов. Впоследствии эта группа генов получила название "главный комплекс гистосовместимости" (Major Histocompatibility Complex — МНС). Самим названием была подчеркнута их определяющая роль в развитии трансплантационного иммунитета. У человека этот комплекс генов получил название системы HLA (Human Leukocyte Antigen). Таким образом, аббревиатуры ГКГ, МНС и HLA для человека являются синонимами обозначения главного комплекса гистосовместимости.
Действительно, до недавнего времени изучение проблем, связанных с антигенами системы HLA (трансплантационными, или тканевыми, антигенами), диктовалось в основном их очевидным практическим значением в пересадке органов, прежде всего — в пересадке почки. Первичная биологическая функция трансплантационных антигенов была неизвестна. Однако достижения последних лет в исследовании генетической структуры и биологической роли ГКГ позволили определить, по крайней мере, две основные его функции, которые имеют общебиологическое значение. К ним относятся: 1) роль трансплантационных антигенов в межклеточных взаимодействиях при реализации иммунного ответа; 2) функция HLA-региона, связанная с иммунологической реактивностью организма в целом. В первом случае речь идет о том, что молекулы ГКГ являются теми структурами, с помощью которых осуществляется презентация чужеродного антигенного материала для последующего распознавания Т-клеточным антигенраспознающим рецептором. Во втором случае речь идет о существовании в HLA-регионе специального гена иммунного ответа (1г — immune response), наличие которого определяет способность данного организма развивать иммунный ответ на конкретный антиген; эта же функция HLA-региона связана с предрасположенностью к ряду заболеваний.
Началом изучения антигенов гистосовместимости человека можно считать работу G. Dausset (1957), в которой был описан первый антиген гистосовместимости человека, названный Мае (сейчас это HLA-A2).
Некоторые исследователи называют антигены ГКГ "иммунным паспортом, группой белой крови", с помощью которых иммунная система способна различать ''свое'' —self от "чужого" —non-self. Индивидуальный набор и свойства молекул ГКГ во многом определяют силу иммунного ответа конкретного человека на конкретный антиген.
Отметив, что клетки гомозиготных близнецов реагируют с набором тест-сывороток одинаково, а гетерозиготных — по разному, G. Dausset высказал подтвердившееся впоследствии предположение о генетической детерминированности антигенов гистосовместимости: т. е. о том, что каждый из генов, входящих в HLA-комплекс, имеет свое представительство в виде антигена гистосовместимости, экспрессируемого на мембране клетки.
В настоящее время ГКГ (HLA) человека является одним из наиболее хорошо изученных и вместе с тем наиболее сложных генетических структур в геноме человека.
Обозначение HLA-специфичностей включает три компонента: 1) аббревиатуру всей системы; 2) локус, содержащий данную специфичность; 3) номер антигена (например HLA-B12). В том случае, когда генетическая позиция антигена еще недостаточно ясна или недостаточно уточнена, перед его порядковым номером ставят символ "w" (workshop).
На рис МО представлена несколько упрощенная схема системы HLA человека. Установлено, что гены HLA-системы расположены на коротком плече хромосомы 6. Все они разделены на три группы: гены гистосовместимости класса I, класса II и класса III; также сгруппированы и молекулы (антигены), которые контролируются этими генами.
В настоящее время гены системы HLA класса I включают локусы

Рис. 10. Схематическое изображение генного комплекса HLA на С6 хромосоме.
В, С, Е, A, G, F (по направлению к теломере). Часть из них — локусы В, С и А — относят к так называемым "классическим", кодирующим традиционные трансплантационные антигены. Что касается недавно открытых локусов Е, G, F, то биологическая функция их самих и их продуктов в настоящее время уточняется. Возможно, некоторые из них принимают участие в презентации антигена для распознавания интраэпителиальными Т-лимфоцитами-киллерами, несущими гамма-, дельта-цепи в антиген-распознающем рецепторе; другие определяют взаимоотношения в системе "мать-плод" (например антигены локуса G).
В норме "классические" антигены системы HLA класса I присутствуют на всех ядерных клетках, отличаясь лишь степенью интенсивности их экспрессии. Доказано наиболее низкое содержание их на миокарди- оцитах, скелетных мышцах, эндотелии роговицы; не установлено их присутствие на нитях трофобласта. Степень выраженности антигенов системы HLA как I, так и II класса — непостоянна и зависит от воздействия, прежде всего, так называемых эндогенных факторов модификации иммунного ответа, к которым относят интерлейкины, интерферо- ны, опухольнекротизирующий фактор, простагландины и др.
Одной из важнейших характеристик генов системы HLA является их разнообразие и полиморфизм, т. е. существование в пределах каждого локуса большого количества различных специфичностей HLA- генов (или множественных аллельных вариантов), отличающихся между собой по аминокислотным последовательностям, входящим в вариабельный участок ДНК, что определяет их полиморфизм. В настоящее время описано более 40 специфичностей в локусе А, более 60 специ-
фичностей в локусе В и около 20 — в локусе С (R. Lechler, 1994). Кроме того, показано, что некоторые специфичности (гены) имеют по несколько аллельных вариантов. Так, например, HLA-A2 специфичность имеет 12 аллелей, В35 — 6, а В27 — 7 аллелей. Наличие аллельного полиморфизма HLA молекул лежит в основе строгой индивидуализации набора трансплантационных антигенов у каждого конкретного человека, делая его неповторимым в этом плане.
Очень важным этапом в развитии учения о системе HLA и в понимании функции молекул HLA класса I стали работы, в которых было описано их тонкое строение.
На рис. 11 представлено схематическое изображение структуры молекулы (антигена) HLA класса I (I. Roitt, 1994). По современным представлениям, молекула HLA класса I является гетеродимером, состоящим из тяжелой альфа-полипептидной цепи и нековалентно связанной с ней легкой бета-полипептидной цепи.

Рис. 11. Схематическое изображение молекулы (антигена) HLA класса I (объяснение в тексте).
Альфа-цепи молекул класса 'I содержат приблизительно 340 аминокислотных остатков, которые формируют три внеклеточных домена (альфа 1, альфа2, альфаЗ), одну трансмембранную часть и внутрицитоплазматический "хвост". Они кодируются генами локусов А, В и С комплекса HLA, расположенного на 6-ой хромосоме, и как упоминалось, являются высокополиморфными. Бета-цепь молекулы класса I представляет собой бета-2-микроглобулин, который состоит из внеклеточного домена, включающего 100 аминокислотных остатков, он кодируется геном, расположенным на 15-ой хромосоме и является неполиморфным.
Серия работ, выполненная P. Bjorkman и др. (1987), впервые позволила понять природу пространственного взаимодействия HLA-mo- лекул и антигенных пептидов.
Оказалось, что взаимное расположение альфа 1- и альфа2-доменов в молекуле HLA класса I создают некий "желоб", "карман", в формировании которого принимают участие две альфа-спирали — "стены" и антипараллельные бета-складки — "дно"; эта структура получила название "пептидсвязывающая бороздка". Определенная аминокислотная последовательность этой бороздки служит своеобразным "якорем" удержания в нем пептида. Именно таким образом HLA-молекула класса I презентирует (представляет) специфический пептид для его дальнейшего распознавания альфа- и бета-цепями Т-клеточного антиген- распознающего рецептора.
Как упоминалось выше, пептид представляет собой процессированный антиген (чужеродный или собственный), состоящий из небольшого числа аминокислотных остатков. Так называемый линейный пептид, который находится в пептидсвязывающей бороздке молекулы HLA класса I, состоит всего из 4—9 аминокислотных остатков. Несколько больше (до 20) их содержат пептиды, которые находятся в "бороздках" молекул класса И. По сути дела пептид представляет собой антигенную детерминанту — эпитоп. Сложный антиген может содержать сотни пептидов.
Как же образуется пептид, как он попадает в пептидсвязывающую бороздку молекулы гистосовместимости класса I и как она появляется на поверхности клетки? Это стало понятным после обнаружения двух новых локусов — LMP и ТАР, отнесенных к классу II (см. рис. 10).
Гены локуса LMP кодируют большой пептидазный комплекс, названный протеасомой. Протеасома является внутриклеточным комплексом, вовлеченным в протеолиз цитозольных белков, что обеспечивает продукцию эндогенных пептидов (рис. 12).
В свою очередь, эти пептиды с помощью трансмембранных белков, которые контролируются генами локуса ТАР, доставляются в

Рис. 12. Схема механизма презентации антигена с помощью молекулы HLA класса I (объяснение в тексте).
В цитозоле, кроме эндогенных пептидов, образуются также некоторые экзогенные пептиды, в частности вирусные.
эндоплазматическую сеть и там "загружаются" в пептидсвязывающую бороздку антигенов системы HLA класса I, затем транспортируются на поверхность клетки и далее представляются для распознавания предшественникам Т-лимфоцитов-киллеров/супрессоров (CD8+ клетки).
Важно помнить, что к антигенам, подвергающимся воздействию про- теасом, относятся не только собственные цитозольные белки, но и продукты многих вирусных, бактериальных или протозойных патогенов, которые индуцируют развитие клеточного ответа и созревание Т-лим- фоцитов-киллеров (CD8+ клеток).
Таким образом, пептиды, презентируемые молекулами HLA класса I, несут информацию о всех цитозольных эндогенных белках, как нормальных, так и измененных либо в результате мутации, либо вследствие модификации вирусами, а также иными внутриклеточными паразитами. Поскольку "классические" антигены ГКГ класса I представлены, как уже упоминалось, на всех клетках организма, становится понятным насколько важен подобный цензорный механизм за изме-
ненными клетками организма, индуцирующии активацию цитотоксических Т-лимфоцитов-киллеров (CD8+ клетки).
Гены системы HLA класса II (см. рис. 10) расположены непосредственно вблизи центромеры и включают несколько локусов, часть из которых — DR, DP, DQ — можно отнести к "классическим", транс-. плантационным или непосредственно принимающим участие в презентации чужеродного антигена при его распознавании; другие же несут хоть и чрезвычайно важную, но все же вспомогательную функцию.
Антигены, кодируемые генами системы HLA класса II локусов DR, DP и DQ, экспрессируются, в противоположность молекулам HLA класса I, не столь широко. Они обнаружены в норме лишь на В-лим- фоцитах, макрофагах и дендритных клетках (т. е. на клетках, способных презентировать антиген). При воздействии таких цитокинов, как гамма-интерферон, молекулы HLA класса II могут экспрессироваться и на других клетках, например Т-лимфоцитах, эндотелиальных и эпителиальных клетках.
Молекулы HLAкласса II (рис. 13) несколько отличаются по структуре от молекул HLA класса I. Являясь гетеродимерами, альфа- и бета-

Рис. 13. Схематическое изображение молекулы (антигена) HLA класса II (объяснение в тексте).
цепи состоят приблизительно из 230 аминокислотных остатков, каждая из которых формирует два внеклеточных домена (альфа 1 и аль- фа2, бета1 и бета2), трансмембранную часть и внутриплазматический "хвост"; бета-цепь является высокополиморфной. Молекулы HLA класса II также имеют пептидсвязывающую бороздку, в формировании которой принимают участие поровну альфа 1 и бета1 домены альфа- и бета-полипептидных цепей: их альфа-спирали ("стены" бороздки) и антипараллельные бета-складки ("дно" бороздки).
В пептидсвязывающих бороздках антигенов системы HLA класса II также имеются пептиды, но в основе их образования (продукции) лежит принципиально иной внутриклеточный механизм. В этом случае пептиды! происходят из экзогенных антигенов, поглощенных антигенпред- ставляющими клетками с помощью, например, эндоцитоза (рис. 14).

Рис. 14. Схема механизма презентации антигена с помощью молекулы HLA класса II (объяснение в тексте).
После эндоцитоза чужеродный антиген' подвергается деградации (протеолизу) в ранних и поздних эндосомах (лизосомах), в результате чего образуются пептиды. Однако "загрузка" этих пептидов в пептидсвязывающую бороздку молекул HLA класса II происходит не в эндоплазматической сети. Дело в том, что хотя сборка молекул HLA класса II и происходит в эндоплазматической сети, но в этом компарт-
менте клетки указанные молекулы имеют дополнительную цепь, названную инвариантной цепью (ИЦ), которая как бы "прикрывает" собой пептидсвязывающую бороздку. Такой комплекс — молекулы HLA класса II + инвариантная цепь — транспортируется через комплекс Гольджи в эндосомальный компартмент клетки, где находится пептид, образовавшийся из чужеродного антигена. Здесь под влиянием катепсинов В и D происходит разрушение инвариантной цепи и "загрузка" пептидов в открывшуюся пептидсвязывающую бороздку. На следующем этапе образовавшийся комплекс — молекула HLA класса II + пептид — транспортируется на поверхность клетки и представляется для распознавания Т-лимфоцитам-хелперам (CD4+ клеткам). Активированные таким образом Т-лимфоциты-хелперы в свою очередь участвуют в реализации иммунного ответа.
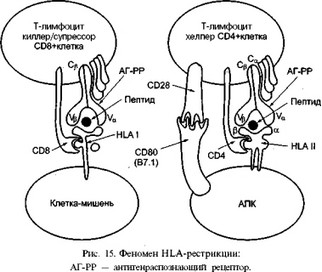
Говоря об основной роли молекул HLA класса I и II в реализации иммунного ответа, следует подчеркнуть их необходимость для антигенной активации Т-клеток. В отличие от В-клеток, которые непосредственно распознают антиген за счет своих иммуноглобулиновых рецепторов, Т-клетки могут распознавать его только в том случае, если антиген в виде пептида экспрессирован на клеточной мембране в комплексе с собственной HLA-молекулой — феномен HLA-рестрикции (ограничение распознавания антигенных пептидов молекулами HLA; рис. 15).
Установлено, что субпопуляция Т-лимфоцитов-хелперов (CD4+ клетки) распознают чужеродный пептид, который презентируется молекулами HLA класса II, а субпопуляция Т-лимфоцитов-киллеров/суп- рессоров (CD8+ клетки) распознает пептид, который презентируется молекулами HLA класса I (поэтому говорят, что функция Т-хелперов ограничена (рестриктирована) молекулами HLA класса II, а функция Т-киллеров/супрессоров — молекулами HLA класса I). Доказано, что структуры CD4 и CD8, имеющиеся на Т-хелперах и Т-киллерах/суп- рессорах соответственно, представляют собой дополнительные, адгезивные, молекулы, которые стабилизируют присоединение Т-клеток хелперов и киллеров к антигенпредставляющим клеткам с помощью специфического взаимодействия с неполиморфными частями соответственно молекул HLA класса II (бета2-домен) и класса I (альфаЗ-до- мен). Они специфически распознают аутологичные молекулы ГКГ и к!ак бы "удерживают" вместе антигенпредставляющую клетку и Т-лим- фоцит, обеспечивая тем самым достаточный контакт клеток в процессе распознавания. Кроме того, CD4 и CD8 молекулы относятся к так называемым костимуляционным молекулам, способствуя трансдукции сигнала внутрь Т-лимфоцита. Еще одним важным костимуляционным сигналом для активации Т-лимфоцита является взаимодействие его ре-

цептора CD28 с белками на поверхности антигенпредставляющей клетки, которые относятся к семейству молекул CD80. В процессе этого взаимодействия усиливается передача сигнала внутрь Т-лимфоцита, в результате чего происходит его активация. Без костимуляционных сигналов активация Т-лимфоцитов не наступит; возможна его гибель по механизмам апоптоза. ,
В табл. 5 приведена краткая сравнительная характеристика антигенов (молекул) системы HLA классов I и II.
Важным является также возможность изменения степени экспрессии молекул HLA. Установлено, что молекулы класса И, имеющиеся в норме только на антигенпредставляющих клетках, могут индуцироваться на многих (если не на всех) клетках под влиянием инкубации с гамма-интерфероном, который включает транскрипцию генов II класса в этих клетках. Кроме того, обработка гамма-интерфероном клеток, на которых обычно обнаруживаются молекулы HLA класса II, будет усиливать их экспрессию, тогда как простагландин Е будет снижать этот эффект. Отсюда следует, что количественная и качественная экспрессия молекул HLA классов I и II может критически зависеть от различных регуляторных механизмов, которые способны ее как усиливать, так и ослаблять. Это обстоятельство имеет важное значение.
Таблица 5. Краткая характеристика классических антигенов системы HLA
класса I и II
|
Характеристика |
Класс I |
Класс II |
|
Генетические локусы |
HLA— А, В, С |
HLA — DP, DQ, DR |
|
Распределение в тканях |
Все ядросодержащие клетки |
В-лимфоциты, МОНОЦИТЫ- - макрофаги, дендритные клетки, активированные Т-лимфо- циты, эпителиальные и эндотелиальные клетки |
|
Участие в презентации пептидов для Т-клеток |
Для Т-киллеров (CD8+) |
Для Т-хелперов (CD4+) |
|
Связывание с поверхностными молекулами Т-кле- ток |
С молекулой CD8 |
С молекулой CD4 |
Так, клетки, являющиеся в норме класс-П-негативными, в присутствии гамма-интерферона (продуцируемого активированными Т-клетками- хелперами) могут становиться класс-И-позитивными и приобретать способность индуцировать антигенспецифический ответ. Поскольку степень Т-клеточной активации (до определенного предела) прямо пропорциональна концентрации HLA-молекул, количественные вариации в экспрессии молекул HLAI и II классов могут оказывать иммунорегуляторное воздействие, усиливая (или ослабляя) иммунный ответ.
Гены системы HLA класса III (см. рис. 10) занимают на 6-ой хромосоме промежуточное положение между генами класса I и класса II. Они не кодируют классические антигены гистосовместимости, но их продукты выполняют целый ряд важнейших биологических функций.
Одним из генов системы HLA класса III, привлекающих наибольшее внимание, является ген CYP21, основной функцией которого является контроль активности ферментов цитохрома Р450. Дефект этого гена приводит к развитию синдрома конгенетальной адреналовой гиперплазии, частота которой составляет в популяции .европеоидов 1/10000. "Нормально" функцию ферментов кодирует ген CYP21; тогда как CYP21P является псевдогеном.
Гены С4 (С4А и С4В) кодируют 4-й компонент комплемента.
В популяции европеоидов наличие "С4А нулевой аллели" в большинстве случаев ассоциировано с предрасположенностью к системной красной волчанке и другой аутоиммунной патологии. Что касается ассоциации системной красной волчанки с HLA гаплотипом (совокупность генов, расположенных на одной хромосоме) в целом, то наиболее сильная связь с предрасположенностью к системной красной волчанке установлена для гаплотипа HLA-A1, В8, Cw4, DR3.
Ген В (Bf) функционирует в значительной степени совместно с геном С2, принимая участие в "запуске" альтернативного пути активации. Дефицит гена В описан только в гетерозиготе. В гомозиготе дефицит этого гена не описан и, по-видимому, является летальным.
Дефицит С2 является наиболее частой формой недостаточности системы комплемента у человека (частота отсутствия С2 в гомозиготе 1:10000). У 40% больных системной красной волчанкой обнаружен дефицит С2.
Следующим после локуса С2 в сторону от центромеры является локус генов теплового шока 70 (HSP70). Белковые продукты этих генов обладают протективной функцией при развитии так называемого клеточного стресса (повышение температуры тела, изменение рН и ос- мотичности внутри- и внеклеточной среды). Не исключено, что продукты этих генов могут обусловливать ассоциацию определенных аллельных вариантов HLA-генов с заболеваниями человека.
Крайним в сторону теломеры среди генов системы HLA класса III является локус опухольнекротизирующего фактора (TNF), состоящий из двух генов А и В, которые кодируют ОНФ-адьфа и ОНФ-бета. Оба белка секретируются активированными макрофагами и Т-лимфоци- тами и оказывают плейотропное действие на различные типы клеток, включая различные субпопуляции лимфоцитов, нейтрофилы и эндо- телиоииты сосудов.
Указанные механизмы действия белков ОНФ, а также их влияние на воспалительный процесс, опосредованный ими цитолитический и цитотоксический эффект против раковых клеток, обеспечивает важнейшую биологическую функцию ОНФ. Помимо этого, белки ОНФ участвуют в регуляции экспрессии антигенов HLA класса I на эндотелии сосудов, что свидетельствует об участии ОНФ в развитии аутоиммунной патологии и реакции отторжения трансплантации.
HLA-гены наследуются по кодоминантному типу, что означает одинаковое проявление у гибридов аллоантигенов, определяемых обоими родительскими аллелями данного локуса. Поскольку каждый индивидуум получает от своих родителей по одной хромосоме, у человека имеется два гаплотипа, которые в совокупности составляют генотип.
Антигены, выявленные при изучении клеток конкретного человека, составляют его фенотип; такое лабораторное обследование называют фенотипированием. В отличие от фенотипа в генотипе известна последовательность расположения генов на хромосоме. Генотип (два гаплотипа) может быть определен с помощью семейных исследований, при которых выявляются фенотипы родителей и детей (родные сестры и братья — сибсы). Таким образом, определяя фенотипы членов семьи, можно установить гаплотипы.
Для решения важных вопросов, связанных с изучением ГКГ человека, организуются и проводятся Международные рабочие совещания (Международные воркшопы). Решение об упорядочении специфичностей, особенно об отмене "w", принимается при корреляции всех данных рабочего совещания (результатов исследований локальных лабораторий, с одной стороны, и данных, полученных при окончательном компьютерном анализе, — с другой).
Эксперименты на животных, а также результаты, полученные прежде всего после пересадки аллогенных органов, показали, что в целом млекопитающие по способности развивать иммунный ответ на конкретный антиген делятся условно на три группы: 1) респондеры
(to respond — отвечать), развивающие сильную иммунную реакцию; 2) нонреспондеры — реагирующие на тот же антиген слабо; 3) часть популяции, реагирующих средне. Было высказано предположение о существовании гена иммунного ответа (1г — Immune response), который предопределяет индивидуальную специфику иммунного реагирования. Действительно, в 1972 г. McDevitt и соавт. сообщили о том, что им удалось картировать ген иммунного ответа у мышей именно в области ГКГ. Попытки обнаружить Ir-ген у человека пока не увенчались успехом. Вместе с тем, достижения фундаментальной иммунологии последних лет позволили сформировать представление об 1г-гене у человека, как о некой интегральной функции, в которой принимают участие "главные действующие лица" процесса распознавания: чужеродный пептид, молекулы HLA класса I и II и Т-клеточный антиген- распознающий рецептор. R. Lechler (1994) описывает участие упомянутых структур в реализации интегральной функции иммунного распознавания следующим образом:
Во-первых, необходимо, чтобы антигенпредставляющая клетка могла "сделать" оптимальное количество пептидов из чужеродного антигенного материала, а ее пептидсвязывающие бороздки смогли связать эти пептиды; этот этап назван селекцией антигенных детерминант.
Во-вторых, необходимо, чтобы иммунная система конкретного человека имела достаточный репертуар Т-лимфоцитов с антигенрас- познающим рецептором, способным распознать чужеродный пептид. Если же такие Т-лимфоциты отсутствуют, (т. е. имеют место "дыры" в репертуаре Т-лимфоцитов), то создаются условия, при которых иммунная система не способна распознать некоторые экзогенные антигены.
В-третьих, предполагается, что на конечном этапе распознавания включаются (с помощью все того же пептида) разные механизмы, приводящие в одном случае к индукции иммунного ответа, а в другом — к его супрессии.
На практике это подтверждается доказательством существования двух субпопуляций Т-хелперов: 1-го и 2-го типов. Т-хелперы 1-го типа, продуцируя ИЛ-2, гамма-интерферон, индуцируют клеточный ответ, реализуемый специфическими Т-киллерами (CD8+ клетками). Т-Хел- перы 2-го типа индуцируют гуморальный ответ за счет продукции ИЛ-4, ИЛ-5. Интенсивность и клеточного, и гуморального ответа находится под контролем супрессорного цитокина— ИЛ-10, который продуцируется Т-хелперами 2-го типа. По какому "сценарию" будет развиваться иммунный ответ зависит от многих факторов, большинство из которых пока неизвестно.
Еще раз подчеркнем, что информацию об антигене, представляемую молекулами HLA класса I, "считывают" Т-лимфоциты-киллеры (CD8+ клетки), а молекулами HLA класса II — Т-лимфоциты-хелпе- ры (CD4+ клетки).
Весьма важно помнить, что "считывание" информации об антигене Т-лимфоцитами (как CD8+, так и CD4+) возможно лишь в том случае, если она представляется им аутологичными HLA-молекулами. Эта закономерность составляет основное правило иммунного распознавания и сущность феномена HLA-рестрикции (т.е. ограничения функции распознавания собственными молекулами гистосовместимости). За открытие феномена HLA-рестрикции была присуждена Нобелевская премия американским ученым Дохерти и Цинкернагель.
Источник: Г. Н. Дранник, «КЛИНИЧЕСКАЯ ИММУНОЛОГИЯ и АЛЛЕРГОЛОГИЯ» 1999
А так же в разделе « Глава 12 ГЛАВНЫЙ КОМПЛЕКС ГИСТОСОВМЕСТИМОСТИ: СТРУКТУРА И ФУНКЦИИ »
- Глава 1 ОСНОВНЫЕ ЗАДАЧИ И ПРОБЛЕМЫ КЛИНИЧЕСКОЙ ИММУНОЛОГИИ
- Глава 2 ВРОЖДЕННЫЙ НЕСПЕЦИФИЧЕСКИЙ (ЕСТЕСТВЕННЫЙ) ИММУНИТЕТ
- Глава 3 СИСТЕМА КОМПЛЕМЕНТА
- КЛАССИЧЕСКИЙ ПУТЬ АКТИВАЦИИ СИСТЕМЫ КОМПЛЕМЕНТА
- АЛЬТЕРНАТИВНЫЙ ПУТЬ АКТИВАЦИИ СИСТЕМЫ КОМПЛЕМЕНТА
- БИОЛОГИЧЕСКИЕ ПОСЛЕДСТВИЯ АКТИВАЦИИ СИСТЕМЫ КОМПЛЕМЕНТА
- Глава 4 АНТИГЕНЫ
- Глава 5 ПРИОБРЕТЕННЫЙ СПЕЦИФИЧЕСКИЙ (АДАПТИВНЫЙ) ИММУНИТЕТ
- ОСНОВНЫЕ СВЕДЕНИЯ О СТРУКТУРЕ И ФУНКЦИИ СПЕЦИФИЧЕСКОГО (АДАПТИВНОГО) ИММУНИТЕТА
- СОЗРЕВАНИЕ Т- И В-ЛИМФОЦИТОВ
- ОТБОР (СЕЛЕКЦИЯ) ЛИМФОЦИТАРНОГО НАБОРА (РЕПЕРТУАРА); ОТБОР ЛИМФОЦИТОВ, НЕ РЕАГИРУЮЩИХ НА СОБСТВЕННЫЕ (SELF) АНТИГЕНЫ. СОЗДАНИЕ ТОЛЕРАНТНОСТИ
- Т-ЛИМФОЦИТЫ
- АПОПТОЗ
- Т-ЛИМФОЦИТЫ-СУПРЕССОРЫ
- В-ЛИМФОЦИТЫ
- Т-НЕЗАВИСИМАЯ ПРОДУКЦИЯ АНТИТЕЛ
- Т-ЗАВИСИМАЯ ПРОДУКЦИЯ АНТИТЕЛ
- ДИФФЕРЕНЦИРОВКА Т-ЛИМФОЦИТОВ
- ДИФФЕРЕНЦИРОВКА В-ЛИМФОЦИТОВ
- Глава 6 ИММУНОГЛОБУЛИНЫ
- ИММУНОГЛОБУЛИН
- ИММУНОГЛОБУЛИН G
- ИММУНОГЛОБУЛИН А
- ИММУНОГЛОБУЛИН Е
- ИММУНОГЛОБУЛИН D
- Глава 7 ИММУННЫЕ КОМПЛЕКСЫ
- Глава 8 ЦИТОКИНЫ - РЕГУЛЯТОРЫ И ЭФФЕКТОРЫ ИММУННОЙ СИСТЕМЫ
- ИНТЕРЛЕЙКИНЫ
- РОСТОВЫЕ ФАКТОРЫ
- ОПУХОЛЬНЕКРОТИЗИРУЮЩИЕ ФАКТОРЫ
- ХЕМОКИНЫ
- КРАТКАЯ ХАРАКТЕРИСТИКА НАИБОЛЕЕ ВАЖНЫХ ХЕМОКИНОВ
- Глава 9 ИНТЕРФЕРОНЫ
- Глава 10 МОЛЕКУЛЫ КЛЕТОЧНОЙ АДГЕЗИИ (АДГЕЗИВНЫЕ МОЛЕКУЛЫ)
- Глава 11 ИММУННАЯ СИСТЕМА СЛИЗИСТЫХ ОБОЛОЧЕК
- ЛИМФОИДНАЯ ТКАНЬ, АССОЦИИРОВАННАЯ С ЖЕЛУДКОМ И КИШЕЧНИКОМ
- МИГРАЦИЯ ЛИМФОЦИТОВ ПРИ РАЗВИТИИ ИММУННОГО ОТВЕТА В ОБЛАСТИ СЛИЗИСТЫХ ОБОЛОЧЕК
- ТОЛЕРАНТНОСТЬ, ИНДУЦИРУЕМАЯ ВВЕДЕНИЕМ АНТИГЕНА per os
- СЕКРЕЦИЯ IgA
- ТРАНСПОРТ СЕКРЕТОРНОГО IgA
- ФУНКЦИОНАЛЬНОЕ ЗНАЧЕНИЕ СЕКРЕТОРНОГО IgA
- ГАММА-, ДЕЛЬТА-Т-ЛИМФОЦИТЫ
- ВЗАИМОСВЯЗЬ АНТИГЕНОВ СИСТЕМЫ HLA С ПРЕДРАСПОЛОЖЕННОСТЬЮ К ЗАБОЛЕВАНИЯМ
- ОПРЕДЕЛЕНИЕ HLA-ФЕНОТИПА