Механизм действия антибиотиков
По клиническому применению антибиотики принято разделять на основные, или антибиотики выбора, и резервные антибиотики.
Основные, или антибиотики выбора, это те препараты, которые имеют оптимальное соотношение риска и пользы, и с которых начинают лечение до определения чувствительности к ним микроорганизмов, вызвавших заболевание.
Резервные антибиотики применяются в случае устойчивости микроорганизмов к основным антибиотикам или при непереносимости макроорганизмом основных антибиотиков. Резервные антибиотики обычно обладают меньшей активностью, у них более выражены побочные эффекты, они обладают большей токсичностью и к ним быстро развивается резистентность.
По степени значимости в терапии бактериальных инфекций антибиотики делятся на антибиотики I, II, III, IV поколений. Поколения антибиотиков различаются между собой по величине относительного коэффициента эффективности воздействия на бактериальные клетки. Обычно в клинической практике срок появления антибиотиков нового класса составляет 10 лет. В первую очередь это связано с тем, что за это время вырабатываются устойчивые штаммы микроорганизмов к старым антибиотикам. Однако такое разделение антибиотиков на поколения не всегда связано со сроками внедрения в практику новых препаратов соответствующей группы. Так, классификация це- фалоспоринов построена на спектре антибактериального действия, а появление нового поколения связывают с новым спектром их антибактериальной активности.
На клеточном уровне действие антибиотика может быть (рис. 1):
бактериостатическим, когда антибиотик блокирует репликацию и деление клеток и не вызывает их гибели. Клетки сохраняют способность к росту и размножению, если удаляется антибиотик;
бактерицидным, когда в присутствии антибиотика клетка гибнет.
Антибиотик оказывает бактерицидный эффект, так как он взаимодействует с субклеточными структурами, необратимо нарушая их целостность или функции. При этом антибиотик из-за высокого сродства связывается с ферментом или клеточными структурами, необходимыми для поддержания жизнеспособности клетки, практически необратимо.
Антибиотики, обладающие бактериостатическим действием, взаимодействуют с субклеточными структурами, на которые они влияют с меньшим эффектом,
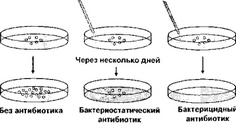
Рис.1. Действие антибиотиков in vitro
так что комплекс антибиотика с этой структурой диссоциирует, и последняя вновь становиться активной.
Клеточная стенка у большинства бактериальных клеток тонкая, эластичная, ригидная, защищает микробную клетку от внешних воздействий и определяет форму микроорганизма. Одновременно клеточная стенка поддерживает постоянство внутренней среды и защищает клетку от разрушения при высоком внутриклеточном осмотическом давлении. Через клеточную стенку происходит транспорт питательных веществ в клетку и выделение метаболитов. Структура и состав элементов клеточной стенки определяет способность воспринимать определенные красители, что позволило дифференцировать микроорганизмы на грамполо- жительные и грамотрицательные.
Основным компонентом клеточной стенки бактерий является пептидогликан. Пептидогликана значительно больше в грамположительных бактериях (до 40 слоев), в то время как у грамотрицательных бактерий всего 1-2 слоя. В состав пептидогликана входят N—ацетилг- люкозамин и N—ацетилмурамовая кислота. Пептидог- ликаны состоят из двух мономерных цепочек: ацетил- мурамовой кислоты (М) и ацетилглюкозамина (G), рас-
положенных поочередно и соединенных гликозидны- ми связями. Цепи соединены между собой четырехаминокислотными пептидами. Пептиды ответвляются от остатков ацетилмурамовой кислоты и образуют трехмерную структуру. Помимо трехмерной пептидогли- кановой сети, состоящей из гликопептидов и муреина, в клеточной стенке имеются и другие полимеры (полисахариды, липопротеины и т.д.).
Грамположительные микроорганизмы имеют несложную, но мощную клеточную стенку, состоящую из множества слоев пептидогликана, белка и тейхоевых кислот. Мембранные тейхоевые кислоты представлены цепями из чередующихся остатков глицерина или риби- та и фосфатов.
У грамотрицательных бактерий клеточная стенка тоньше, чем у грамположительных, но гораздо сложнее. Она состоит из нескольких слоев. Внутренний слой образован пептидогликаном и не имеет тейхоевой кислоты, отдален от плазматической мембраны периплаз- матическим пространством, в котором функционируют некоторые ферменты. Снаружи от пептидогликанового слоя расположена наружная мембрана, представляющая собой двойной слой липополисахарида, дающий начало структуре, сходной с плазматической мембраной. Слои пересекаются молекулами белков, некоторые из них выполняют транспортные функции. Наружную поверхность клеточный мембраны покрывает сложный липополисахаридный слой. В стенке клеточной мебраны находятся ферменты, принимающие участие в ее синтезе: трансгидроксилаза и транспептидаза.
По механизму действия антибиотики делят на (рис. 2):
ингибиторы синтеза компонентов микробной стенки или активаторы разрушающих ее ферментов (бактерицидные) — пенициллины, цефалоспорины, монобак- тамы, карбапенемы;
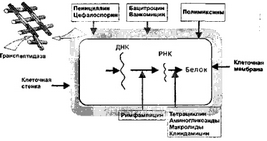
Рис 2. Механизм действия антибиотиков на микробную клетку
нарушающие структуру и функцию цитоплазматических мембран (бактерицидные): полимиксины, поли- еновые антибиотики;
ингибиторы синтеза РНК на уровне РНК-полимера- зы (бактерицидные): рифамицины, гризеофулъвин;
ингибиторы синтеза белка на уровне рибосом: бактерицидные — аминогликозиды, бактериостатические — хлорамфеникол, тетрациклин, фузидин, линкомицин, макролиды.
Ингибиторы синтеза клеточной стенки
Эти ингибиторы делятся на два класса: ингибиторы синтеза пептидогликана; ингибиторы синтеза сборки других компонентов клеточной стенки.
Механизм действия связан с подавлением синтеза или сборки липопротеида наружной мембраны грамот- рицательных бактерий.
Ингибиторы синтеза пептидогликана действуют следующим образом:
1) на образование основных компонентов, из которых строится клеточная стенка (циклосерин);
- блокируют образование димеров и их перенос к растущим цепям пептидогликана (ванкдмицин);
- ингибируют образование сшивок (пенициллины, цефалоспорины, монобактамы).
Несмотря на различие в механизме действия, у ингибиторов синтеза клеточной стенки есть и общие свойства:
препараты обладают бактерицидным действием;
не действуют на покоящиеся клетки;
не действуют на бактерии, утратившие клеточную стенку.
Ингибиторы транскрипции и репликации
Синтез нуклеиновых кислот условно делят на два этапа:
- Синтез предшественников нуклеотидов и де- зоксинуклеотидов из промежуточных продуктов метаболизма.
- Ферментативная полимеризация нуклеотидов с образованием макромолекул.
В синтезе ДНК и РНК принимают участие ДНК- зависимая АТФ-аза, гираза, специфическая РНК-по- лимераза, репликативная ДНК-полимераза, РНК-аза, лигаза.
Антибиотики, блокирующие репликацию и транскрипцию, делятся на три группы:
- ингибиторы синтеза предшественников;
- ингибиторы полимеризации;
- ингибиторы матричной функции ДНК.
Ингибиторы синтеза предшественников (антиметаболиты) — это группа природных и синтетических веществ, которая весьма гетерогенна как по своему химическому строению, так и по механизмам действия, но характерной их особенностью является то, что по структуре они часто сходны с природными метаболи-
тами, аналогами которых их считают, и взаимодействуют с ферментами, узнающими в норме природный метаболит, или исключают взаимодействие фермента с природным метаболитом.
Степень ингибирования зависит от отношения кон- центрадии аналога и природного метаболита. Этот тип ингибирования называют конкурентным. Описано много химиотерапевтических средств, в том числе и антибиотиков, которые влияют на синтез промежуточных метаболитов (ингибируют синтез нуклеиновых кислот), аминокислот (блокируют синтез пентапептида пепти- доглакана, синтез или фиксацию фолиевой кислоты) и механизмы транспорта. Так, антибиотик хлодацин является конкурентом аспарагиновой кислоты, а шов- домицин является аналогом уридина. Механизм дей-
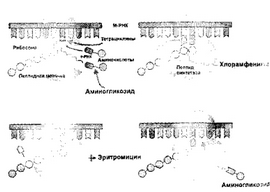
Рис.З. Механизм действия ингибиторов синтеза белка
ствия циклосерина связывают с подавлением образования пептидогликана как аналога аланина.
Ингибиторы матричной функции ДНК связываются с нуклеиновой кислотой самых разных клеток (бактерий, грибов, высших организмов), что приводит к угнетению синтеза не только ДНК, но и РНК. Такое неспецифическое действие приводит к подавлению роста любых клеток, в которые эти антибиотики способны проникать. Рубомицин и адриамицин способны встраиваться между парами двойной спирали ДНК и стабилизируют ее. Митомицин ковалентно связывается с ДНК, сшивает цепи молекул и препятствует их разделению. Актиномицин D обратимо внедряется между двумя цепочками ДНК, образуя с ней нековалентные соединения, препятствует перемещению РНК- полимеразы вдоль ДНК-матрицы и, следовательно, подавляет синтез РНК.
Ингибиторы полимеразной реакции обладают избирательным действием и блокируют только синтез РНК в растущих клетках. Они способны подавлять рост бактериальных клеток или только клеток макроорганизма. Однако временная остановка синтеза РНК не является гибельной для клеток, поэтому считается, что такие антибиотики обладают бактериостатическим действием. Механизм действия рифамицинов, толипомицинов, гало- мицинов и стрептомицина связан с ингибированием ДНК-зависимой РНК полимеразы, что позволяет их отнести к бактериостатическим антибиотикам.
Ингибиторы синтеза белка
Антибиотики, подавляющие синтез белка, составляют большую группу лекарственных веществ, используемых в медицинской практике. Условно их делят на четыре подгруппы в соответствии с тем, на какую стадию синтеза они действуют (рис. 3):
- Ингибиторы активации аминокислот и реакции переноса (в клинике эта подгруппа не применяется).
- Ингибиторы функций малых субчастиц рибосом (30S).
- Ингибиторы функции больших субчастиц рибосом (50S).
- Ингибиторы внерибосомальных факторов.
Антибиотики, взаимодействующие с ЗОЭ-субчасти-
цами рибосом, подавляют инициацию синтеза белка, блокируя акцепторный участок. К ним относятся ами- ногликозиды, тетрациклины.
Функция бОБ-субчастицы рибосом сводится к следующему: она участвует в образовании пептидной связи, предоставляя участок для связывания пептидил-т- РНК. После образования пептидной связи акцепторный участок освобождается и с ним связывается следующая т-РНК. К ингибиторам функции 50S-cy64ac- тиц относятся следующие антибиотики: пуромицин, макролиды, хлорамфеникол, линкомицин, клиндами- цин.
Ингибиторы внерибосомальных факторов нарушают функционирование растворимых факторов элонгации (EF-G, EF-2, EF-Tu), принимающих участие в синтезе белка. Стероидный антибиотик фузидиевая кислота нарушает функционирование фактора EF-G и EF-2, а киромицины. подавляют процесс элонгации, связываясь с фактором EF-Tu.
Ингибиторы функционирования клеточных мембран
Мембраны всех живых клеток от бактерий и до животных клеток состоят из сходных компонентов. Исключением являются клеточные мембраны бактерий, в которых отсутствуют стерины. Мембраны грибов и растений содержат зимостерин и эргостерин, а мембраны млекопитающих содержат холестерин.
Антибиотики, действие которых направлено на клеточные мембраны, делятся на нарушающие надмолекулярную структуру клеточной мембраны и высвобождающие внутриклеточные вещества, вызывающие аномальное накопление ионов внутри клетки.
Основной механизм действия антибиотиков, нарушающих структуру клеточной мембраны, связывают с наличием липофильных и гидрофильных участков в их химической формуле. Эти антибиотики способны встраиваться между липидами и белками мембранных структур и при этом необратимо изменяют их (поли- миксин, колистин, циркулин).
Другой механизм действия связан со способностью антибиотиков полиеновой структуры связываться со стеринами клеточных мембран (нистатин, амфоте- рицин. В) и вызывать необратимые изменения в структуре клеточных мембран.
Линейные пептидные антибиотики гражицидииы и циклический пептидный антибиотик аламетицин. способны включаться в структуру клеточной мембраны и приводят к выходу катионов из клетки, что и обусловливает гибель микроорганизмов.
Источник: Хоменко А.И., Шадурская С.К., «Антибиотики: химиотерапия инфекционных заболеваний.» 2002
А так же в разделе «Механизм действия антибиотиков »
- Общая характеристика антибиотиков
- Антибиотикорезистентность и механизмы ее развития
- Классификация антибиотиков
- Пенициллины
- Ингибиторы бета-лактамаз
- Цефалоспорины
- Монобактамы
- Карбапенемы
- Хлорамфеникол
- Аминогликозиды
- Фармакокинетика
- Макролиды и азалиды
- Линкозамины
- Фузидин-натрия
- Фосфомицин
- Фузафунжин
- Полипептиды
- Гликопептиды
- Тетрациклины
- Рифамициды (ансамициды)
- Принципы выбора антибиотиков
- Комбинированное применение антибиотиков
- ПРОТИВОГРИБКОВЫЕ СРЕДСТВА
- П РОТИ ВОП РОТОЗОЙ Н Ы Е СРЕДСТВА
- Средства, применяемые для лечения и профилактики малярии
- Препараты, препятствующие развитию приступов лихорадки
- Препараты, препятствующие развитию рецидивов
- Средства, применяемые для лечения токсоплазмоза
- Средства, применяемые для лечения амебиаза, криптоспоридоза, гиардиоза (лямблиоза), балантидиаза
- Средства, применяемые для лечения трихомониаза
- Средства, применяемые для лечения лейшманиоза
- Средства, применяемые для лечения трипаносомоза
- ПРОТИВОВИРУСНЫЕ СРЕДСТВА
- ПРИЛОЖЕНИЕ