ПРОТИВОВИРУСНЫЕ СРЕДСТВА
Это группа лекарственных средств, применяемых для профилактики и терапии вирусных инфекций. Современная вирусология описывает более 500 различных вирусов, возбудителей заболеваний человека, причем половина из них распространены повсеместно. Такая насыщенность биосферы вирусами не может не быть связанной с широким вовлечением вирусов в патологические процессы, такие как вирусные инфекции дыхательных путей, желудочно-кишечного тракта, внутренних органов, кожных покровов, слизистых оболочек.
Вирусы, поражая внутриутробно плод, приводят к развитию уродств человека. Особую группу составляют так называемые медленные вирусные инфекции, инкубационный период которых может длиться годы, и заканчиваются они тяжелыми поражениями и гибелью организма. Не снята с повестки дня и вирусная этиология злокачественных заболеваний. Широко распространены вирусные заболевания среди животных. Необходимо отметить и тот факт, что в последние годы удельный вес вирусной патологии среди общей инфекционной патологии человека возрастает.
Считается, что вирусы — облигантные внутриклеточные паразиты, не способные к самостоятельному делению. Основным условием для их существования является синтез вирусспецифических белков и формирование вирусного генома из материалов инфицированной клетки-хозяина. Любой вирус содержит защитную протеиновую или липид-протеиновую оболоч-
ку и нуклеотид. Последний может быть представлен двухцепочными молекулами ДНК или бдноцепочны- ми молекулами РНК. Как правило, защитная оболочка имеет двойной слой липидов и специфические вирусные белки. Основная функция липидов (смесь фос- фо- глико- и нейтральных липидов) - обеспечить стабилизацию структуры вируса. Белки входят в состав поверхностных структур (гликопротеины) и формируют внутренний поверхностный слой оболочки (матричные белки). В ряде вирусов содержатся ферменты — тимидинкиназа, нейраминидаза, полимеразы, протеазы, эндонуклеазы и лигазы.
Весьма условно и кратко этапы взаимодействия «вирус-хозяин» можно представить следующим образом:
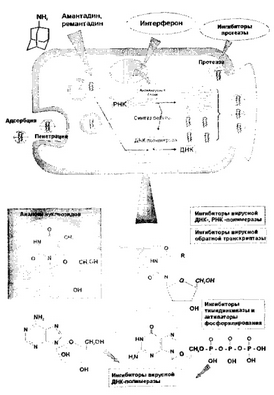
Гибель инфицированной клетки происходит из-за подавления синтеза клеточных белков, в основном это связано с дефектами трансляции мРНК, приводящими к нарушениям макромолекулярного биосинтеза, со вторичным ингибированием синтеза РНК и ДНК в клетке. На уровне структуры клеточной мембраны гликопротеины клетки замещаются вирусиндуцированны- ми белками, приводя к изменению ее проницаемости, образованию в ней дефектов, появлению лабильности к агглютинирующему действию. Изменение проницаемости лизосомальных мембран, из-за накопления токсических и повреждающих вирусных компонентов в клетке, способствует повреждению клеточных лизосом и высвобождению лизосомальных ферментов в цитоплазму клетки.
Таким образом, все биосинтетические процессы вирусов происходят в клетках макроорганизма, поэтому избирательно уничтожить вирус лекарственными средствами, при этом не повредив клетку хозяина, практически невозможно. В связи с этим к противовирусным средствам предъявляются определенные требования: они должны иметь широкий спектр противовирусной активности, низкую токсичность, хорошо проникать в мозговую ткань, не оказывать отрицательного влияния на иммунитет и в то же время подавлять размножение вируса.
Первым препаратом, предложенным в качестве специфического противовирусного средства, был тиосе- микарбазон, описанный Г. Домагк в 1946 году и открывший эру химиотерапии вирусных инфекции. В последующие годы были синтезированы метисазон (1953), идоксуридин (1959).
В основе классификации противовирусных средств лежит расположение мишеней действия противовирусных средств в зависимости от стадий вирусной репликации (рис. 5):
Амантадин (мидантан) и его метильное производное ремантадин являются трициклическими симметричными адамантаминами. Они проявляют противовирусную активность практически против всех вирусов гриппа типа А и коревой краснухи в низких концентрациях, при этом ремантадин в 6-10 раз более активен, чем амантадин.
Механизм действия производных адамантаминов связывают со взаимодействием препаратов с вирусным белком М2 гриппа А, ответственным за образование ионных каналов в липидной оболочке. Вмешиваясь в функцию белка М2, препараты блокируют кисло-связанную диссоциацию рибонуклеинового комплекса на ранних стадиях репликации и потенцируют кислотные рН- индуцированные конформационные изменения транспорта гемагглютинина на более поздних стадиях внутриклеточной репликации.
Амантадин был введен в медицинскую практику как противовирусное средство в 1964 году. Препарат проявляет профилактический эффект до заражения и на ранних стадиях гриппозной инфекции вирусом типа А. Прием препарата на фоне вирусной инфекции, вызванной вирусом типа В ослабляет токсическое действие гриппозной инфекции. Считается, что применение производных адамантаминов на ранних этапах болезни приблизительно на 50% снижает тяжесть заболевания.
Как амантадин, так и ремантадин хорошо и достаточно полно всасываются из желудочно-кишечного тракта, частично инактивируются в печени и выводятся почками.
Адапромин относится к производным адамантаминов. По своей фармакологической активности и механизмам действия близок к ремантадину. При приеме внутрь эффективен не только против вируса гриппа типа А, но и типа В.
Видарабин является аденозиновым аналогом, имеющим четвертичную структуру, аналогичную дезок- сиаденозину, где рибоза заменена на арабинозу. Отсутствие гидроксильной группы препятствует взаимодействию видарабина с другими нуклеозидами. Таким образом, встраивание видарабина во вновь синтезируемую молекулу ДНК блокирует ее дальнейший синтез. Внутри клетки видарабин под влиянием ферментов превращается в трифосфатвидарабин, который способен ингибировать активность ДНК-полимеразы. Трифосфатвидарабин, включенный в ДНК, выступает как внутриклеточный интермедиант не только вирусов, но и клеток человека. Он способен блокировать рибонукле- озидредуктазу, РНК-полиаденилазу и S-аденозилгомоцистеин гидролизу, основные ферменты реакций трансметилирования.
Препарат был введен в медицинскую практику в 1977 году как высокоэффективное средство для лечения герпеса 1 и 2-го типов, в том числе и герпетических энцефалитов. В настоящее время видарабин применяется для лечения вирусных инфекций, вызванных герпето- и альфагерпетовирусами. Используется видарабин внутривенно при энцефалитах, неонатальном герпесе и наружно при различных кератитах, ке- ратоконъюнктивитах, вызванных герпесом, варицел- ла зостер. Часто препарат комбинируют с ацикловиром. Неэффективен видарабин при инфекциях, вызванных РНК-вирусами, аденовирусами.
Производные дезоксиуридина — идоксуридин, триф- торидин, суривудин — в своей химической структуре содержат атомы галогенов. Так, идоксуридин содержит йод, трифторидин — фтор, а суривудин — бром. Для появления противовирусного эффекта эти препараты на первом этапе метаболизируются до нуклеотида и после реакции фосфорилирования вирусной тимидинкиназой включаются в синтез вирусной ДНК, встраиваясь в ДНК вируса, что приводит к образованию дефектных вирусных белков. Однако эти препараты не обладают избирательностью действия, поэтому они способны встраиваться в ДНК клеток человека.
Идоксуридин — первый и наиболее активный препарат из производных дезоксиуридина. Он вошел в историю как первое эффективное лекарственное средство для лечения герпетического кератита, ранее иногда приводившего к слепоте. Основной механизм действия связан с образованием трифосфатного производного идоксуридина, который под влиянием вирусной и клеточной тимидинкиназы встраивается не только в ДНК вируса, но и в ДНК клеток млекопитающих. Кроме того, образовавшийся на первом этапе фосфорилирования 5-монофосфат-идоксуридина снижает фосфорилирование тимидина, и при этом образуются дефектные популяции вирионов, не обладающие инфекцион- ностью.
Используется идоксуридин местно для лечения вирусных кератитов, за исключением аденовирусных. Можно также препарат применять местно для лечения генитального герпеса.
Соривудин — высокоэффективное средство против простого герпеса 1 типа, вируса Эпстайна-Барр. Соривудин блокирует синтез ДНК. Известно, что первоначальные реакции фосфорилирования зависят от активности вирусной тимидинкиназной реакции, а последующий метаболизм дифосфонатов зависит от активности вирусной темидилаткиназы. Образовавшийся в результата метаболизма соривудин-трифосфат избирательно блокирует процессы репликации вирусной ДНК, связанные с ди- окситимидин-трифосфатом. Более того, клетки, инфицированные вирусом простого герпеса 1 типа, почти в 40 раз более чувствительны к соривудину, чем неинфи- цированные клетки.
Препарат быстро и достаточно полно всасывается из желудочно-кишечного тракта, почти на 98% связывается с белками плазмы и выводится почками. Вводится соривудин внутривенно или через рот.
Трифлюридин имеет более широкий спектр противовирусной активности. Эффективен в отношении простого герпеса 1-го и 2-го типа, оспы, цитомегаловиру- сов и некоторых типов аденовирусов. Механизм антивирусной активности связан с блокадой синтеза ДНК вируса. Образовавшийся в результате метаболизма монофосфат трифлюридина необратимо ингибирует ти- мидинсинтетазу. Одновременно трифлюридин конкурентно блокирует включение тимидин-трифосфата в ДНК за счет угнетения ДНК-полимеразы.
Препарат применяется для лечения первичных герпетических или аденовирусных кератоконъюнктиви- тов и кератоувеитов, для чего используется раствор или мазь.
В результате фармакологического поиска новых препаратов, избирательно действующих на зараженные клетки, было обнаружено, что аналоги пуриновых оснований обладают выраженной противовирусной активностью. Среди препаратов, широко вошедших в клинику можно выделить ацикловир и его эстерифициро- ванное валильное производное валацикловир, фамцик- ловир, пенцикловир, ганцикловир.
Ацикловир — ациклический нуклеозидный аналог гуанозина без углеводного цикла, влияющий на вирусы простого герпеса типа 1 и 2, Эпстайна-Барра, цитомегаловируса — был синтезирован в 1974 году.
Механизм противовирусной активности ацикловира связан с блокадой синтеза вирусной ДНК и состоит из нескольких этапов. В клетке ацикловир под влиянием вирусной тимидинкиназы фосфорилируется и превращается в монофосфатное производное. При участии гуанилатциклазы клеток человека образуется ацикловирдифосфат, затем — ацикловиртрифосфат. Отмечен и тот факт, что неинфицированные клетки почти не фосфорилируют препарат, или фосфорили- руют очень мало, поэтому препарат почти не влияет на синтез ДНК в незаряженных клетках.
Аффинность тимидинкиназы вируса к ацикловиру более чем в 200 раз выше в сравнении с тимидинки- назой человека. Таким образом, ацикловир избирательно активируется в клетках, инфицированных вирусом. Трифосфат ацикловира образует комплексное соединение с эндогенным деоксигуанозинтрифосфа- том, которое способно конкурентно включаться в вирусную ДНК, в результате этого происходит торможение элонгации цепи ДНК и образование неактивного комплекса с вирусной ДНК-полймеразой, что подавляет репликацию.
При приеме внутрь до 30% от введенной дозы связывается в белками плазмы, проникает через гематоэнцефалический барьер и плацентарный барьер. Выводится почками в неизмененном виде или в виде метаболита. При местном использовании препарат не всасывается в системный кровоток, но способен проходить через эпителий роговицы, создавая терапевтическую концентрацию препарата в глазной жидкости.
Назначается при инфекциях, вызванных вирусами герпеса 1 и 2 типа, варицелла зостер, Эпстайна-Барр, в том числе и у больных с нарушениями иммунной системы. Для лечения опоясывающего герпеса, ветряной оспы, герпетического энцефалита, рецидивирующего лабиального и генитального герпеса препарат назначается внутрь, местно — для лечения герпетического кератита.
Валацикловир при приеме внутрь быстро и фактически полностью превращается в ацикловир, который после фосфорилирования приобретает антивирусную активность. Спектр антивирусной активности аналогичен ацикловиру.
Применяется для лечения опоясывающего герпеса, при герпетических инфекциях кожи, слизистых оболочек и гениталий, для профилактики цитомегалови- русной инфекции на фоне ВИЧ-инфекции и иммуно- депрессивной терапии при трансплантации органов и костного мозга.
Ганцикловир является ациклическим аналогом гуанина. Впервые его противовирусная активность была описана в 1985 году. Активен в отношении цитомега- ловирусов, обоих видов простого герпеса, Эпстайна- Барра, вирусов гепатита В.
Механизм противовирусной активности связан с блокадой синтеза вирусной ДНК. Внутри клеток, пораженных вирусом, ганцикловир фосфорилируется под влиянием клеточных ферментов. Концентрация ганцикловиртрифосфата в клетках, пораженных ци- томегаловирусом, может длительно сохраняться почти в 10 раз выше, чем в неинфицированных клетках. Ганцикловиртрифосфат конкурентно ингибирует включение деоксигуанозинтрифосфата в ДНК, прекращая элонгацию, и избирательно блокирует вирусную ДНК-полимеразу. Эти процессы интенсивнее происходят в вирусах, нежели в клетках млекопитающих.
При приеме внутрь ганцикловир медленно и неполно всасывается, поэтому более целесообразно его применять парентерально. Используется для лечения ци- томегаловирусной инфекции, в том числе и на фоне ВИЧ-инфекции. Можно применять для профилактики цитомегаловирусной инфекции после трансплантации органов и костного мозга.
Пенцикловир является ациклическим аналогом гу- анозиннуклеотида, а фамцикловир — диацетиловым эфиром пенцикловира. В организме фамцикловир трансформируется в пенцикловир.
Спектр противовирусной активности пенцикловира схож со спектром противовирусной активности ацикловира. Оба препарата эффективны против вирусов простого герпеса, Эпстайна-Барра, цитомегаловирусов, опоясывающего лишая. Механизм действия пенцикловира связывают с торможением синтеза ДНК и репликации вируса. Пенцикловир в инфицированых вирусом клетках фосфорилируется вирусной тимидин- киназой в моно— и трифосфат. Трифосфат пенцикловира конкурентно ингибирует вирусную ДНК-полимеразу. Хотя трифосфат пенцикловира намного активнее ингибирует ДНК-полимеразу в сравнении с ацик- ловиртрифосфатом, однако для создания активной концентрации препарата внутри клетки требуется более значительный период времени, чем для ацикловирт- рифосфата.
При приеме внутрь пенцикловир почти не всасывается, в то время как фамцикловир быстро и полно адсорбируется в желудочно-кишечном тракте и затем связывается с белками плазмы. Экскретируются препараты с мочой.
Рекомендуется применять эти препараты внутрь при острой герпетической инфекции, опоясывающем лишае, постгерпетических невралгиях, рецидивирующем генитальном герпесе. Длительность приема не должна превышать 7-ми дней.
Фоскарнет является натриевой солью фосформура- вьиной кислоты, активен против всех типов вируса герпеса, цитомегаловируса, гепатита. В отличие от других препаратов этой группы, фоскарнет для проявления противовирусной активности не нуждается в фосфорилировании .
Механизм действия фоскарнета связывают со способностью блокировать синтез вирусных нуклеиновых кислот и тем самым нарушать процесс репликации вируса. Препарат непосредственно взаимодействует с ДНК-полимеразой вируса герпеса или с транскриптазой вируса гепатита. Фоскарнет обратимо блокирует связывание полифосфатных групп на сайтах вирусной ДНК-полимеразы, это препятствует поступлению пирофосфатов из дезоксирибонуклеозидтрифосфата, тем самым блокируется элонгация молекулы ДНК. Фоскарнет неконкурентно блокирует расщепление пиро- фосфоната, необходимого для образования деоксинук- леотидтрифосфатов.
При приеме внутрь фоскарнет почти не всасывается, при внутривенном введении хорошо распределяется в органах и тканях.
Препарат вводится внутривенно при цитомегалови- русной инфекции, в том числе и у больных с ВИЧ- инфекцией, герпесом, гепатитом В. Особенно показано назначение фоскарнета в случаях ацикловир-резис- тентных штаммов.
Все антиретровирусные средства (зидовудин, заль- цитабин, диданозин, ставудин, ламивудин), применяемые в медицинской практике, являются аналогами 2,3-дидеоксинуклеозидов. Эти препараты имеют общий механизм противовирусной активности, связанный с ингибированием РНК-зависимой ДНК-полиме- разы (обратимой транскриптазы) ретровирусов, включая вирус иммунодефицита человека. Их механизм действия связывают с конкурентным ингибированием обратной транскриптазы и элонгации. Препараты нарушают соединение фермента РНК-полимеразы с ДНК матрицей, связывание нуклеозидтрифосфатов с ферментом и замыкание фосфодиэстеразного мостика между цепочками нуклеиновых кислот.
Зидовудин в химическом отношении является аналогом тимидина (З-азидо-З-деокситимидин), в медицинской практике используется как средство первого ряда у больных с синдромом приобретенного иммунодефицита (СПИД).
Характер действия зидовудина — вирусостатический. Являясь структурным аналогом тимидина, препарат, проникая внутрь клетки, фосфорилируется клеточной титимидинкиназой с образованием монофосфата зидовудина, а затем ди- и трифосфата зидовудина. Зидо- вудинтрифосфат конкурентно ингибирует обратную транскриптазу и препятствует включению естественного продукта тимидинтрифосфата. Встраивание зи- довудинтрифосфата останавливает рост конечных цепочек ДНК вируса, поскольку 3-азидогруппа предотвращает образование фосфорноэфирной связи. Зидови- дина монофосфат блокирует клеточную тимидинкина- зу, что вызывает резкое снижение содержания внутриклеточного тимидинтрифосфата, необходимого для образования диэфирных связей между цепочками нуклеиновых кислот.
Это действие зидовудина и обусловливает цитотоксический эффект. Кроме вируса СПИДа зидовудин эффективен против вируса гепатита. Однако при длительном приеме зидовудина (более 6-ти месяцев) отмечается развитие почти 100% резистентности штаммов ВИЧ- инфекции к препарату, связанной с мутацией в гене обратной транскриптазы.
Зидовудин быстро и почти полностью всасывается из желудочно-кишечного тракта, хорошо проникает в большинство тканей и жидкостей организма, в том числе через гематоэнцефалический барьер.
Назначается на ранних и поздних стадиях ВИЧ-инфекции с содержанием клеток CD4+ gt; 500 /мм3.
Залъцитабин - цитозиновый нуклеозидный аналог, эффективен против штаммов ВИЧ-1 и ВИЧ-2, включая и штаммы, резистентные к зидовудину. Препарат конкурентно ингибирует синтез вирусной ДНК и подавляет репликацию вируса. Зальцитабин, проникнув внутрь клетки, фосфорилируется под влиянием деок- еицитидинкиназы. Там же, в клетке, при действии других клеточных ферментов из него образуется активный метаболит - дидеоксицититина трифосфат. Образованный метаболит конкурирует с диоксицитидин- трифосфатом, в результате нарушается синтез вирусной ДНК и формирование между ее цепями фосфоди- эстеразных мостиков, необходимых для элонгации. Кроме того, дидеоксицититинтрифосфат ингибирует клеточную ДНК-полимеразу и Ь-митохондриальную ДНК-полимеразу, поэтому при его приеме возникают серьезные побочные эффекты.
6. Зак. 301
При приеме внутрь зальцитабин хорошо всасывается, быстро проникает через гематоэнцефалический барьер и обнаруживается в спинно-мозговой жидкости. Применяется зальцитабин для лечения ВИЧ-инфекции с клиническими проявлениями, в комбинации с зидо- вудином, с исходным числом CD-4+ lt; ЗОО/mm3. В качестве монотерапии используется при нечувствительности штаммов вируса ВИЧ к зидовудину.
Диданозин является пуриновым нуклеозидным аналогом (дидезоксиинозин), активен против вирусов ВИЧ- 1 и ВИЧ-2. Диффузируя внутрь клетки, диданозин первоначально метаболизируется 5-нуклеотидазой и затем другими клеточными ферментами в активный метаболит, ингибирующий вирусную обратную транскриптазу. Отсутствие 3-гидроксила делает невозможной репликацию нуклеиновых кислот, что связано с наличием акцепторной группы у 2,3-дидезоксиаденозин-5-три- фосфата, которая способствует встраиванию этого метаболита в вирусную ДНК, что приводит к обрыву цепи.
При приеме внутрь биодоступность диданозина составляет около 40%, препарат очень незначительно связывается с белками крови, хорошо проникает в органы и ткани, в том числе и через гематоэнцефалический барьер.
Применяется диданозин для лечения ВИЧ-инфекции у взрослых и детей старше 6-ти месяцев.
Ставудин в химическом отношении является цито- циннуклеозидным аналогом тимидина. Препарат активен против вирусов ВИЧ-1 и ВИЧ-2, в том числе и резистентных к зидовудину.
Основной механизм противовирусной активности связывают со способностью подавлять репликацию ви-
руса ВИЧ. Ставудин быстро проникает внутрь клетки путем диффузии. В клетке метаболизируется. На первоначальных этапах ставудин фосфорилируется клеточной тимидинкиназой. Клеточные энзимы быстро переводят монофосфат в ди- и затем в трифосфатставудина. Ставудинтрифосфат конкурентно ингибирует обратную транскриптазу и препятствует включению деокситими- динатрифосфата. В результате синтез вирусной ДНК и формирование ее цепей, необходимых для элонгации, становится невозможным. Ставудинтрифосфат вызывает определенную гепато- и нейротоксичность связанную с ингибированием клеточных (3- и у- ДНК-полимераз.
Ставудин быстро адсорбируется из желудочно-кишечного тракта, хорошо распределяется по органам и тканям, проникает через гематоэнцефалический барьер.
Используется препарат для лечения ВИЧ-инфекции, в том числе и после терапии зидовудином с исходным числом CD-4+ lt; 400/mm3.
Ламивудин является нуклеозидным аналогом ти- мидина, в котором в молекуле рибозы атом углерода заменен на серу. Препарат эффективен в отношении вирусов ВИЧ-1 и ВИЧ-2. Механизм противовирусной активности ламивудина близок к зидовудину. Препарат проникает внутрь клетки, инфицированной вирусом, под действием ферментов превращается в лами- вудинтрифосфат, активный метаболит, который подавляет активность обратной транскриптазы. Одновременно препарат способен ингибировать активность а-, [3- и у- ДНК-полимеразы клеток. В отличие от других нуклеозидных аналогов у ламивудина низкое цитотоксическое действие, поэтому при его приеме практически не было отмечено случаев периферических нейропатий.
После приема внутрь ламивудин быстро и практически полностью всасывается. В лимфоцитах периферической крови трифосфат ламивудина может находиться до 10-ти часов. Ламивудин используется для моно- и комбинированной терапии больных с ВИЧ-инфекцией.
Невирапин является ненуклеозидным ингибитором обратимой транскриптазы. Препарат активен только против вирусов ВИЧ-1. Механизм действия связывают со способностью препарата связываться необратимо с гидрофобными фрагментами обратимой транскриптазы, в регионе, отличном от места присоединения других ингибиторов обратной транскриптазы. Таким образом, штаммы ВИЧ, устойчивые к другим ингибиторам обратной транскриптазы, не проявляют перекрестной устойчивости, в то же время широкому применению невирапина препятствует очень быстрое развитие устойчивых штаммов, иногда через несколько недель после начала химиотерапии, и возникновение кожных сыпей после его приема.
Ифавиренц избирательно и неконкурентно ингибирует обратную транскриптазу вируса ВИЧ-1. Блокада обратной транскриптазы препятствует транскрипции вирусной РНК на комплементарной цепочке ДНК и встраиванию ДНК в геном клеток человека. Препарат хорошо всасывается из желудочно-кишечного тракта, хорошо распределяется по органам и тканям, способен проникать через гематоэнцефалический барьер. Как и к невирапину, к ифавиренцу быстро развивается резистентность вирусов ВИЧ-инфекции. Используется ифавиренц при комбинированной терапии ВИЧ-1 инфекции.
Ингибиторы протеаз (саквинавир, ритонавир, индинавир, нелфинавир) — это сравнительно новый класс химиотерапевтических средств, введенный в 1995 году и используемый для лечения ВИЧ-инфекции. В химическом отношении они являются синтетическими негидролизируемыми пептидами.
Механизм действия препаратов связывают с конкурентным ингибированием протеазы ВИЧ, фермента, вырезающего самого себя из большой полипептид- ной цепи и разрезающего оставшийся полипротеин- предшественник на отдельные протеины и пептиды. В протеазе у аминокислотного остатка происходит замещение аспартата на аспарагин, в клетках, инфицированных вирусом, накапливаются нерасщепленные предшественники, что приводит к появлению незрелых вирусных частиц, неспособных инфицировать другие клетки. Наиболее изучены из ингибиторов протеаз саквинавир и индинавир.
Индинавир обладает активностью против вируса ВИЧ-1. Механизм его действия заключается в способности связываться с активным центром протеазы. После приема внутрь индинавир всасывается. Биотрансформация препарата происходит в системе цитохрома Р450 печени и желудочно-кишечного тракта.
Назначается для лечения ВИЧ-1 инфекции в дозе до 0,8 г, в том числе и у больных с резистентными штаммами к препаратам-ингибиторам обратной транскриптазы.
Саквинавир — назначается больным с ВИЧ-1 инфекцией в дозе 0,6 г. Препарат хорошо переносится больными.
Нелфинавир избирательно ингибирует ВИЧ-протеа- зы у штаммов ВИЧ-1 и ВИЧ-2. Препарат быстро и хорошо всасывается из желудочно-кишечного тракта, хорошо распределяется в органах и тканях, однако через гематоэнцефалический барьер почти не проникает.
Препарат рекомендуется использовать в дозе 0,75 г больным с ВИЧ-1 инфекцией. Нелфинавир при комбинированном применении усиливает эффекты ингибиторов обратной транскриптазы, что уменьшает вероятность развития резистентных штаммов ВИЧ-инфекции.
Ритонавир по механизму противовирусной активности является ингибитором протеазы штаммов ВИЧ-1 и ВИЧ-2. В клиническую практику был введен в 1996 году. Препарат хорошо переносится больными, обычно назначается в дозе 0,6 г в комбинации с другими антиВИЧ-препаратами.
Рибавирин в химическом отношении представляет собой рибофуранозил-триазол-карбоксамид. Препарат обладает широким спектром противовирусной активности, блокирует размножение большинства ДНК- и РНК-содержащих вирусов. Поэтому он эффективен против простого герпеса, аденовирусов, микровирусов, ри- новирусов, полиовирусов, ретровирусов.
Механизм противовирусной активности рибавири- на связывают с влиянием на ранние стадии реплика- ционного цикла вируса, что приводит к блокаде синтеза вирусного антигена и синтеза РНК-вируса. Препарат ускоряет обмен нуклеотидов в клетке, ингибирует транспортную РНК-синтетазу, оказывает влияние на гуаниновую дезаминазу. В клетке рибавирин фос- форилируется, и образует рибавиринамонофосфат, который избирательно ингибирует клеточную инозин-5- фосфатдегидрогеназу, что приводит к нарушению синтеза гуанозинтрифосфата и нуклеиновых кислот. У вирусов инфлюенции рибавиринтрифосфат способен угнетать транскриптазную активность. В целом противовирусная активность рибавирина связана с блокадой гуанозинтрифосфат-зависимых ферментов.
При приеме внутрь рибавирин быстро и полностью всасывается, а при ингаляциях его концентрация в дыхательном тракте в десятки раз выше, чем при введении орально. Применяется препарат для лечения вирусных инфекций вызванных герпесом, гриппом, корью, ветряной оспой, гепатитами типа А и В, лихорадки Ласса. Как средство выбора рибавирин назначается при лечении заболеваний дыхательных путей, а в качестве препаратов второго ряда — при гриппозной инфекции. В отличие от других противовирусных препаратов, не выявлено штаммов вирусов, резистентных к рибавирину. Назначается внутрь или в виде ингаляций.
Метисазон является производным тиосемикарбазо- на. Механизм действия заключается в ингибировании синтеза «поздних» стадий сборки инфекционных ва- рионов. Препарат нарушает синтез РНК и образование поздних полисом, что приводит к нарушению процесса самосборки, и внутри клетки образуются незрелые вирусные частицы. Антивирусная активность метиса- зона выражена против ДНК-содержащих вирусов оспы человека и животных, но особенно вэффективна в отношении вируса натуральной оспы.
Метисазон применяется для экстренной профилактики оспы и для лечения кожных осложнений после прививки живой оспенной вакциной.
Вирусы, поражая внутриутробно плод, приводят к развитию уродств человека. Особую группу составляют так называемые медленные вирусные инфекции, инкубационный период которых может длиться годы, и заканчиваются они тяжелыми поражениями и гибелью организма. Не снята с повестки дня и вирусная этиология злокачественных заболеваний. Широко распространены вирусные заболевания среди животных. Необходимо отметить и тот факт, что в последние годы удельный вес вирусной патологии среди общей инфекционной патологии человека возрастает.
Считается, что вирусы — облигантные внутриклеточные паразиты, не способные к самостоятельному делению. Основным условием для их существования является синтез вирусспецифических белков и формирование вирусного генома из материалов инфицированной клетки-хозяина. Любой вирус содержит защитную протеиновую или липид-протеиновую оболоч-
ку и нуклеотид. Последний может быть представлен двухцепочными молекулами ДНК или бдноцепочны- ми молекулами РНК. Как правило, защитная оболочка имеет двойной слой липидов и специфические вирусные белки. Основная функция липидов (смесь фос- фо- глико- и нейтральных липидов) - обеспечить стабилизацию структуры вируса. Белки входят в состав поверхностных структур (гликопротеины) и формируют внутренний поверхностный слой оболочки (матричные белки). В ряде вирусов содержатся ферменты — тимидинкиназа, нейраминидаза, полимеразы, протеазы, эндонуклеазы и лигазы.
Весьма условно и кратко этапы взаимодействия «вирус-хозяин» можно представить следующим образом:
- На первом этапе репродуктивного процесса происходит адсорбция вируса на клетке через взаимодействие гликопротеиновых рецепторов вируса с поверхностными рецепторами клеток и тканей организма. После адсорбции вирус проникает в клетку хозяина (пенетрация вируса), где происходит частичная депротеинизация вириона и раздевание нукле- опротеида.
- На следующем этапе, происходящем внутри клетки хозяина, происходит синтез вирусспецифических белков из компонентов клетки, включающий несколько этапов. У РНК-содержащих вирусов синтезируются белки, а у ДНК-содержащих вирусов - нуклеиновые кислоты (транскрипция вирусных нуклеиновых кислот, трансляция варионов), синтез ферментов и регуляторных белков вируса.
- На последнем этапе репликационного цикла осуществляется полная сборка генома внутриклеточного лируса. Происходит быстрое высвобождение дочерних Ларионов из клеток, а клетка-хозяин, как правило, погибает (рис. 5).

Гибель инфицированной клетки происходит из-за подавления синтеза клеточных белков, в основном это связано с дефектами трансляции мРНК, приводящими к нарушениям макромолекулярного биосинтеза, со вторичным ингибированием синтеза РНК и ДНК в клетке. На уровне структуры клеточной мембраны гликопротеины клетки замещаются вирусиндуцированны- ми белками, приводя к изменению ее проницаемости, образованию в ней дефектов, появлению лабильности к агглютинирующему действию. Изменение проницаемости лизосомальных мембран, из-за накопления токсических и повреждающих вирусных компонентов в клетке, способствует повреждению клеточных лизосом и высвобождению лизосомальных ферментов в цитоплазму клетки.
Таким образом, все биосинтетические процессы вирусов происходят в клетках макроорганизма, поэтому избирательно уничтожить вирус лекарственными средствами, при этом не повредив клетку хозяина, практически невозможно. В связи с этим к противовирусным средствам предъявляются определенные требования: они должны иметь широкий спектр противовирусной активности, низкую токсичность, хорошо проникать в мозговую ткань, не оказывать отрицательного влияния на иммунитет и в то же время подавлять размножение вируса.
Первым препаратом, предложенным в качестве специфического противовирусного средства, был тиосе- микарбазон, описанный Г. Домагк в 1946 году и открывший эру химиотерапии вирусных инфекции. В последующие годы были синтезированы метисазон (1953), идоксуридин (1959).
В основе классификации противовирусных средств лежит расположение мишеней действия противовирусных средств в зависимости от стадий вирусной репликации (рис. 5):
- препараты, ингибирующие адсорбцию и депро- теинизацию вирусов (производные адамантана — аман- тадин, ремантадин);
- ингибиторы вирусной ДНК-полимеразы, РНК- полимеразы (видарабин, производные дезоксиуриди- на — идоксуридин, трифторидин, суривудин);
- аналоги нуклеотидов, избирательно активируемые вирусспецифической тимидинкиназой (ацикловир, валацикловир, фамцикловир, пенцикловир, ганцикло- вир, фоскарнет);
- ингибиторы обратной транскриптазы (аналоги нуклеозидов — зидовудин, залъцитабин, диданозин, ставудин, ламивудин, не нуклеозидной структуры — невирапин, ифавиренц);
- ингибиторы протеаз (саквинавир, ритонавир, индинавир, нелфинавир);
- нуклеозидные аналоги (рибавирин);
- средства, нарушающие сборку вирусных частиц (метисазон).
Амантадин (мидантан) и его метильное производное ремантадин являются трициклическими симметричными адамантаминами. Они проявляют противовирусную активность практически против всех вирусов гриппа типа А и коревой краснухи в низких концентрациях, при этом ремантадин в 6-10 раз более активен, чем амантадин.
Механизм действия производных адамантаминов связывают со взаимодействием препаратов с вирусным белком М2 гриппа А, ответственным за образование ионных каналов в липидной оболочке. Вмешиваясь в функцию белка М2, препараты блокируют кисло-связанную диссоциацию рибонуклеинового комплекса на ранних стадиях репликации и потенцируют кислотные рН- индуцированные конформационные изменения транспорта гемагглютинина на более поздних стадиях внутриклеточной репликации.
Амантадин был введен в медицинскую практику как противовирусное средство в 1964 году. Препарат проявляет профилактический эффект до заражения и на ранних стадиях гриппозной инфекции вирусом типа А. Прием препарата на фоне вирусной инфекции, вызванной вирусом типа В ослабляет токсическое действие гриппозной инфекции. Считается, что применение производных адамантаминов на ранних этапах болезни приблизительно на 50% снижает тяжесть заболевания.
Как амантадин, так и ремантадин хорошо и достаточно полно всасываются из желудочно-кишечного тракта, частично инактивируются в печени и выводятся почками.
Адапромин относится к производным адамантаминов. По своей фармакологической активности и механизмам действия близок к ремантадину. При приеме внутрь эффективен не только против вируса гриппа типа А, но и типа В.
Видарабин является аденозиновым аналогом, имеющим четвертичную структуру, аналогичную дезок- сиаденозину, где рибоза заменена на арабинозу. Отсутствие гидроксильной группы препятствует взаимодействию видарабина с другими нуклеозидами. Таким образом, встраивание видарабина во вновь синтезируемую молекулу ДНК блокирует ее дальнейший синтез. Внутри клетки видарабин под влиянием ферментов превращается в трифосфатвидарабин, который способен ингибировать активность ДНК-полимеразы. Трифосфатвидарабин, включенный в ДНК, выступает как внутриклеточный интермедиант не только вирусов, но и клеток человека. Он способен блокировать рибонукле- озидредуктазу, РНК-полиаденилазу и S-аденозилгомоцистеин гидролизу, основные ферменты реакций трансметилирования.
Препарат был введен в медицинскую практику в 1977 году как высокоэффективное средство для лечения герпеса 1 и 2-го типов, в том числе и герпетических энцефалитов. В настоящее время видарабин применяется для лечения вирусных инфекций, вызванных герпето- и альфагерпетовирусами. Используется видарабин внутривенно при энцефалитах, неонатальном герпесе и наружно при различных кератитах, ке- ратоконъюнктивитах, вызванных герпесом, варицел- ла зостер. Часто препарат комбинируют с ацикловиром. Неэффективен видарабин при инфекциях, вызванных РНК-вирусами, аденовирусами.
Производные дезоксиуридина — идоксуридин, триф- торидин, суривудин — в своей химической структуре содержат атомы галогенов. Так, идоксуридин содержит йод, трифторидин — фтор, а суривудин — бром. Для появления противовирусного эффекта эти препараты на первом этапе метаболизируются до нуклеотида и после реакции фосфорилирования вирусной тимидинкиназой включаются в синтез вирусной ДНК, встраиваясь в ДНК вируса, что приводит к образованию дефектных вирусных белков. Однако эти препараты не обладают избирательностью действия, поэтому они способны встраиваться в ДНК клеток человека.
Идоксуридин — первый и наиболее активный препарат из производных дезоксиуридина. Он вошел в историю как первое эффективное лекарственное средство для лечения герпетического кератита, ранее иногда приводившего к слепоте. Основной механизм действия связан с образованием трифосфатного производного идоксуридина, который под влиянием вирусной и клеточной тимидинкиназы встраивается не только в ДНК вируса, но и в ДНК клеток млекопитающих. Кроме того, образовавшийся на первом этапе фосфорилирования 5-монофосфат-идоксуридина снижает фосфорилирование тимидина, и при этом образуются дефектные популяции вирионов, не обладающие инфекцион- ностью.
Используется идоксуридин местно для лечения вирусных кератитов, за исключением аденовирусных. Можно также препарат применять местно для лечения генитального герпеса.
Соривудин — высокоэффективное средство против простого герпеса 1 типа, вируса Эпстайна-Барр. Соривудин блокирует синтез ДНК. Известно, что первоначальные реакции фосфорилирования зависят от активности вирусной тимидинкиназной реакции, а последующий метаболизм дифосфонатов зависит от активности вирусной темидилаткиназы. Образовавшийся в результата метаболизма соривудин-трифосфат избирательно блокирует процессы репликации вирусной ДНК, связанные с ди- окситимидин-трифосфатом. Более того, клетки, инфицированные вирусом простого герпеса 1 типа, почти в 40 раз более чувствительны к соривудину, чем неинфи- цированные клетки.
Препарат быстро и достаточно полно всасывается из желудочно-кишечного тракта, почти на 98% связывается с белками плазмы и выводится почками. Вводится соривудин внутривенно или через рот.
Трифлюридин имеет более широкий спектр противовирусной активности. Эффективен в отношении простого герпеса 1-го и 2-го типа, оспы, цитомегаловиру- сов и некоторых типов аденовирусов. Механизм антивирусной активности связан с блокадой синтеза ДНК вируса. Образовавшийся в результате метаболизма монофосфат трифлюридина необратимо ингибирует ти- мидинсинтетазу. Одновременно трифлюридин конкурентно блокирует включение тимидин-трифосфата в ДНК за счет угнетения ДНК-полимеразы.
Препарат применяется для лечения первичных герпетических или аденовирусных кератоконъюнктиви- тов и кератоувеитов, для чего используется раствор или мазь.
В результате фармакологического поиска новых препаратов, избирательно действующих на зараженные клетки, было обнаружено, что аналоги пуриновых оснований обладают выраженной противовирусной активностью. Среди препаратов, широко вошедших в клинику можно выделить ацикловир и его эстерифициро- ванное валильное производное валацикловир, фамцик- ловир, пенцикловир, ганцикловир.
Ацикловир — ациклический нуклеозидный аналог гуанозина без углеводного цикла, влияющий на вирусы простого герпеса типа 1 и 2, Эпстайна-Барра, цитомегаловируса — был синтезирован в 1974 году.
Механизм противовирусной активности ацикловира связан с блокадой синтеза вирусной ДНК и состоит из нескольких этапов. В клетке ацикловир под влиянием вирусной тимидинкиназы фосфорилируется и превращается в монофосфатное производное. При участии гуанилатциклазы клеток человека образуется ацикловирдифосфат, затем — ацикловиртрифосфат. Отмечен и тот факт, что неинфицированные клетки почти не фосфорилируют препарат, или фосфорили- руют очень мало, поэтому препарат почти не влияет на синтез ДНК в незаряженных клетках.
Аффинность тимидинкиназы вируса к ацикловиру более чем в 200 раз выше в сравнении с тимидинки- назой человека. Таким образом, ацикловир избирательно активируется в клетках, инфицированных вирусом. Трифосфат ацикловира образует комплексное соединение с эндогенным деоксигуанозинтрифосфа- том, которое способно конкурентно включаться в вирусную ДНК, в результате этого происходит торможение элонгации цепи ДНК и образование неактивного комплекса с вирусной ДНК-полймеразой, что подавляет репликацию.
При приеме внутрь до 30% от введенной дозы связывается в белками плазмы, проникает через гематоэнцефалический барьер и плацентарный барьер. Выводится почками в неизмененном виде или в виде метаболита. При местном использовании препарат не всасывается в системный кровоток, но способен проходить через эпителий роговицы, создавая терапевтическую концентрацию препарата в глазной жидкости.
Назначается при инфекциях, вызванных вирусами герпеса 1 и 2 типа, варицелла зостер, Эпстайна-Барр, в том числе и у больных с нарушениями иммунной системы. Для лечения опоясывающего герпеса, ветряной оспы, герпетического энцефалита, рецидивирующего лабиального и генитального герпеса препарат назначается внутрь, местно — для лечения герпетического кератита.
Валацикловир при приеме внутрь быстро и фактически полностью превращается в ацикловир, который после фосфорилирования приобретает антивирусную активность. Спектр антивирусной активности аналогичен ацикловиру.
Применяется для лечения опоясывающего герпеса, при герпетических инфекциях кожи, слизистых оболочек и гениталий, для профилактики цитомегалови- русной инфекции на фоне ВИЧ-инфекции и иммуно- депрессивной терапии при трансплантации органов и костного мозга.
Ганцикловир является ациклическим аналогом гуанина. Впервые его противовирусная активность была описана в 1985 году. Активен в отношении цитомега- ловирусов, обоих видов простого герпеса, Эпстайна- Барра, вирусов гепатита В.
Механизм противовирусной активности связан с блокадой синтеза вирусной ДНК. Внутри клеток, пораженных вирусом, ганцикловир фосфорилируется под влиянием клеточных ферментов. Концентрация ганцикловиртрифосфата в клетках, пораженных ци- томегаловирусом, может длительно сохраняться почти в 10 раз выше, чем в неинфицированных клетках. Ганцикловиртрифосфат конкурентно ингибирует включение деоксигуанозинтрифосфата в ДНК, прекращая элонгацию, и избирательно блокирует вирусную ДНК-полимеразу. Эти процессы интенсивнее происходят в вирусах, нежели в клетках млекопитающих.
При приеме внутрь ганцикловир медленно и неполно всасывается, поэтому более целесообразно его применять парентерально. Используется для лечения ци- томегаловирусной инфекции, в том числе и на фоне ВИЧ-инфекции. Можно применять для профилактики цитомегаловирусной инфекции после трансплантации органов и костного мозга.
Пенцикловир является ациклическим аналогом гу- анозиннуклеотида, а фамцикловир — диацетиловым эфиром пенцикловира. В организме фамцикловир трансформируется в пенцикловир.
Спектр противовирусной активности пенцикловира схож со спектром противовирусной активности ацикловира. Оба препарата эффективны против вирусов простого герпеса, Эпстайна-Барра, цитомегаловирусов, опоясывающего лишая. Механизм действия пенцикловира связывают с торможением синтеза ДНК и репликации вируса. Пенцикловир в инфицированых вирусом клетках фосфорилируется вирусной тимидин- киназой в моно— и трифосфат. Трифосфат пенцикловира конкурентно ингибирует вирусную ДНК-полимеразу. Хотя трифосфат пенцикловира намного активнее ингибирует ДНК-полимеразу в сравнении с ацик- ловиртрифосфатом, однако для создания активной концентрации препарата внутри клетки требуется более значительный период времени, чем для ацикловирт- рифосфата.
При приеме внутрь пенцикловир почти не всасывается, в то время как фамцикловир быстро и полно адсорбируется в желудочно-кишечном тракте и затем связывается с белками плазмы. Экскретируются препараты с мочой.
Рекомендуется применять эти препараты внутрь при острой герпетической инфекции, опоясывающем лишае, постгерпетических невралгиях, рецидивирующем генитальном герпесе. Длительность приема не должна превышать 7-ми дней.
Фоскарнет является натриевой солью фосформура- вьиной кислоты, активен против всех типов вируса герпеса, цитомегаловируса, гепатита. В отличие от других препаратов этой группы, фоскарнет для проявления противовирусной активности не нуждается в фосфорилировании .
Механизм действия фоскарнета связывают со способностью блокировать синтез вирусных нуклеиновых кислот и тем самым нарушать процесс репликации вируса. Препарат непосредственно взаимодействует с ДНК-полимеразой вируса герпеса или с транскриптазой вируса гепатита. Фоскарнет обратимо блокирует связывание полифосфатных групп на сайтах вирусной ДНК-полимеразы, это препятствует поступлению пирофосфатов из дезоксирибонуклеозидтрифосфата, тем самым блокируется элонгация молекулы ДНК. Фоскарнет неконкурентно блокирует расщепление пиро- фосфоната, необходимого для образования деоксинук- леотидтрифосфатов.
При приеме внутрь фоскарнет почти не всасывается, при внутривенном введении хорошо распределяется в органах и тканях.
Препарат вводится внутривенно при цитомегалови- русной инфекции, в том числе и у больных с ВИЧ- инфекцией, герпесом, гепатитом В. Особенно показано назначение фоскарнета в случаях ацикловир-резис- тентных штаммов.
Все антиретровирусные средства (зидовудин, заль- цитабин, диданозин, ставудин, ламивудин), применяемые в медицинской практике, являются аналогами 2,3-дидеоксинуклеозидов. Эти препараты имеют общий механизм противовирусной активности, связанный с ингибированием РНК-зависимой ДНК-полиме- разы (обратимой транскриптазы) ретровирусов, включая вирус иммунодефицита человека. Их механизм действия связывают с конкурентным ингибированием обратной транскриптазы и элонгации. Препараты нарушают соединение фермента РНК-полимеразы с ДНК матрицей, связывание нуклеозидтрифосфатов с ферментом и замыкание фосфодиэстеразного мостика между цепочками нуклеиновых кислот.
Зидовудин в химическом отношении является аналогом тимидина (З-азидо-З-деокситимидин), в медицинской практике используется как средство первого ряда у больных с синдромом приобретенного иммунодефицита (СПИД).
Характер действия зидовудина — вирусостатический. Являясь структурным аналогом тимидина, препарат, проникая внутрь клетки, фосфорилируется клеточной титимидинкиназой с образованием монофосфата зидовудина, а затем ди- и трифосфата зидовудина. Зидо- вудинтрифосфат конкурентно ингибирует обратную транскриптазу и препятствует включению естественного продукта тимидинтрифосфата. Встраивание зи- довудинтрифосфата останавливает рост конечных цепочек ДНК вируса, поскольку 3-азидогруппа предотвращает образование фосфорноэфирной связи. Зидови- дина монофосфат блокирует клеточную тимидинкина- зу, что вызывает резкое снижение содержания внутриклеточного тимидинтрифосфата, необходимого для образования диэфирных связей между цепочками нуклеиновых кислот.
Это действие зидовудина и обусловливает цитотоксический эффект. Кроме вируса СПИДа зидовудин эффективен против вируса гепатита. Однако при длительном приеме зидовудина (более 6-ти месяцев) отмечается развитие почти 100% резистентности штаммов ВИЧ- инфекции к препарату, связанной с мутацией в гене обратной транскриптазы.
Зидовудин быстро и почти полностью всасывается из желудочно-кишечного тракта, хорошо проникает в большинство тканей и жидкостей организма, в том числе через гематоэнцефалический барьер.
Назначается на ранних и поздних стадиях ВИЧ-инфекции с содержанием клеток CD4+ gt; 500 /мм3.
Залъцитабин - цитозиновый нуклеозидный аналог, эффективен против штаммов ВИЧ-1 и ВИЧ-2, включая и штаммы, резистентные к зидовудину. Препарат конкурентно ингибирует синтез вирусной ДНК и подавляет репликацию вируса. Зальцитабин, проникнув внутрь клетки, фосфорилируется под влиянием деок- еицитидинкиназы. Там же, в клетке, при действии других клеточных ферментов из него образуется активный метаболит - дидеоксицититина трифосфат. Образованный метаболит конкурирует с диоксицитидин- трифосфатом, в результате нарушается синтез вирусной ДНК и формирование между ее цепями фосфоди- эстеразных мостиков, необходимых для элонгации. Кроме того, дидеоксицититинтрифосфат ингибирует клеточную ДНК-полимеразу и Ь-митохондриальную ДНК-полимеразу, поэтому при его приеме возникают серьезные побочные эффекты.
6. Зак. 301
При приеме внутрь зальцитабин хорошо всасывается, быстро проникает через гематоэнцефалический барьер и обнаруживается в спинно-мозговой жидкости. Применяется зальцитабин для лечения ВИЧ-инфекции с клиническими проявлениями, в комбинации с зидо- вудином, с исходным числом CD-4+ lt; ЗОО/mm3. В качестве монотерапии используется при нечувствительности штаммов вируса ВИЧ к зидовудину.
Диданозин является пуриновым нуклеозидным аналогом (дидезоксиинозин), активен против вирусов ВИЧ- 1 и ВИЧ-2. Диффузируя внутрь клетки, диданозин первоначально метаболизируется 5-нуклеотидазой и затем другими клеточными ферментами в активный метаболит, ингибирующий вирусную обратную транскриптазу. Отсутствие 3-гидроксила делает невозможной репликацию нуклеиновых кислот, что связано с наличием акцепторной группы у 2,3-дидезоксиаденозин-5-три- фосфата, которая способствует встраиванию этого метаболита в вирусную ДНК, что приводит к обрыву цепи.
- дидезоксиаденозин-5-трифосфат блокирует активность клеточной и митохондриальной ДНК-полимера- зы, с чем и связано его цитотоксическое действие.
При приеме внутрь биодоступность диданозина составляет около 40%, препарат очень незначительно связывается с белками крови, хорошо проникает в органы и ткани, в том числе и через гематоэнцефалический барьер.
Применяется диданозин для лечения ВИЧ-инфекции у взрослых и детей старше 6-ти месяцев.
Ставудин в химическом отношении является цито- циннуклеозидным аналогом тимидина. Препарат активен против вирусов ВИЧ-1 и ВИЧ-2, в том числе и резистентных к зидовудину.
Основной механизм противовирусной активности связывают со способностью подавлять репликацию ви-
руса ВИЧ. Ставудин быстро проникает внутрь клетки путем диффузии. В клетке метаболизируется. На первоначальных этапах ставудин фосфорилируется клеточной тимидинкиназой. Клеточные энзимы быстро переводят монофосфат в ди- и затем в трифосфатставудина. Ставудинтрифосфат конкурентно ингибирует обратную транскриптазу и препятствует включению деокситими- динатрифосфата. В результате синтез вирусной ДНК и формирование ее цепей, необходимых для элонгации, становится невозможным. Ставудинтрифосфат вызывает определенную гепато- и нейротоксичность связанную с ингибированием клеточных (3- и у- ДНК-полимераз.
Ставудин быстро адсорбируется из желудочно-кишечного тракта, хорошо распределяется по органам и тканям, проникает через гематоэнцефалический барьер.
Используется препарат для лечения ВИЧ-инфекции, в том числе и после терапии зидовудином с исходным числом CD-4+ lt; 400/mm3.
Ламивудин является нуклеозидным аналогом ти- мидина, в котором в молекуле рибозы атом углерода заменен на серу. Препарат эффективен в отношении вирусов ВИЧ-1 и ВИЧ-2. Механизм противовирусной активности ламивудина близок к зидовудину. Препарат проникает внутрь клетки, инфицированной вирусом, под действием ферментов превращается в лами- вудинтрифосфат, активный метаболит, который подавляет активность обратной транскриптазы. Одновременно препарат способен ингибировать активность а-, [3- и у- ДНК-полимеразы клеток. В отличие от других нуклеозидных аналогов у ламивудина низкое цитотоксическое действие, поэтому при его приеме практически не было отмечено случаев периферических нейропатий.
После приема внутрь ламивудин быстро и практически полностью всасывается. В лимфоцитах периферической крови трифосфат ламивудина может находиться до 10-ти часов. Ламивудин используется для моно- и комбинированной терапии больных с ВИЧ-инфекцией.
Невирапин является ненуклеозидным ингибитором обратимой транскриптазы. Препарат активен только против вирусов ВИЧ-1. Механизм действия связывают со способностью препарата связываться необратимо с гидрофобными фрагментами обратимой транскриптазы, в регионе, отличном от места присоединения других ингибиторов обратной транскриптазы. Таким образом, штаммы ВИЧ, устойчивые к другим ингибиторам обратной транскриптазы, не проявляют перекрестной устойчивости, в то же время широкому применению невирапина препятствует очень быстрое развитие устойчивых штаммов, иногда через несколько недель после начала химиотерапии, и возникновение кожных сыпей после его приема.
Ифавиренц избирательно и неконкурентно ингибирует обратную транскриптазу вируса ВИЧ-1. Блокада обратной транскриптазы препятствует транскрипции вирусной РНК на комплементарной цепочке ДНК и встраиванию ДНК в геном клеток человека. Препарат хорошо всасывается из желудочно-кишечного тракта, хорошо распределяется по органам и тканям, способен проникать через гематоэнцефалический барьер. Как и к невирапину, к ифавиренцу быстро развивается резистентность вирусов ВИЧ-инфекции. Используется ифавиренц при комбинированной терапии ВИЧ-1 инфекции.
Ингибиторы протеаз (саквинавир, ритонавир, индинавир, нелфинавир) — это сравнительно новый класс химиотерапевтических средств, введенный в 1995 году и используемый для лечения ВИЧ-инфекции. В химическом отношении они являются синтетическими негидролизируемыми пептидами.
Механизм действия препаратов связывают с конкурентным ингибированием протеазы ВИЧ, фермента, вырезающего самого себя из большой полипептид- ной цепи и разрезающего оставшийся полипротеин- предшественник на отдельные протеины и пептиды. В протеазе у аминокислотного остатка происходит замещение аспартата на аспарагин, в клетках, инфицированных вирусом, накапливаются нерасщепленные предшественники, что приводит к появлению незрелых вирусных частиц, неспособных инфицировать другие клетки. Наиболее изучены из ингибиторов протеаз саквинавир и индинавир.
Индинавир обладает активностью против вируса ВИЧ-1. Механизм его действия заключается в способности связываться с активным центром протеазы. После приема внутрь индинавир всасывается. Биотрансформация препарата происходит в системе цитохрома Р450 печени и желудочно-кишечного тракта.
Назначается для лечения ВИЧ-1 инфекции в дозе до 0,8 г, в том числе и у больных с резистентными штаммами к препаратам-ингибиторам обратной транскриптазы.
Саквинавир — назначается больным с ВИЧ-1 инфекцией в дозе 0,6 г. Препарат хорошо переносится больными.
Нелфинавир избирательно ингибирует ВИЧ-протеа- зы у штаммов ВИЧ-1 и ВИЧ-2. Препарат быстро и хорошо всасывается из желудочно-кишечного тракта, хорошо распределяется в органах и тканях, однако через гематоэнцефалический барьер почти не проникает.
Препарат рекомендуется использовать в дозе 0,75 г больным с ВИЧ-1 инфекцией. Нелфинавир при комбинированном применении усиливает эффекты ингибиторов обратной транскриптазы, что уменьшает вероятность развития резистентных штаммов ВИЧ-инфекции.
Ритонавир по механизму противовирусной активности является ингибитором протеазы штаммов ВИЧ-1 и ВИЧ-2. В клиническую практику был введен в 1996 году. Препарат хорошо переносится больными, обычно назначается в дозе 0,6 г в комбинации с другими антиВИЧ-препаратами.
Рибавирин в химическом отношении представляет собой рибофуранозил-триазол-карбоксамид. Препарат обладает широким спектром противовирусной активности, блокирует размножение большинства ДНК- и РНК-содержащих вирусов. Поэтому он эффективен против простого герпеса, аденовирусов, микровирусов, ри- новирусов, полиовирусов, ретровирусов.
Механизм противовирусной активности рибавири- на связывают с влиянием на ранние стадии реплика- ционного цикла вируса, что приводит к блокаде синтеза вирусного антигена и синтеза РНК-вируса. Препарат ускоряет обмен нуклеотидов в клетке, ингибирует транспортную РНК-синтетазу, оказывает влияние на гуаниновую дезаминазу. В клетке рибавирин фос- форилируется, и образует рибавиринамонофосфат, который избирательно ингибирует клеточную инозин-5- фосфатдегидрогеназу, что приводит к нарушению синтеза гуанозинтрифосфата и нуклеиновых кислот. У вирусов инфлюенции рибавиринтрифосфат способен угнетать транскриптазную активность. В целом противовирусная активность рибавирина связана с блокадой гуанозинтрифосфат-зависимых ферментов.
При приеме внутрь рибавирин быстро и полностью всасывается, а при ингаляциях его концентрация в дыхательном тракте в десятки раз выше, чем при введении орально. Применяется препарат для лечения вирусных инфекций вызванных герпесом, гриппом, корью, ветряной оспой, гепатитами типа А и В, лихорадки Ласса. Как средство выбора рибавирин назначается при лечении заболеваний дыхательных путей, а в качестве препаратов второго ряда — при гриппозной инфекции. В отличие от других противовирусных препаратов, не выявлено штаммов вирусов, резистентных к рибавирину. Назначается внутрь или в виде ингаляций.
Метисазон является производным тиосемикарбазо- на. Механизм действия заключается в ингибировании синтеза «поздних» стадий сборки инфекционных ва- рионов. Препарат нарушает синтез РНК и образование поздних полисом, что приводит к нарушению процесса самосборки, и внутри клетки образуются незрелые вирусные частицы. Антивирусная активность метиса- зона выражена против ДНК-содержащих вирусов оспы человека и животных, но особенно вэффективна в отношении вируса натуральной оспы.
Метисазон применяется для экстренной профилактики оспы и для лечения кожных осложнений после прививки живой оспенной вакциной.
Источник: Хоменко А.И., Шадурская С.К., «Антибиотики: химиотерапия инфекционных заболеваний.» 2002
А так же в разделе « ПРОТИВОВИРУСНЫЕ СРЕДСТВА »
- Общая характеристика антибиотиков
- Антибиотикорезистентность и механизмы ее развития
- Механизм действия антибиотиков
- Классификация антибиотиков
- Пенициллины
- Ингибиторы бета-лактамаз
- Цефалоспорины
- Монобактамы
- Карбапенемы
- Хлорамфеникол
- Аминогликозиды
- Фармакокинетика
- Макролиды и азалиды
- Линкозамины
- Фузидин-натрия
- Фосфомицин
- Фузафунжин
- Полипептиды
- Гликопептиды
- Тетрациклины
- Рифамициды (ансамициды)
- Принципы выбора антибиотиков
- Комбинированное применение антибиотиков
- ПРОТИВОГРИБКОВЫЕ СРЕДСТВА
- П РОТИ ВОП РОТОЗОЙ Н Ы Е СРЕДСТВА
- Средства, применяемые для лечения и профилактики малярии
- Препараты, препятствующие развитию приступов лихорадки
- Препараты, препятствующие развитию рецидивов
- Средства, применяемые для лечения токсоплазмоза
- Средства, применяемые для лечения амебиаза, криптоспоридоза, гиардиоза (лямблиоза), балантидиаза
- Средства, применяемые для лечения трихомониаза
- Средства, применяемые для лечения лейшманиоза
- Средства, применяемые для лечения трипаносомоза
- ПРИЛОЖЕНИЕ