Данные международной статистики свидетельствуют, что между показателями частоты рака шейки матки и рака эндометрия (РЭ) существует обратная корреляционная связь. Первый доминирует в развивающихся странах, а второй — в западных странах с высоким уровнем социально-экономического развития. РЭ у женщин в более старших
возрастных группах, преимущественно после менопаузы, встречается чаще, чем РШМ. В Европе и Северной Америке в среднем ежегодно регистрируется около 15 новых случаев РЭ на 100 000 женского населения. В РФ частота РЭ за последнее десятилетие увеличилась и достигла 14 случаев на 100 000 населения, превысив частоту РШМ.
В конце 60-х и начале 70-х годов XX века в США было отмечено активное использование гормональных препаратов женщинами в постменопаузальном периоде. В последующие годы неожиданно обнаружилось увеличение частоты РЭ. Это событие послужило толчком к решению проблемы.


Целевые установки
Этиология и патогенетические варианты
Многолетние исследования ученых позволили конкретизировать представление о раке эндометрия как об одной из наиболее ярко выраженных гормонозависимых опухолей человека. В последние годы сформулирована «эндокринно-метаболическая концепция» патогенеза РЭ и выделено два основных патогенетических его варианта (Я.В. Бохман).
- (гормонозависимый) патогенетический вариант РЭ наблюдается у 60—70% пациентов и характеризуется выраженными проявлениями хронической гиперэстрогении в сочетании с нарушениями жирового и углеводного обмена. Симптомы: нарушение менструальной и детородной функций, ановуляторные маточные кровотечения, бесплодие, позднее наступление менопаузы. Морфологические изменения:
гиперплазия текаткани яичников, синдром Штейна—Левенталя, гиперпластические процессы в эндометрии с очагами атипической пролиферации, миома матки. В механизме развития гиперпластических процессов основным звеном является нарушение овуляции. Независимо от причин ановуляции (персистенция фолликула или его атре- зия) последовательность изменений в эндометрии одинакова. При атрезии фолликулов последние, не созрев, подвергаются регрессии, что сопровождается снижением уровня эстрогенов. В ответ на это происходит повышение секреции гонадотропинов, которые стимулируют рост новых фолликулов, что вновь приводит к повышению уровня эстрогенов в организме. Таким образом происходит волнообразная длительная секреция на относительно высоком уровне, что приводит к вышеописанным морфологическим изменениям. Новыми исследованиями установлено, что по мере нарастания гиперпластических процессов увеличивается масса апудоцитов, вырабатывающих биогенные амины и пептидные гормоны (норадреналин, мелатонин, хорионический гонадотропин и др.). Последние способствуют развитию паранеопластического эндокринно-обменного синдрома, присущего первому варианту РЭ. Обменные нарушения сводятся к ожирению, сахарному диабету и гипертонической болезни.
- (автономный) патогенетический вариант РЭ выявляют у 30—40% больных. Эндокринно-обменные нарушения отсутствуют или выражены слабо. Характерно сочетание фиброза стромы яичников и атрофии эндометрия, на фоне которых возникают полипы, очаги атипической пролиферации и рака.
Значительные колебания показателей заболеваемости РЭ в разных регионах указывают на то, что в развитии эндокринных нарушений и продолжающейся тенденции к увеличению частоты РЭ важную роль играют факторы питания и образа жизни.
Таблица 8
Сравнительные признвки патогенетических вариантов РЭ
|
Признаки |
I вариант |
II вариант |
|
Менструальная функция |
по типу ановуляторных маточных кровотечений |
не нарушена |
|
Детородная функция |
снижена, бесплодие |
не нарушена |
|
Менопауза |
обычно после 50 лет |
до 50 лет |
|
Тип кольпомикроскопи- ческой реакции |
эстрогенный |
атрофический |
|
Признаки |
I вариант |
II вариант |
|
Состояние яичников |
гиперплазия текаткани, синдром Штейна— Левенталя, феминизирующие опухоли |
фиброз |
|
Фон эндометрия |
гиперпластический |
атрофический |
|
Изменения миометрия |
фибромиома |
нет |
|
Эндокринно- |
ожирение, гиперлипи- |
четко не выражены |
|
метаболические нарушения |
демия, сахарный диабет |
|
|
Т-система иммунитета |
не изменена |
выраженная депрессия |
|
Продолжительность заболевания |
длительная |
короткая |
|
Степень дифференцировки опухоли |
высокая (Gl, G2) |
снижена (G3, G4) |
|
Чувствительность к про- гестагенам |
высокая |
невысокая |
|
Множественные опу- |
яичники, молочная |
не характерны |
|
ХОЛИ |
железа, толстая кишка |
|
|
Прогноз |
благоприятный |
менее благоприятный |
Патологическая анатомия
Гиперплазию и полипы эндометрия многие специалисты относят к предраковым состояниям, хотя вопрос о связи их с РЭ до сих пор остается спорным. При микроскопии может быть выявлена гиперплазия как желез, так и стромы. Пролиферативные изменения бывает трудно отличить от рака эндометрия.
РЭ может исходить из любой части полости матки. На ранних стадиях развития рост карциномы идет преимущественно в сторону полости матки. По мере развития заболевания в процесс вовлекается и миометрий, позднее — серозная оболочка, затем соседние органы малого таза, цервикальный канал и верхняя половина влагалища.
РЭ характеризуется высокой частотой лимфогенного метастази- рования при переходе опухоли на цервикальный канал. Регионарные метастазы развиваются и при расположении опухоли в верхней части матки. Риск последних повышается при II патогенетическом варианте РЭ с низкой степенью дифференцировки опухоли.
Гистологически РЭ является аденокарциномой разной степени дифференцировки. В некоторых случаях имеет место плоскоклеточная метаплазия. Этот тип опухоли известен как аденоакантома.
Саркома матки встречается редко. Она может развиваться из предшествующей лейомиомы или из мезодермальных тканей, входящих в структуру тела матки.
Диагностика
В большинстве случаев основной симптом заболевания — маточные кровотечения — проявляется на фоне менопаузы. Лейкорея часто оказывается малозаметным проявлением РЭ.
Возможно появление болей на первых этапах развития опухоли. Схваткообразные боли обычно связаны со стенозированием шеечного канала, скоплениями выделений в полости матки. В запущенных случаях болевой синдром обусловлен сдавлением запирательного или седалищного нерва, мочеточников лимфогенными метастазами или инфильтратами.
Увеличение и фиксация тела матки, обусловленные инфильтрацией параметральной клетчатки, наблюдаются при распространенных опухолях. Фракционный юоретаж полости матки, представляющий собой раздельное получение материала со всех частей полости матки и цервикального канала, является эффективным методом диагностики заболеваний эндометрия. Кюретаж следует выполнять периодически у женщин, относящихся к группе риска, с нарушениями менструального цикла, кровотечениями в менопаузе. Цитологические исследования выделений обычно малорезультативны, поскольку клеточные элементы уже лизированы. Более полезным является получение аспирата или промывных вод из полости матки для цитологического исследования.
Гистерография позволяет уточнить локализацию и распространенность поражения, если выполнение кюретажа невозможно. Ультрасонография и специальная вагинальная ультрасонография, особенно у тучных женщин, успешно применяются для стадирования процесса.
Таблица 9
Классификация рака эндометрия по системе TNM и стадиям (FIGO)
|
TNM- категории |
Стадии FIGO |
Описательные признаки |
|
т X |
|
Первичная опухоль не определяется |
|
То |
|
Первичная опухоль не доказана |
|
т. IS |
0 |
Carcinoma in situ |
|
Т, |
I |
Опухоль ограничена телом матки |
|
TNM- категории |
Стадии FIGO |
Описательные признаки |
|
т, 1а |
IA |
Опухоль ограничена эндометрием |
|
т 1 1Ь |
IB |
Инвазия менее 1/2 миометрия |
|
Т1е |
1C |
Инвазия более 1/2 миометрия |
|
Т2 |
II |
Опухоль распространяется на шейку, но не выходит за пределы матки |
|
|
ПА |
Вовлечение в процесс только желез эндоцервикса |
|
|
ПВ |
Инвазия стромы шейки |
|
Т3 |
III |
Местное и/или регионарное распространение соответ- |
|
и/или N, |
|
ствующего FIGO ША, В, С |
|
Т, За |
ША |
Опухоль прорастает серозную оболочку и/или придатки и/или положительные перитонеальные цитограммы |
|
|
ШВ |
Прорастание стенок влагалища |
|
N, |
1C |
Метастатическое поражение тазовых или парааорталь- ных лимфоузлов |
|
т4 |
IVA |
Опухоль прорастает слизистую оболочку мочевого пузыря и/или кишки |
|
м, |
IVA |
Отдаленные метастазы |
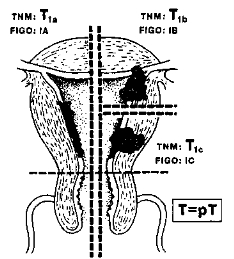
Рис. 25. Стадии рака эндометрия. Иллюстрация поражений, ограниченных маткой
Лечение
Выбор методов лечения РЭ зависит от стадии заболевания, патогенетического варианта и состояния больной.
Абдоминальная гистерэктомия с билатеральной сальпингоовариэк- томией является методом выбора при Т и Т,. Расширенную гистерэктомию по Вертгейму (с сальпингоовариэктомией, удалением параме- тральных и подвздошных лимфатических узлов) рекомендуют для Т .
Комбинированное лечение (операция + предоперационное или послеоперационное облучение). Предоперационное облучение снижает риск развития местных рецидивов и появления отдаленных метастазов. Радиотерапия предполагает внутриполостное введение радиоактивных аппликаторов или проведение дистанционной гамма-терапии. Послеоперационное облучение включает интравагинальную радиотерапию и дистанционную гамма-терапию на параметральную зону.
Сочетанная лучевая терапия. Этот метод используют при наличии неоперабельных опухолей, хотя он может быть применен и в более ранних стадиях, когда операция противопоказана.
Гормонотерапия. Наиболее чувствительными к прогестагенам являются больные РЭ I патогенетического варианта. Надежным критерием чувствительности опухоли к гормональному лечению является определение эстрогенных рецепторов и прогестерона. Обычно прогестагены (провера, депо-провера, мегейс) и антиэстрогены (та- моксифен, зитазониум и др.) применяют для паллиативного лечения распространенных опухолей или в качестве компонентов комбинированной терапии.
Химиотерапия пока ограниченно применяется в лечении РЭ. По данным ряда авторов, поиск вариантов сочетания химио- и гормонотерапии является весьма перспективным.
Прогноз
Способность к агрессивному росту и диссеминации при I патогенетическом варианте РЭ низкая, поэтому прогноз довольно хороший. Пятилетняя выживаемость при Tjs и Т составляет 90%. При вовлечении в процесс миометрия этот показатель снижается до 70%, а при распространении на шейку — до 50%.
- Хориокарцинома
Хориокарцинома (ХК) — сравнительно редкая опухоль, развивающаяся из эмбриональных ворсинок хориона. В матке ХК развивается чаще всего, но могут быть и другие места первичного роста.
Возраст больных ХК — преимущественно до 35 лет. Актуальность проблемы обусловлена не только поражением женщин молодого возраста, но и весьма агрессивным течением, ассоциирующимся с беременностью.
Эксперты ВОЗ (Женева, 1985) полагают, что на 1000 родов приходится 1 пузырный занос (ПЗ). В мире при ежегодном рождении 126 млн детей можно ожидать 126 000 случаев пузырного заноса, хотя фактическое число значительно больше. Приблизительно у 2 из 100 000 женщин после родов, а также после абортов возникает ХК. Число заболеваний в европейских странах в 30—40 раз меньше, чем в азиатских. Высокая частота развития ХК отмечается в Китае и Индонезии.
Несмотря на то что ряд проблем лечения трофобластической болезни решен и выживаемость после него может достичь 90%, вопросы своевременной диагностики продолжают оставаться актуальными и требуют привлечения особого внимания гинекологов.


Целевые установки
Этиология и патогенез
Развитие ХК непосредственно связано с предшествующей беременностью. В патогенезе ХК играет роль не только ее исход, но и сущность — была ли она изначально нормальной (роды, аборт, выкидыш) или патологической (пузырный занос, эктопическая беременность).
В рамках современной концепции патологических состояний трофобласта рассматриваются простой, пролиферирующий, инвазивный пузырный занос и ХК как последовательная цепь взаимосвязанных заболеваний, входящих в понятие «трофобластическая болезнь». Развитие ХК после нормальной, на первый взгляд, беременности протекает наименее благоприятно, а пятилетняя выживаемость наиболее низкая.
Различия клинического течения, географического распространения ТБ да и самих причин заболевания отдельные авторы объясняют:
- неполноценностью питания (дефицит белка);
- перенесенными инфекционно-вирусными заболеваниями;
- снижением выработки уровня эстрогенов в организме матери;
- иммунодефицитными состояниями и др.
Однако так или иначе частота заболеваемости ТБ выше в развивающихся странах, где высока фертильность — большое число родов с короткими интервалами между ними, что нередко сопровождается иммунодефицитом.
Принято выделять несколько категорий риска ТБ. Возраст наступления беременности — один из критериев риска пузырного заноса. Низкий риск ПЗ в возрастной группе 20—25 лет, несколько выше — в группе 15—20 лет; риск резко возрастает после 35 лет. Риск развития ХК, по данным экспертов ВОЗ, в 1000 раз выше после патологической беременности, чем после нормальной.
Патологическая анатомия
Макроскопически ХК представляет собой характерные темнокрасного цвета узлы разной величины с очагами кровоизлияний и некроза, напоминающие гематому. При микроскопическом исследовании находят два основных вида клеточных элементов: клетки Лангханса и синцития с резко выраженным полиморфизмом.
ХК обладает определенными функционально-морфологическими особенностями, отличающими ее от других злокачественных опухолей:
- отсутствие собственных сосудов;
- способность расплавлять стенки сосудов матки;
- способность вырабатывать антикоагуляционный фактор;
- способность продуцировать хорионический гонадотропин (ХГ).
Указанные особенности являются ключевыми в понимании клинической семиотики ХК, причин преимущественно гематогенного метастазирования, специфики методов диагностики.
ВОЗ предложила следующие гистологические определения вариантов ТБ.
Пузырный занос — общий термин. Наряду с простым и пролиферирующим различают полный и частичный ПЗ. Полный ПЗ характеризуется отсутствием плода. Частичный ПЗ отличается наличием плода с участком нормальных ворсин.
Инвазивный пузырный занос — опухолевидный процесс с инвазией миометрия, характеризующийся гиперплазией трофобласта с сохранением структуры ворсин.
Трофобластическая опухоль плацентарного места — возникает из трофобласта плацентарного ложа, бывает низкой и высокой степени злокачественности.
Реакция плацентарного места — термин, используемый для обозначения состояния при обнаружении воспалительных клеток в области ложа плаценты. Синоним — «синцитиальный эндометрит».
Таблица 10
Особенности проявления опорных симптомов при хориокарциноме и пузырном заносе
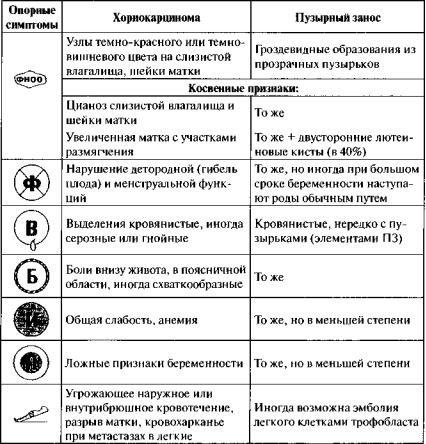
Клиника и диагностика
Ведущим опорным симптомом, наблюдаемым почти в 100% случаев различных видов ТБ, являются выделения кровянистого характера: у 25% больных — в ближайшее время после родов, аборта, выкидыша или пузырного заноса; после длительной задержки — у 50% пациентов; в других случаях — в межменструальном периоде или длительно продолжающиеся. В промежутке между кровотечениями у многих больных можно наблюдать серозные или гнойные выделения, что связано с особенностями кровоснабжения, некрозом, распадом и инфицированием опухолевых узлов. Могут быть болевые ощущения внизу живота и в поясничной области, иногда схваткообразные боли, связанные с присутствием инородных масс в полости матки или угрозой перфорации.
Общие симптомы ХК обусловлены интоксикацией и анемизаци- ей больных. Опосредованную группу симптомов составляют ложные признаки беременности, связанные с выработкой ХГ. Промедление с диагностикой приводит к серьезным осложнениям (кровотечению), метастазам в легкие и мозг.
Диагностика ТБ базируется на 4 основных методах исследования: клиническом, гистологическом, лабораторном (определение ХГ) и рентгенологическом.
Клиническая диагностика
Предполагает тщательный сбор анамнеза и внимательный гинекологический осмотр. Заподозрить ТБ позволяют цианоз слизистых оболочек влагалища и шейки матки, увеличенная, мягкой консистенции матка. Ультрасонография с высокой достоверностью позволяет установить размеры матки, выявить гомогенную мелкокистозную ткань при отсутствии плода и лютеиновые кисты.
Гистологическая диагностика
Является наиболее надежным методом, позволяющим установить вариант ТБ. Затрудняет морфологическую диагностику недостаточное выскабливание, когда в биопсийный материал попадает лишь некротическая ткань.
К сожалению, еще нередко (более чем в 50% случаев) при первом выскабливании в связи с маточным кровотечением, возникающим после родов или абортов, полученный соскоб на гистологическое исследование не направляется, а результаты повторного исследования могут быть ложноотрицательными.
Следует помнить:
во всех случаях материал после выскабливания полости матки, проводимого с лечебной или иной целью, не выбрасывается, а направляется в патогистологическую лабораторию!
Биологический и иммунологический методы диагностики
Определение ХГ, являющегося надежным маркером, имеет наибольшее практическое значение. Именно это исследование позволяет осуществлять раннюю диагностику ТБ, контролировать проведение химиотерапии, определять сроки лечения и решать вопрос о возможности иметь новую беременность. Для определения ХГ используются биологические и иммунологические методы исследования мочи и крови. Первые проводят на лягушках, мышах или кроликах (реакции Галли-Майнини, Ашгейма—Цондека, Фридмана). Чувствительность иммунологического и радиоиммунологического тестирования немного выше чувствительности биологических методов.
Рентгенологический метод
Среди диагностических исследований занимает особое место. Рентгенография органов грудной клетки при подозрении на ХК является обязательным исследованием и повторяется через каждые 3 недели для контроля за динамикой заболевания.
Гистерография может быть полезной при отрицательных данных гистологического исследования соскоба из полости матки.
Лечение
Оперативное вмешательство, независимо от возраста больной, не должно предшествовать химиотерапии, если для этого нет ур- гентных показаний. Положительные результаты химиотерапии у большинства больных достигаются даже при диссеминированных формах заболевания. В настоящее время практически у всех женщин, перенесших различные виды ПЗ и неметастатические формы ХК, могут быть восстановлены менструальная и детородная функции. Однако рекомендации в отношении беременности можно давать не ранее чем через 2—3 года.
Лечение больных с пузырным заносом актиномицином D предпочтительнее терапии метотрексатом. Токсическое действие метотрексата может быть уменьшено одновременным назначением фолиевой кислоты. Полихимиотерапия расширяет возможности лечения ХК. Наиболее широкое применение получила схема MAC (метотрексат, актиномицин D, циклофосфан).
