Значение оксидоредуктаз в системе внутриклеточного метаболизма
Все внутриклеточные реакции органических веществ, процессы анаболизма и катаболизма тесно интегрированы в систему метаболизма. Регуляторные особенности метаболической системы проявляются в ее способности координировано изменять величины субстратных потоков и концентраций интермедиатов в изменяющихся условиях, так чтобы в клетке поддерживалось стационарное состояние ключевых метаболитов и основных физиологических характеристик.
Наиболее информативными показателями внутриклеточного метаболизма являются оксидоредуктазы. Это связано с тем, что основными переносчиками электронов в клетке являются пиридиновые нуклеотиды, а отсюда активное участие оксидоредуктаз в биоэнергетических процессах. Кроме того, оксидоредуктазы, участвуя в направленной координации сопряженных метаболических потоков, в значительной степени обусловливают адаптивные изменения внутриклеточного обмена веществ.
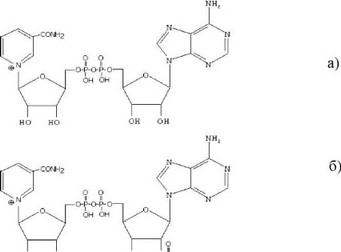
К классу оксидоредуктаз относят ферменты, катализирующие окислительно-восстановительные реакции. Подклассы оксидоредуктаз определяются типами соединений, которые выступают в качестве доноров электронов. Так, оксидоредуктазы катализируют окисление гидроксигрупп (подкласс 1), карбонильных групп (подкласс 2) и т.д. В рамках подклассов оксидоредуктаз выделяют подподклассы, которые характеризуются типами соединений, определяемых в качестве акцепторов электронов. Например, к подподклассу 1 относят ферменты, катализирующие реакции окисления-восстановления с участием никотинамиддинуклеотида (НАД) или близкого аналога, у которого 2’-гидроксигруппа аденилатного фрагмента фосфорилирована - никотинамиддинуклеотидфосфат (НАДФ) (рис. 55). Данный подподкласс оксидоредуктаз называется дегидрогеназами.
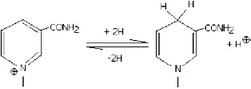
Восстановленные дегидрогеназами никотинамидные коферменты отличаются от окисленных форм по производной никотиновой кислоты (рис. 56). Дегидрогеназами также называют ферменты, которые в своих реакциях используют флавиновые кофакторы: флавинадениндинуклеотид (ФАД) и флавинмононуклеотид (ФМН) (рис. 57). При этом рядом авторов выделяется следующая закономерность: если биологически значимо окисление органического субстрата, то в реакции чаще всего участвует НАД+, если же реакция этого подподкласса имеет значение для восстановления какого-либо органического соединения, то чаще всего восстановителем является НАДФН.
НО НО ОН 0-fjgt;-0H
он
Рис. 55. Структура никотинамиддинуклеотида (а) и никотинамид- динуклеотидфосфата (б).
НАД+ НАДН
НАДФ+ НАДФ
Рис. 56. Восстановление никотинамиддинуклеотида и никотинамид- динуклеотидфосфата.
Биохимические реакции в клетке организованы в систему метаболических процессов. Причем, метаболические процессы представляют собой как циклы, в которых процесс начинается с участием интермедиата, регенерируемого в последней реакции цикла, так и цепи, не приводящие к образованию какого-либо исходного компонента.
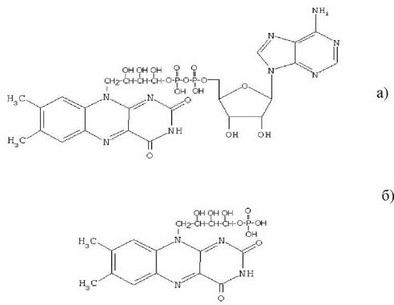
Рис. 57. Структура флавинадениндинуклеотида (а) и флавинмоно- нуклеотида (б).
Интеграция путей и циклов в систему метаболизма определяется следующим:
- Наличием общих промежуточных интермедиатов в большей части метаболических путей.
- Возможностью взаимопревращений через общие метаболиты.
- Использованием общих коферментов и необходимостью их постоянной циркуляции.
- Наличием общего пути катаболизма и единой системы освобождения и использования энергии (дыхательная цепь).
- Наличием сходных механизмов регуляции.
В клетках контроль за этапами метаболизма осуществляется путем разделения метаболических процессов по отдельным компартментам. На рис. 58 представлена схема компартментализации внутриклеточных метаболических процессов, наиболее общие закономерности которой можно представить следующим образом:
- Метаболические взаимопревращения и биологический синтез преимущественно осуществляются в цитоплазме. НАДФН, необходимый для реакций восстановления, образуется также в цитоплазме в пентозофос- фатном цикле.
- Окислительные реакции, связанные с дыханием, протекают в митохондриях. В качестве коферментов обычно используются НАД+ и флаво- протеины.
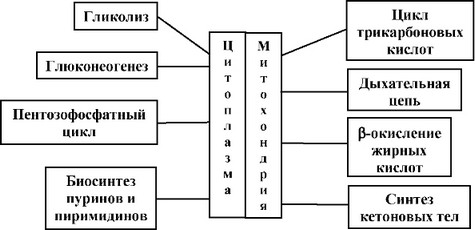
Рис. 58. Компартментализация основных внутриклеточных процессов.
Кроме того, в настоящее время констатируется, что ферменты, функционально объединенные в едином метаболическом пути, способны образовывать упорядоченные мультиферментные ансамбли, называемые мета- болонами. Характерными чертами метаболонов являются их тесная ассоциация с субклеточными структурами, а также высокая степень лабильности, что препятствует их обнаружению и выделению. Биохимическая значимость метаболона определяется в повышении общей скорости метаболического процесса в связи с уменьшением времени диффузии метаболических интермедиатов к активным центрам ферментов, в компартментали- зации процесса, препятствующей нежелательному вовлечению субстратов в другие метаболические пути или циклы, а также в возможности управления метаболическим процессом как единым целым.
Однако ключевую роль в регуляции интенсивности субстратных потоков по метаболических путям и циклам определяют именно ферменты. В связи с этим, мы рассмотрим химизм ферментативных реакций и метаболическое значение ряда оксидоредуктаз, активность которых исследуется нами в лимфоцитах крови.
Глюкозо-6-фосфатдегидрогеназа (Г6ФДГ, КФ 1.1.1.49) - осуществляет дегидрирование глюкозо-6-фосфата и кофермента НАДФ. Образовавшийся в ходе данной реакции 6-фосфоглюконо-5-лактон является нестабильным и гидролизуется либо спонтанно, либо с помощью фермента 6-фосфоглюконолактоназы с образованием 6-фосфоглюконата.
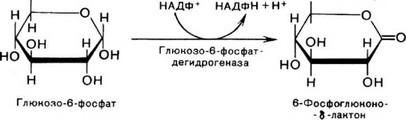
СН20Р03Н2
сн2оро3н2
Г6ФДГ катализирует инициализирующую и ключевую реакцию пен- тозофосфатного цикла. В норме доля пентозофосфатного цикла в количественном превращении глюкозы обычно невелика и варьирует в зависимости от типа ткани и функционального состояния клеток. У человека активность пентозофосфатного цикла относительно высока в печени, надпочечниках, эмбриональной ткани, активированных иммунокомпетентных клетках и молочной железе в период лактации. Пентозофосфатный цикл имеет важное значение для системы внутриклеточного метаболизма. Он поставляет восстановленные НАДФН для реакций биосинтеза жирных кислот, холестерина и др. За счет пентозофосфатного цикла приблизительно на 50 % покрывается потребность клеток в НАДФН. Кроме того, продуктами пентозофосфатного цикла являются также различные пентозофосфаты, которые необходимы для реакций синтеза нуклеиновых кислот и ряда ко- ферментов.
Глицерол-3-фосфатдегидрогеназа (Г3ФДГ, КФ 1.1.1.8) - НАД-
в реакциях липидного обмена. В реакциях синтеза липидов Г3ФДГ осуществляет образование глицеро-3-фосфата из диоксиацетонфосфата, в то время как последний генерируется в реакциях гликолиза и глюконеогенеза. В то же время, образовавшийся в реакциях липидного катаболизма глице- рол-3-фосфат переводится на реакции анаэробного окисления глюкозы с помощью Г3ФДГ. На примере некоторых тканей доказана возможность образования комплекса Г3ФДГ с альдолазой. Причем установлено, что альдолаза связывается только с активным димером дегидрогеназы, увеличивая при этом активность фермента.
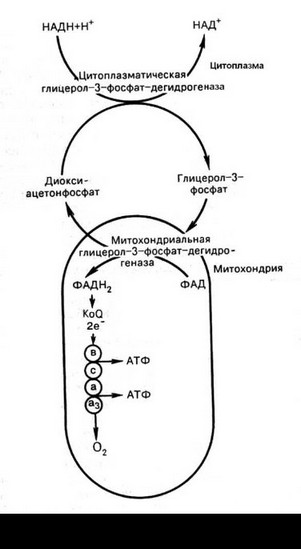 Синтезированный в цитоплазме НАДН не способен сам проникать через митохондриальную мембрану. Однако электроны НАДН способны включаться в дыхательную цепь с помощью а-
Синтезированный в цитоплазме НАДН не способен сам проникать через митохондриальную мембрану. Однако электроны НАДН способны включаться в дыхательную цепь с помощью а-
глицерофосфатного водородного шунта (рис. 59).
Цитоплазматический НАДН сначала реагирует с диоксиацетонфосфатом, образуя глицерол-3-фосфат. Реакция катализируется НАД-зависимой цитоплазматической Г3ФДГ. Образовавшийся глицерол-3- фосфат легко проникает через митохондриальную мембрану. Внутри митохондрии другая (митохондриальная ФАД-зависимая) Г3ФДГ окисляет глицеро-3- фосфат до диоксиацетон- фосфата. ФАДН2 вводит приобретенные им электроны на уровне коэнзима Q в систему дыхательной цепи, а диоксиацетонфос- фат выходит из митохондрий в цитоплазму, где снова взаимодействует с НАД-зависимой Г3ФДГ.
Наибольшая значимость системы а-глицеро фосфатного шунта выявляется в метаболизме скелетных мышц и клетках мозга.
Лактатдегидрогеназа (ЛДГ, КФ 1.1.1.27) - фермент гликолитиче- ского цикла, обратимо катализирующий окисление лактата в пировино- градную кислоту с участием в качестве кофермента НАД. В варьирующих количествах ЛДГ содержится во всех органах и тканях организма; наибольшая ее активность отмечается в гладкой и поперечно-полосатой мускулатуре, печени, почках и форменных элементах крови. Установлено существование 5 изоферментов ЛДГ, различающихся по сочетанию составляющих ее полипептидных цепей; для разделения изоферментов обычно пользуются электрофорезом на ацетатцеллюлозных пленках. Каждый изофермент представляет собой тетрамер, состоящий из субъединиц двух типов. За синтез этих двух субъединиц отвечают разные гены, уровень активности которых различен в разных тканях. Именно за счет изо- ферментного спектра и осуществляется контроль за интенсивностью субстратного потока по гликолизу. В тканях с аэробным метаболизмом преобладают изоферменты ЛДГ, которые чувствительны к пирувату. Данные изоферменты ЛДГ ингибируются даже небольшим количеством пирувата, что препятствует образованию лактата и приводит к более полному окислению пирувата через образование ацетил-КоА в цикле трикарбоновых кислот. В тканях с преимущественно анаэробным дыханием выявляется изоферментный спектр ЛДГ, который не ингибируется пируватом (во всяком случае, в низких концентрациях).
ЛДГ занимает ключевое положение в регуляции цитоплазматического уровня НАДН/НАД. В случае избытка НАДН в цитоплазме ЛДГ восстанавливает пируват до лактата, который затем удаляется из клетки (анаэробная реакция ЛДГ). В то же время, при активации аэробных процессов ЛДГ может окислять лактат до пирувата с образованием НАДН (аэробная реакция ЛДГ). В этом случае, пируват, образовавшийся при окислении лактата, в основном через пируватдегидрогеназный комплекс поступает на реакции цикла трикарбоновых кислот (митохондриальный компартмент).
Малатдегидрогеназа (МДГ, КФ 1.1.1.37) - фермент, катализирующий обратимое окисление малата в оксалоацетат. Фермент локализуется как в митохондриях (цикл трикарбоновых кислот), так и в цитоплазме. В
- 130 -
Отредактировал и опубликовал на сайте
митохондриях уровень соотношения НАДН/НАД относительно велик, в результате чего внутримитохондриальным оксалоацетат легко восстанавливается в малат, который легко выходит из митохондрий. В цитоплазме уровень отношения НАДН/НАД мал, что приводит к окислению малата при участии цитоплазматической НАД-зависимой МДГ.
МДГ принимает участие в реакциях азотного обмена. Одним из ключевых интермедиатов азотного обмена является аспартат, который синтезируется в результате трех сопряженных реакций. В ходе первой реакции фумарат под действием фумаразы присоединяет воду и превращается в малат. Во второй реакции малат под действием МДГ окисляется до окса- лоацетата, который в третьей реакции - в реакции трансаминирования с глутаматом преобразуется в аспартат.
Кроме того, МДГ принимает самое активное участие в работе малат- аспартатного водородного шунта митохондрий (рис. 60). Данная система работает благодаря наличию МДГ и аспартатаминотрансферазы как цитоплазме, так и в митохондриях. Водородный шунт работает следующим образом. Сначала водород от синтезированного в цитоплазме НАДН переносится на цитоплазматический оксалоацетат. В результате образуется малат, который с помощью системы, транспортирующей дикарбоновые кислоты, проходит через внутреннюю мембрану митохондрий в матрикс. В матриксе митохондрий с помощью МДГ малат окисляется в оксалоацетат, а мат- риксный НАД+ восстанавливается до НАДН, который может передавать свои электроны в дыхательную цепь, локализованную на внутренней мембране митохондрий. В свою очередь образовавшийся оксалоацетат в присутствии глутамата и аспартатаминотрансферазы вступает в реакцию тран- саминирования. Образовавшиеся в результате данной реакции а- кетоглутарат и аспартат с помощью специальных транспортных систем способны проходить через мембрану митохондрий.
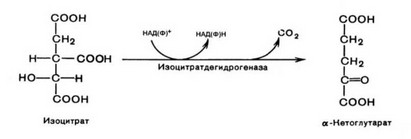
В митохондриях существует два типа изоцитратдегидрогеназ. НАД-зависимая изоцитратдегидрогеназа (НАДИЦДГ, КФ 1.1.1.41) выявляется только в митохондриальном компартменте, в то время как НАДФ- зависимая изоцитратдегидрогеназа (НАДФИЦДГ, КФ 1.1.1.42) выявляется как в митохондриях, так и в цитоплазме. НАДИЦДГ осуществляет третью реакцию в цикле трикарбоновых кислот, которая, по-видимому, является лимитирующей. В ходе изоцитратдегидрогеназной реакции также осуществляется декарбоксилирование изолимонной кислоты. Специфическим активатором НАДИЦДГ является АДФ, ингибиторами фермента являются АТФ и НАДН. Кроме того, изоцитратдегидрогеназе для осуществления ферментативной активности необходимы ионы магния и марганца.
Одним из наиболее важных ферментов цикла трикарбоновых кислот является сукцинатдегидрогеназа (СДГ, КФ 1.3.99.1), активность которой оказывает существенное влияние на интенсивность субстратного потока по лимонному циклу. СДГ катализирует 6 реакцию цикла Кребса, в которой сукцинат дегидрируется в фумаровую кислоту. Кофактором СДГ является ФАД, ковалентно связанный с молекулой
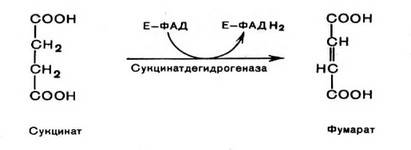
фермента. При этом, сама СДГ прочно связана с внутренней мембраной митохондрий. Восстановленный ФАДН2 передает электроны непосредственно на дыхательную цепь через ^Q. Установлено, что аллостериче- ским ингибитором СДГ является оксалоацетат.
Глутаматдегидрогеназа осуществляет окислительное дезаминирование L-глутаминовой кислоты. В качестве кофермента глутаматдегидрогеназа использует НАД (НАДГДГ, КФ 1.4.1.2) или НАДФ (НАДФГДГ, КФ 1.4.1.4). Реакция включает анаэробную фазу дегидрирования глутаминовой кислоты с образованием промежуточного продукта - иминоглутаровой кислоты, после чего осуществляется спонтанный гидролиз с образованием аммиака и а-кетоглутаровой кислоты (рис. 61). Ферментативные реакции глутаматдегидрогеназ являются обратимыми, соответственно аммиак в присутствии НАД(Ф)Н и а-кетоглутаровой кислоты может участвовать в синтезе глутамата. Глутаматдегидрогеназа является одним из наиболее изученных ферментов азотистого метаболизма. Глутаматдегидрогеназа является олигомерным ферментом с молекулярной массой 312000, который состоит из 6 субъединиц. Фермент проявляет свою актив ность только в мультимерной форме. При диссоциации глутаматдегидрогеназы на субъединицы, которая происходит в присутствии НАДН, ГТФ и ряда стероидных гормонов, фермент теряет способность осуществлять окислительное дезаминирование глутаминовой кислоты, но приобретает способность осуществлять дезаминирование ряда других аминокислот. Подобная особенность характеризует аллостерический механизм регуляции глутаматде- гидрогеназы и определяет данный фермент как регуляторный в системе аминокислотного обмена.
Таким образом, НАД(Ф)- и ФАД-зависимые дегидрогеназы находятся на ключевых позициях внутриклеточного метаболизма. Представленные дегидрогеназы локализуются в различных компартментах клетки и вовлечены в функционирование разных метаболонов. Их активность определяет как ряд основных пластических процессов (синтез аминокислот, нуклеотидов, липидов и т.д.), так анаэробные и аэробные дыхательные реакции.
А так же в разделе «Значение оксидоредуктаз в системе внутриклеточного метаболизма »
- Особенности метаболизма клетки в норме и при патологии
- Энергетическое звено метаболизма
- Пластическое звено метаболизма
- Утилизации продуктов метаболизма
- Метаболические механизмы реактивности клеток иммунной системыИзменение метаболизма в лимфоцитах в процессе их функционирования в норме и при патологии
- Метаболизм гранулоцитов и макрофагов в состоянии относительного покоя и при фагоцитозе
- 2.4. Роль витаминов в системе клеточного метаболизма Межвитаминные взаимоотношения
- Глава 3 ВИТАМИНЫ И НАРУШЕНИЯ ФУНКЦИИ ИММУННОЙ СИСТЕМЫ
- Витаминная недостаточность и их клинические проявления
- Клиническая картина гиповитаминозов Гиповитаминоз A
- Гиповитаминоз В1
- Гиповитаминоз В2
- Гиповитаминоз В6
- Г иповитаминоз фолиевой кислоты (В9)
- Гиповитаминоз В12
- Гиповитаминоз C
- Гиповитаминоз D
- Гиповитаминоз E
- Недостаточность карнитина
- Лабораторные методы исследования витаминов Определение аскорбиновой кислоты в моче по Тильмансу
- Определение рибофлавина (витамина В2) в крови по Берчугу, Бессею и Лоури
- Определение рибофлавина (витамина В2) в моче по Е.М. Масленниковой и Л.Г. Г воздовой
- Определение 4-пиридоксиловой кислоты в моче по Хуффу и Перлцвейгу
- 3.4.8. Определение токоферола (витамина Е) в крови в модификации Фридемана